芥蓝小孢子培养研究初报
2016-05-30李桂花王亭亭刘凯陈汉才张艳黎庭耀蓝华生
李桂花 王亭亭 刘凯 陈汉才 张艳 黎庭耀 蓝华生


摘 要 对40份芥蓝材料进行游离小孢子培养及植株再生研究。结果表明:不同基因型间胚状体诱导率差异显著,其中只有红脚黄花芥蓝×612、孤老种、黄花芥蓝、绿宝、香港中花芥蓝产生胚状体;日照时间为11~12 h的供试植株的胚状体诱导率是日照时间为5~6 h的3~7倍;采用单核靠边期至双核早期的小孢子进行胚状体诱导效果最佳,此时花蕾大小为3.0~4.5 mm;在32.5 ℃下高温预处理小孢子24 h诱导效果最佳,其他温度时间组合条件下胚状体诱导率降低65%~100%。
关键词 芥蓝;游离小孢子培养;胚状体诱导率;植株再生
中图分类号 S635 文献标识码 A
Abstract Forty varieties of Chinese Kale were isolated for the study of microspore culture and plant regeneration. The results showed that: embryogenic rate among different genotypes was significantly different, among which only red foot flower kale × 612, the solitary species, yellow broccoli, Emerald and Hong Kong flower kale generated embryos; the embryogenic rate of the plant with 11-12 hours of sunshine was 3-7 times of those with 5-6 hours of sunshine; the late unicellular to early dual-core sidelined microspores had the best embryogenic rate when the bud size was 3.0-4.5 mm; the microspore with heat pretreatment at 32.5 ℃ for 24 hours had the best embryoid induction ability, while at other combinations of time and temperature, embryogenic rate decreased 65%-100%.
Key words Chinese Kale; Isolated microspore culture; Percentage of embryogenic; Plant regeneration
doi 10.3969/j.issn.1000-2561.2016.08.013
芥蓝(Brassica alboglabra)是十字花科芸薹属的甘蓝类蔬菜作物,是中国南方特色蔬菜作物之一[1]。芥蓝通过常规杂交再经过连续自交纯化获得纯合品系通常需要5~8 a的时间[2]。而采用游离小孢子培养技术获得基因型纯合的双单倍体只需要1~2 a时间,遗传上非常稳定,不仅可以缩短育种年限,而且可以提高基因组合选择效率。小孢子培养是指直接从花蕾或花药中获得游离的或新鲜的小孢子群体而进行培养,经由胚状体的诱导,再生出完整的单倍体植株,然后经过自发或诱发染色体加倍,成为正常可育、纯合的二倍体植株的过程[3]。影响小孢子培养的因素很多,包括内在因素(如供体材料的生理状况和基因型等)和外部因素(如供体植株生长环境、取材时间、培养方法等)[4]。张丽等[5]、朱允华等[6]、王超楠[7]分别研究了影响春白萝卜、菜心、小白菜游离小孢子胚状体产生的因素。王春丽等[8]、周志国等[9]对萝卜的游离小孢子培养技术进行了研究,栗根义等[10]、陈晓峰等[11]、张亚丽[12]对大白菜的游离小孢子培养技术进行了研究,均获得了纯合双单倍体植株。
国内外已有许多学者对十字花科芸薹属作物的游离小孢子培养开展了研究。Duijs等[13]和严准等[14]分别首次报道了抱子甘蓝和球茎甘蓝游离小孢子培养获得成功并得到再生植株。边立娜等[15]、佟智慧[4]分别对青花菜进行游离小孢子培养,研究了影响胚状体发生和植株再生的各种因素。张娜等[16]、姜凤英[17]分别对黄花芥蓝、羽衣甘蓝胚状体发生及植株再生的影响因素进行了探究。对芥蓝小孢子培养成功的报道最早在1991年[18]。何杭军等[19]、赵前程等[20]、Ferrie等[21]先后对芥蓝游离小孢子培养中诱导胚状体的发生及植株再生进行了探讨。利用游离小孢子培养技术有助于快速培养出纯合品系,但相对于其他芸薹属植物而言,目前关于芥蓝游离小孢子培养的报道比较少,还没有建立普遍适用的方法,无法直接将芥蓝种质资源中的优异种质资源进行挖掘与利用。因此,本研究在前人的基础上进行多个不同芥蓝品种游离小孢子培养试验,利用游离小孢子培养技术可创造芥蓝纯合双单倍体,加速芥蓝育种进程,缩短育种时间。
1 材料与方法
1.1 材料
红脚黄花芥蓝×612、凌桂迟芥蓝、孤老种、早35天芥蓝筷等40份优质丰产的不同芥蓝材料,于2014年9月28日播种于广东省农业科学院蔬菜研究所白云基地,如表1所示。
1.2 方法
1.2.1 培养基的种类和保存及小孢子培养过程
将B5液体、固体培养基,MS固体培养基以及1/2MS固体培养基配制完成后置于120 ℃高压灭菌锅消毒20 min,冷却后置于4 ℃冰箱中保存备用。NLN液体培养基需在超净工作台上用过滤器进行过滤灭菌,分装在三角瓶中,封口保存。
1.2.2 统计方法 胚状体诱导率=胚状体数/花蕾数×100%
1.2.3 芥蓝游离小孢子培养方法 于晴天上午9:00~10:00采样,选择处于盛花期的供体植株采集花蕾,取单核靠边期的花蕾;用75%乙醇消毒30 s,再用8%次氯酸钠灭菌15 min,用无菌水冲洗3次,每次5 min;往研钵中加入适量B5液体培养基,用研棒轻轻挤压花蕾,使小孢子从花药中游离到B5液体培养基中,重复2次,每次均取下层沉淀;第3次离心时加入NLN培养基代替B5液体培养基,用NLN培养基分装于小培养皿中,用封口膜封口。
将封口的培养皿先于32.5 ℃暗培养24 h,再转至25 ℃继续进行暗培养,一般2~3周出现胚状体;将胚状体移入MS固体培养基,待形成胚状体后再转到MS培养基中继代;将继代后长出的小苗转移至1/2MS固体培养基上进行生根培养,最终获得生长健壮的再生植株。
1.2.4 影响芥蓝胚状体诱导率因素的试验
(1)基因型的影响。采用40份不同的芥蓝材料进行游离小孢子培养,每个芥蓝材料采100个花蕾,所接培养皿数为14皿。
(2)供体生理状况的影响。选择生长在同一塑料大棚、长势良好且相近的供体材料,将其中一半植株在每天中午12:00套上白色不透明纸袋(相当于日照时间为5~6 h),另一半植株在正常光照条件下生长(相当于日照时间为11~12 h);一个星期后,在处理过的植株与自然受光植株上分别取蕾进行游离小孢子培养,每个芥蓝品种采用100个花蕾,所接培养皿数为14皿。
(3)小孢子发育时期的影响。分别采用单核早期、单核靠边期、双核早期及双核晚期等4个不同发育时期的小孢子进行游离小孢子培养,每个芥蓝品种采100个花蕾,所接培养皿数为14皿。
(4)高温预处理的影响。将培养皿分装完成后分别置于25、30、32.5、35 ℃ 4种不同温度下处理24 h,在32.5 ℃温度条件下分别处理24、48、72 h,每个芥蓝品种采用100个花蕾,所接培养皿数为14皿。
2 结果与分析
2.1 供体基因型对小孢子胚状体状体发生的影响
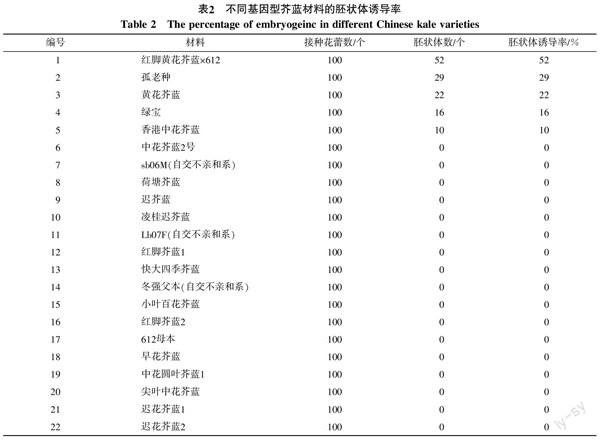
2.1.1 不同基因型芥蓝胚状体诱导率 试验结果如表2所示,不同基因型的芥蓝胚状体诱导率存在很大差异。在用于游离小孢子培养的40份不同基因型芥蓝材料中,有5份材料成功产生胚状体,分别是红脚黄花芥蓝×612、孤老种、黄花芥蓝、绿宝和香港中花芥蓝。这5份材料的胚状体诱导率也相差较大,最高胚状体诱导率达52%,最低胚状体诱导率为10%。而迟花芥蓝、红脚芥蓝、四季粗条等35种芥蓝皆没有产生胚状体。可见基因型对芥蓝胚状体诱导率有重大影响。图1-A~F为芥蓝游离小孢子培养中从诱导出胚状体到形成再生植株的过程。
2.1.2 芥蓝小孢子培养的植株倍性鉴定 对培养出来的植株,在移栽前用醋酸洋红染色法进行倍性鉴定。取100 mL 45%醋酸加热至沸,移去火源,加入1 g洋红,加热回流2~24 h,过滤,加几滴2%的铁明矾,制成1%醋酸洋红;取少许根尖于载玻片上,加1~2滴醋酸洋红溶液,盖上盖玻片;将制片放在显微镜下观察。从图2最左侧一个细胞中可以看出染色体条数为9,而芥蓝是属于十字花科芸薹属CC染色体组,染色体为2n=18,9条染色体说明该植株是单倍体,用0.1%的秋水仙碱浸根10 h,再移栽至田间或花盆中栽培。
2.2 供体生理状况对胚状体诱导率发生的影响
试验结果如表3所示,日照时间为11~12 h的供体植株小孢子胚状体诱导率明显高于日照时间为5~6 h的供体植株小孢子胚状体诱导率。日照时间为11~12 h的供体植株小孢子胚状体诱导率最高为红脚黄花芥蓝×612(58%),最低为香港中花芥蓝(8%);日照时间为5~6 h的供体植株小孢子胚状体诱导率最高为红脚黄花芥蓝×612(12%),最低为香港中花芥蓝(2%)。据统计,日照时间为11~12 h的供试植株的胚状体诱导率是日照时间为5~6 h的3~7倍。日照时间为11~12 h的5份芥蓝材料的胚状体诱导率均高于日照时间为5~6 h的胚状体诱导率。可见日照时间对胚状体诱导率具有明显的影响。
2.3 小孢子发育阶段对小孢子胚状体诱导率的影响
选取处于盛花期的植株采集花蕾,用醋酸洋红染色法在显微镜下观察小孢子的形态,判断小孢子所处的时期。结果如图3、图4所示。
采用红脚黄花芥蓝×612、孤老种、黄花芥蓝、绿宝和香港中花芥蓝5个芥蓝材料不同发育阶段的小孢子分别进行游离小孢子培养试验,结果如表4所示。单核靠边期和双核早期的胚状体诱导能力强,单核靠边期的胚状体诱导率最高的是红脚黄花芥蓝×612(52%),最低的是香港中花芥蓝(12%);双核早期的胚状体诱导率最高的是红脚黄花芥蓝×612(54%),最低的是香港中花芥蓝(10%)。而单核早期和双核晚期的胚状体诱导能力明显降低,单核早期的红脚黄花芥蓝×612小孢子胚状体诱导率为6%,而香港中花芥蓝胚状体诱导率为1%;双核晚期红脚黄花芥蓝×612的胚状体诱导率为2%,孤老种、黄花芥蓝、绿宝、香港中花芥蓝胚状体诱导率均为0。芥蓝不同发育阶段的胚状体诱导率差异明显,单核靠边期和双核早期的胚状体诱导率高,而单核早期和双核晚期的胚状体诱导率低。 结合芥蓝小孢子形态及花蕾大小的相关性推测,芥蓝的花蕾大小为3.0~3.5 mm时处于单核靠边期,也属于单核晚期;介于4.0~4.5 mm时,小孢子发育时期处于双核期,双核还未分开,属于双核早期,选择这2个阶段的花蕾作为小孢子培养,效果最佳。
2.4 高温预处理对小孢子胚状体发生的影响
比较不同温度(25、30、32.5、35 ℃)的高温预处理对小孢子胚状体发生的影响。试验结果如表5显示,对于材料红脚黄花芥蓝×612和孤老种,32.5 ℃处理24 h时胚状体产量分别为59个和30个;在30 ℃条件下培养的胚状体诱导率均明显低于经过热激处理的,胚状体产量分别为12个和6个,分别比在32.5 ℃处理条件下降低了79.7%和80.0%;25 ℃条件下恒温培养的小孢子没有发生分化;35 ℃高温处理的芥蓝胚状体产量分别为9个和4个,较32.5 ℃处理条件下降低了84.7%和86.7%。结果表明,32.5 ℃条件下处理24 h最有利于胚状体的形成。
在32.5 ℃条件下分别处理24、48、72 h,比较不同时间下的高温预处理对小孢子胚状体发生的影响,试验结果如表6所示。对于材料红脚黄花芥蓝×612和孤老种,处理24 h时胚状体产量分别为56个和26个;处理48 h时胚状体产量分别为11个和9个;处理72 h的小孢子没有发生分化。结果表明,高温预处理时间长短对胚状体发生影响显著,处理时间过短效果不明显,本次试验表明处理24 h左右最为适合。
3 讨论与结论
3.1 基因型对芥蓝游离小孢子培养的影响
不同基因型材料对芥蓝游离小孢子培养中胚状体的形成影响显著,主要体现在胚状体数量多少上。将40份芥蓝材料在相同的条件下进行游离小孢子培养,只有红脚黄花芥蓝×612、孤老种、黄花芥蓝、绿宝、香港中花芥蓝等5份材料有胚状体产生。严准等[14]、张德双等[22]在小孢子培养研究中也仅有个别基因型材料被诱导出胚状体。李梅等[3]提出甘蓝类蔬菜胚状体诱导率是一种受基因调控的遗传特性。说明即使在合适的条件下也并非所有基因型都适于游离小孢子培养,因此需要筛选出能够通过游离小孢子培养产生胚状体的芥蓝。另外,基因型差异还表现在胚状体诱导率上,红脚黄花芥蓝
×612小孢子胚状体诱导率是香港中花芥蓝的5.2倍。
3.2 供体生理状况对芥蓝游离小孢子培养的影响
供体生理状况与小孢子胚状体诱导率关系密切。通过改变供体植株的日照时间来改变供体生理状况,日照时间为11~12 h的芥蓝供体植株小孢子胚状体发生能力明显强于日照时间为5~6 h的供体植株小孢子胚状体发生能力,日照时间为11~12 h的供试植株的小孢子胚状体诱导率是日照时间为5~6 h的3~7倍。可见胚状体的诱导率与供体材料的日照长度密切相关。目前没有关于日照时间对芥蓝游离小孢子胚状体诱导率影响的文献报道,需要通过更多研究来验证这一结果。
3.3 小孢子发育阶段对芥蓝游离小孢子培养的影响
采用不同发育阶段的芥蓝小孢子进行培养,胚状体诱导率有较大差异。试验中采用单核靠边期及双核早期的小孢子培养时胚状体诱导率明显较采用单核早期及双核晚期小孢子培养时高,采用单核早期或双核晚期的小孢子进行培养,胚状体诱导率大大降低甚至不能产生胚状体,因此在进行芥蓝小孢子培养时应采用单核靠边期到双核早期的小孢子进行培养。实验结果与赵前程等[20]的研究结果一致。在显微镜下观察,单核靠边期到双核早期的芥蓝花蕾大小为3.0~4.5 mm。
3.4 高温预处理对芥蓝游离小孢子培养的影响
高温预处理对小孢子胚状体诱导率有显著作用。试验结果表明,预处理温度过低不能产生胚状体,温度过高胚状体诱导率大大降低甚至不能产生胚状体,处理时间过长小孢子胚状体诱导率降低或不能产生胚状体。根据实验数据,32.5 ℃条件下对小孢子进行高温预处理24 h最有利于促进胚状体发生。实验结果与赵前程等[20]的研究结果一致。
芥蓝的小孢子培养效率极低,多数材料诱导不出胚状体或胚状体诱导率极低。因此,为解决这一问题,一要加强胚状体发生机理的研究,二要加强小孢子培养条件方面的研究。经大量的试验研究,筛选出能够通过游离小孢子培养技术获得单倍体的芥蓝材料,将其应用于新品种的选育,可大大缩短育种年限,为获得芥蓝新种质资源开拓新的途径。
参考文献
[1] 蒋先明. 各种蔬菜[M]. 北京: 农业出版社, 1989: 54.
[2] 张 娜, 殷家明, 林 呐, 等. 黄花芥蓝游离小孢子培养和植株再生[J]. 贵州农业科学, 2009, 37(12): 43-46.
[3] 李 梅, 孙德岭, 赵前程, 等. 甘蓝类蔬菜游离小孢子培养研究回顾与展望[J]. 天津农业科学, 2004, 10(1): 44-45.
[4] 佟智慧. 青花菜游离小孢子培养技术研究[D]. 福州: 福建农林大学, 2009.
[5] 张 丽, 郑鹏婧. 春白萝卜游离小孢子培养的研究[J]. 北方园艺, 2013(23): 31-33.
[6] 朱云华, 刘明月, 吴朝林. 影响菜心游离小孢子培养的因素[J]. 长江蔬菜, 2003(9): 46-47.
[7] 王超楠. 小白菜游离小孢子培养体系的构建与利用[D]. 沈阳: 沈阳农业大学, 2007.
[8] 王春丽, 姚延兴, 彭 玲. 萝卜游离小孢子培养及胚再生植株研究[J]. 安徽农业科学, 2013, 41(27): 10 919-10 922.
[9] 周志国. 萝卜游离小孢子胚状体状体诱导与植株再生研究[D]. 南京: 南京农业大学, 2007.
[10] 栗根义, 高睦枪, 赵秀山. 大白菜游离小孢子培养[J]. 园艺学报, 1993, 20(2): 167-170.
[11] 陈晓峰, 王承国, 牟晋华, 等. 大白菜游离小孢子培养和植株再生[J]. 山东农业科学, 2014, 46(3): 13-16.
[12] 张亚丽. 大白菜游离小孢子培养技术研究[D]. 咸阳: 西北农林科技大学, 2009.
[13] Duijs J G R, Voorrips E, Visser D L, et al. Microspore culture is successful in most types of Brassica oleracea L.[J]. Euphytica, 1992, 60: 45-55.
[14] 严 准, 田志宏, 孟金陵. 甘蓝游离小孢子培养的初步研究[J]. 华中农业大学学报, 1999, 18(1): 5-7.
[15] 边立娜, 彭永康, 孙德岭, 等. 不同基因型青花菜游离小孢子培养和植株再生[J]. 天津农业科学, 2014, 20(1): 10-12.
[16] 张 娜, 殷家明, 林 呐, 等. 黄花芥蓝游离小孢子培养和植株再生[J]. 贵州农业科学, 2009, 37(12): 43-46.
[17] 姜凤英. 羽衣甘蓝游离小孢子培养体系的构建及应用[D]. 沈阳: 沈阳农业大学, 2006.
[18] Takahata Y, Keller W A. High frequency embryogenesis and plant regeneration in isolated microspore culture of Brassica oleracea L.[J]. Plant Sci, 1991, 74: 235-242.
[19] 何杭军, 王晓武, 王炳良. 芥蓝游离小孢子培养初报[J]. 园艺学报, 2004, 31(2): 239-240.
[20] 赵前程, 李素文, 文正华, 等. 芥蓝游离小孢子培养及植株再生研究[J]. 北方园艺, 2007(9): 4-6.
[21] Ferrie A M R, Keller A. Optimization of methods for using polyethulene glycol as a non-permeating osmoticum for the induction of microspore embryogenesis in the Brassicaceae.[J]. In Vitro Cell Dev Biol-Plant, 2007, 43: 348-355.
[22] 张德双, 曹鸣庆, 秦志伟. 绿菜花游离小孢子培养、胚状体状体发生和植株再生[J]. 华北农学报, 1998, 13 (3): 102-106.
