美迪紫檀素的体外细胞毒性研究
2016-05-30毛旭文朱晓雪高晓黎
赵 静, 毛旭文, 朱晓雪, 高晓黎
(新疆医科大学1药学院; 2基础医学院, 乌鲁木齐 830011)
美迪紫檀素的体外细胞毒性研究
赵静1, 毛旭文2, 朱晓雪1, 高晓黎1
(新疆医科大学1药学院;2基础医学院, 乌鲁木齐830011)
摘要:目的探究美迪紫檀素对正常大鼠心肌细胞H9C2、人胚肝细胞L-02、人胚肾上皮细胞HEK293、大鼠主动脉血管平滑肌细胞VSMC的细胞毒性作用。方法体外培养H9C2、L-02、HEK293、VSMC细胞,加入不同浓度(0.1、1、5、10、50、100、200、250、300 μmol/L)的美迪紫檀素溶液,采用MTT法检测美迪紫檀素对细胞增殖的影响;同时给予1、50、300 μmol/L的美迪紫檀素溶液,利用Hoechst33342荧光染色观察细胞凋亡情况,并考察细胞培养液中乳酸脱氢酶(LDH)、谷草转氨酶(AST)、谷丙转氨酶(ALT)及肌酸激酶(CK)活性的变化。结果与对照组比较,0.1~300 μmol/L浓度下的美迪紫檀素对H9C2细胞增殖和凋亡没有影响,培养液中的LDH、AST、ALT活性无统计学差异(P>0.05)。0.1~300 μmol/L浓度下的美迪紫檀素均可抑制L-02和VSMC细胞增殖,促进细胞的凋亡,并可使培养上清液中的LDH活力增加,L-02细胞培养上清液中AST和ALT活力也增加(P<0.05),在250~300 μmol/L范围内对HEK293细胞有一定的抑制作用,促进其凋亡,并增加LDH活力。美迪紫檀素对L-02和HEK293细胞的抑制作用呈浓度依赖性。结论美迪紫檀素对H9C2细胞生长没有影响,对L-02、VSMC 细胞生长有一定的影响,250~300 μmol/L浓度的美迪紫檀素对HEK293细胞生长有影响。
关键词:美迪紫檀素; H9C2; L-02; HEK293; VSMC; 细胞毒性
美迪紫檀素(Medicarpin,6α,11α-dihydro-9-methoxy-6H-benzofuro(3,2-c) (1)benzopyran-3-ol)是存在于甘草[1]、黄花草木犀[2]、天山岩黄芪[3]、苦马豆[4]、苜蓿[5-6]等新疆常见植物中的一种紫檀烷类化合物,这些植物多分布在草原或者绿洲地带[7]。根据文献报道,美迪紫檀素即使在10-10mol/L的低浓度下也具有骨保护作用[8];对人宫颈癌 HeLa 细胞、人乳腺癌 MCF-7细胞和人肝癌 HepG2细胞等显示抗肿瘤活性[9-12];同时还有抗菌、神经保护及抗雄激素等作用[13],该物质在大鼠体内可被迅速吸收,具有较高的表观分布容积[14]。但目前关于美迪紫檀素的体外安全性研究未见相关报道。为探讨美迪紫檀素的安全性,本研究采用体外培养[15-17]的正常大鼠心肌细胞H9C2、人胚肝细胞L-02、人胚肾上皮细胞HEK293、大鼠主动脉血管平滑肌细胞VSMC,从细胞水平探讨美迪紫檀素对心、肝、肾和血管是否有损伤作用,为其作为活性成分的药物开发提供参考。
1材料与方法
1.1材料与试剂
1.1.1细胞株 大鼠心肌细胞株H9C2(新疆医科大学第一附属医院赠送),人胚肝细胞株L-02(新疆华世丹药物研究有限责任公司赠送),大鼠主动脉血管平滑肌细胞株VSMC、人胚肾上皮细胞株HEK293(中国医学科学院药物研究所国家药物筛选中心赠送)。
1.1.2药物与试剂美迪紫檀素(江苏永健医药科技有限公司,纯度>98%),DMEM培养基(高糖,HyClone),胰蛋白酶(HyClone),优级新生牛血清(HyClone),MTT(Biosharp),Hoechst33342染色试剂(南京凯基生物科技发展公司),LDH、AST、ALT、CK试剂盒均购买于南京建成生物科技有限公司。
1.2方法
1.2.1细胞培养分别取冷冻的H9C2、L-02、HEK293、VSMC细胞,37℃水浴快速复苏,培养在含10% 胎牛血清(FBS)(加有100 IU/L青霉素和100 mg/L链霉素)的DMEM(高糖)培养基中,置于37℃、5% CO2饱和湿度培养箱中培养,每2天换液1次,培养至细胞处于对数生长期时进行实验。
1.2.2MTT法检测美迪紫檀素对细胞增殖的影响收集对数生长期的H9C2、L-02、HEK293、VSMC细胞,以细胞密度为4×104个/mL,接种于96孔板,每孔90 μL,37℃孵育24 h后,分别加入药物浓度为0.1、1、5、10、50、100、200、250、300 μmol/L的美迪紫檀素溶液。每种浓度设6个复孔,对照组为含细胞不加药物的完全培养基,每孔l0 μL,继续孵育72 h。72 h后,取出96孔板,吸弃培养液。每孔加入100 μL的0.5 mg/mL MTT溶液,置于37℃、5% CO2饱和湿度环境中孵育。4 h后吸弃上清液,每孔加入100 μL DSMO振摇15 min,用酶标仪测量各孔570 nm吸光度(OD)值,计算细胞增殖抑制率[18],抑制率(%)=(对照组OD-实验组OD)/对照组OD×100%。
1.2.3Hoechst33342荧光染色法检测细胞凋亡 取对数生长期的H9C2、L-02、HEK293、VSMC细胞,以2×104个/mL浓度接种于96孔板,每孔90 μL。37℃孵育24 h后,给予低浓度(1 μmol/L)、中浓度(50 μmol/L)、高浓度(300 μmol/L)的受试物,0 μmol/L作为对照组,每个浓度设置6个复孔,每孔10 μL,继续培养72 h。72 h后,取出细胞,吸出孔内50 μL上清液,每孔加入100 μL 4% 多聚甲醛溶液,于37℃固定15 min,将上清液全部吸出,用Hoechst 33342染色15 min,每孔加入100 μL PBS清洗2遍,最后加入200 μLPBS,荧光倒置显微镜下观察细胞凋亡情况[19-20]。
2结果
2.1美迪紫檀素对正常细胞的毒性活性作用浓度为0.1~300 μmol/L的美迪紫檀素对大鼠心肌细胞H9C2没有抑制作用(P>0.05);在浓度为0.1~300 μmol/L对人胚肝细胞L-02有一定的抑制作用(P<0.05),且呈剂量依赖性,随美迪紫檀素浓度的增大,抑制作用增强;浓度为0.1~200 μmol/L的美迪紫檀素,对人胚肾上皮细胞HEK293没有抑制作用(P>0.05),在250~300 μmol/L浓度时,有一定的抑制作用(P<0.05),呈剂量依赖性,随美迪紫檀素浓度的增大而抑制作用增强;美迪紫檀素浓度为0.1~300 μmol/L对大鼠主动脉血管平滑肌细胞VSMC均有显著的抑制作用(P<0.01),不具有剂量依赖性,且在浓度为10 μmol/L时,抑制作用最大,见图1~4。
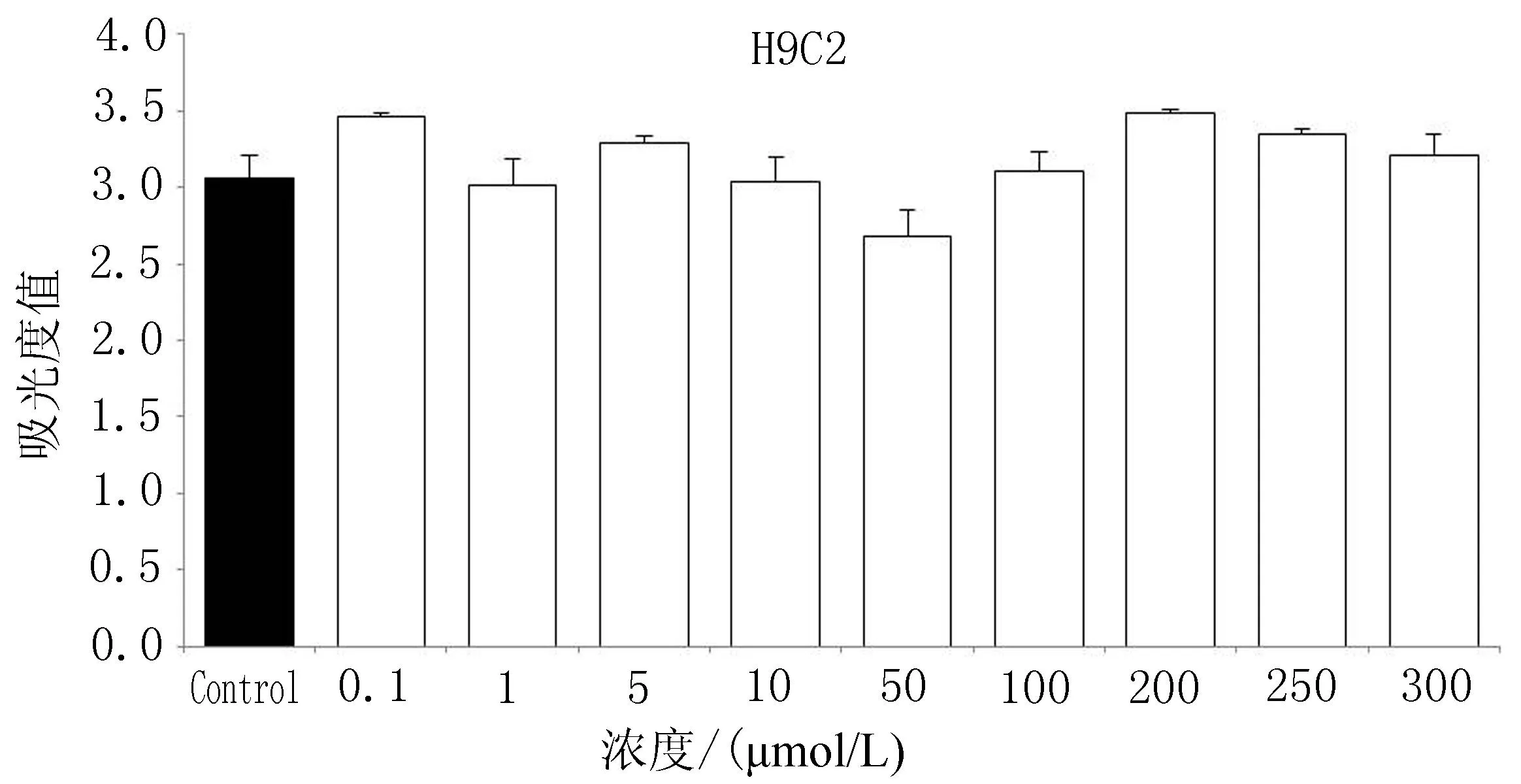

图1美迪紫檀素对H9C2细胞增殖的影响 图2美迪紫檀素对L-02细胞增殖的影响
(注:与对照组比较,*P<0.05,**P<0.01)


图3美迪紫檀素对HEK293细胞增殖的影响 图4美迪紫檀素对VSMC细胞增殖的影响
(注:与对照组比较,*P<0.05,**P<0.01) (注:与对照组比较,**P<0.01)
2.2美迪紫檀素作用下的细胞凋亡情况荧光倒置显微镜下,与对照组细胞相比,H9C2的细胞核完整,染色质均匀分布,较少发生凋亡现象。L-02细胞有凋亡小体(亮白色)出现,且随美迪紫檀素浓度的升高,凋亡小体明显增加。与对照组比较,低浓度组(1 μmol/L)及中浓度组(50 μmol/L)HEK293细胞的凋亡现象较少,在高浓度(300 μmol/L)时,出现凋亡小体。经美迪紫檀素作用后,VSMC细胞均有凋亡小体出现,见图5。
2.3美迪紫檀素对正常细胞膜完整性的影响
2.3.1美迪紫檀素对乳酸脱氢酶(LDH)的影响与对照组比较,美迪紫檀素在1、50、300 μmol/L剂量下,能增加L-02、VSMC细胞上清液中LDH的含量(P<0.05)。美迪紫檀素在1 μmol/L剂量时,可降低HEK293细胞上清液中LDH的含量,但在300 μmol/L浓度下明显增加LDH的含量(P<0.01)。与对照组比较, H9C2细胞上清液中LDH的含量没有明显变化(P>0.05),见图6。


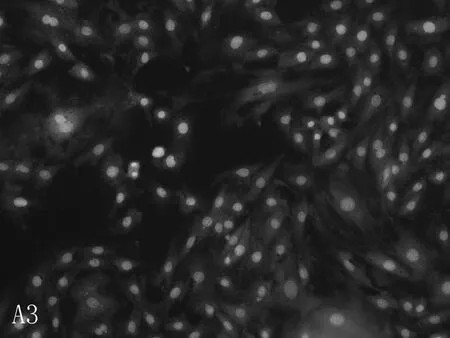

A: 对H9C2细胞中LDH的影响
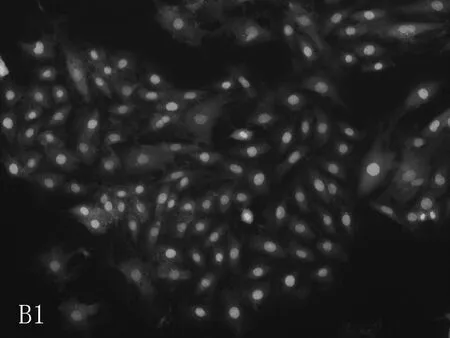



B: 对L-02细胞中LDH的影响


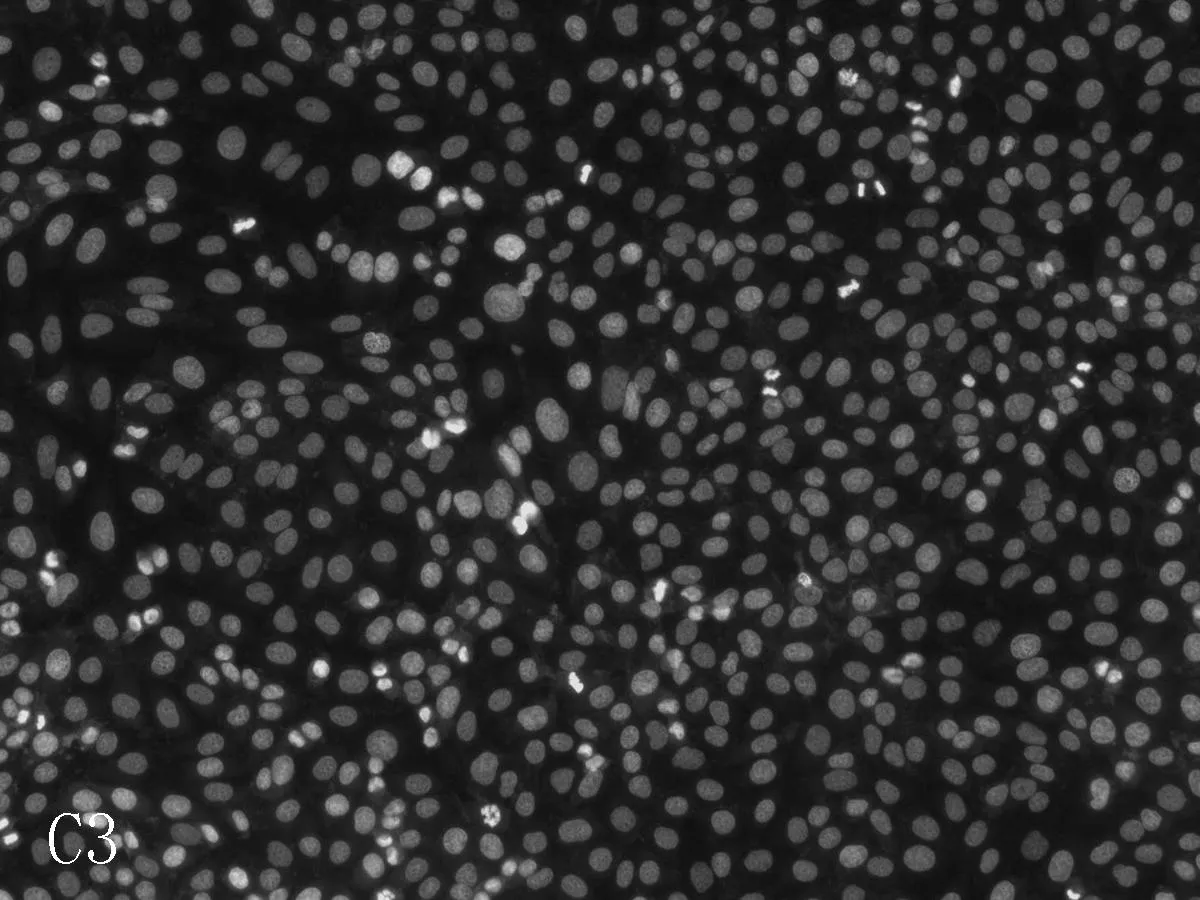
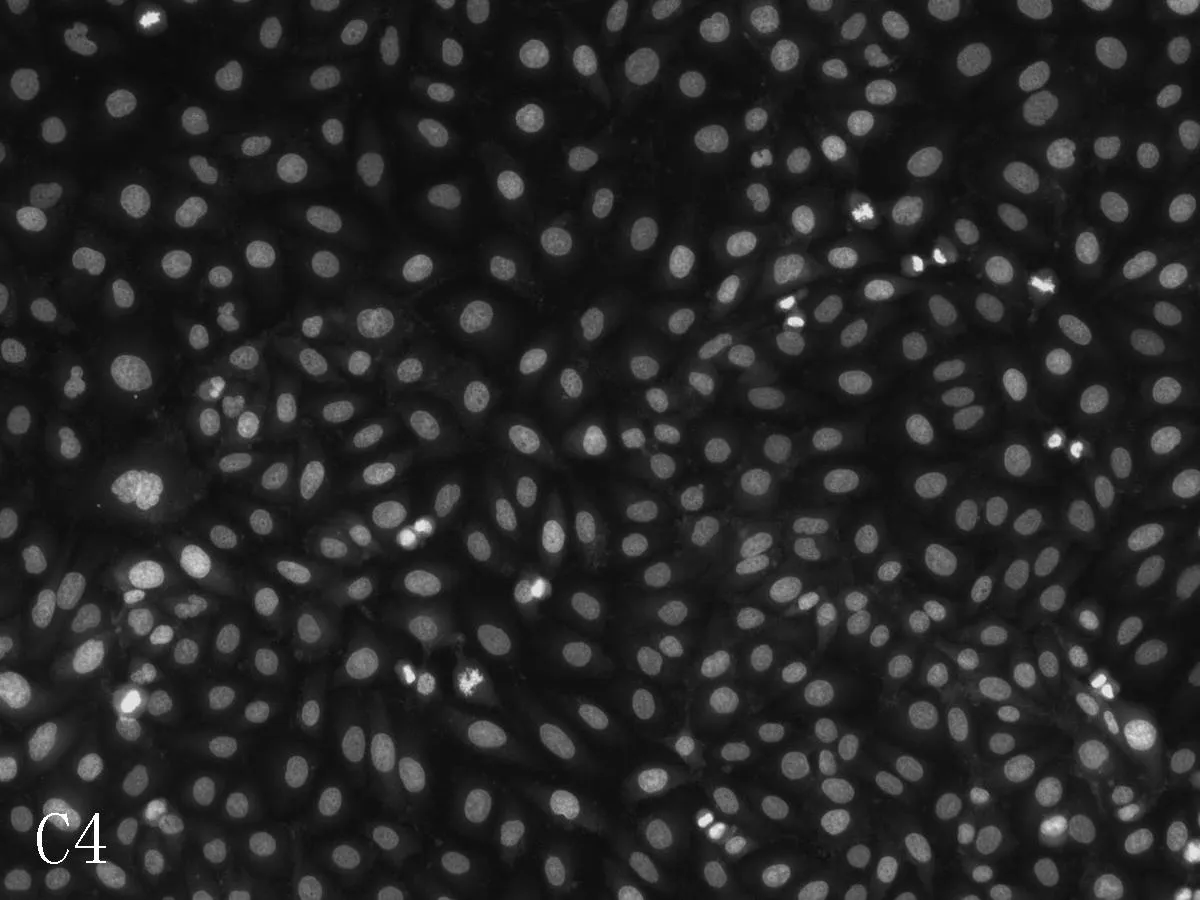
C: 对HEK293细胞中LDH的影响
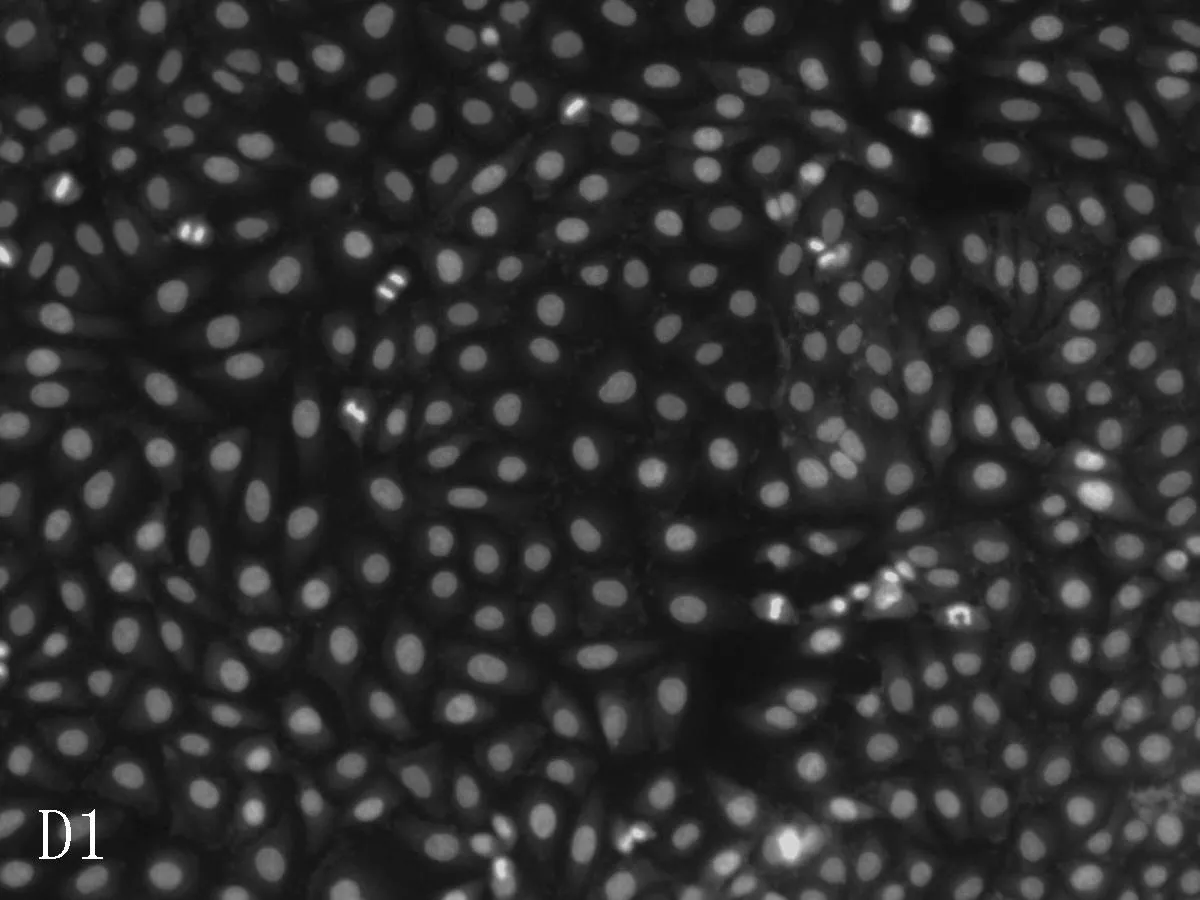

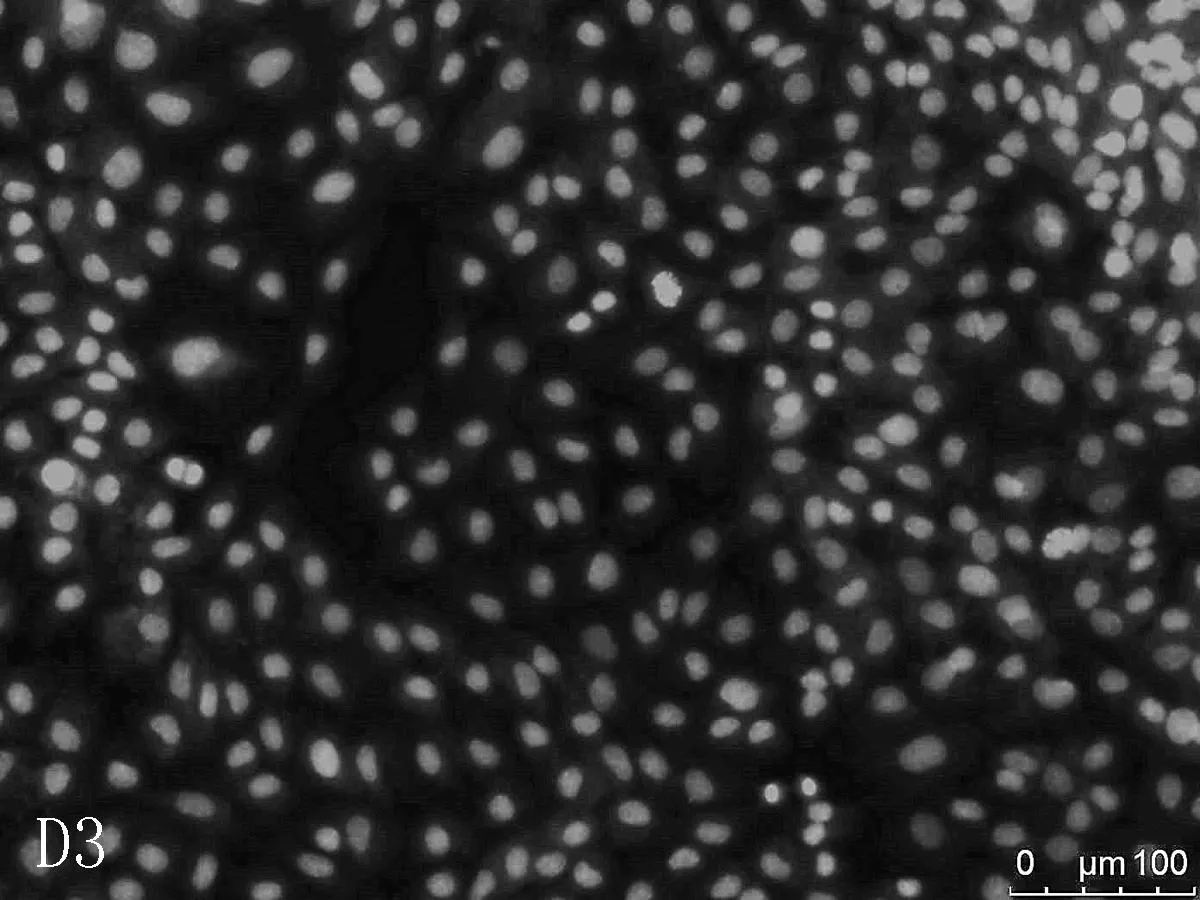

D: 对VSMC细胞中LDH的影响
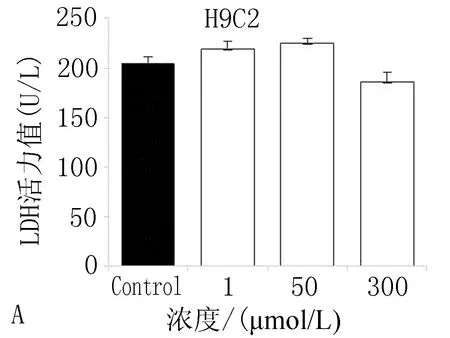



图6美迪紫檀素对细胞中LDH的影响(注:与对照组比较,*P<0.05,**P<0.01)
2.3.2美迪紫檀素对谷草转氨酶(AST)、谷丙转氨酶(ALT)及肌酸激酶(CK)的影响与对照组比较,1、50、300 μmol/L剂量下的美迪紫檀素对H9C2细胞中的AST和CK活性无明显影响(P>0.05),但可使L-02细胞中的AST和ALT活性升高(P<0.05),且呈一定的剂量相关性,随着浓度的增大,L-02细胞中的AST和ALT活性更高,见图7。

A: 对H9C2细胞中AST的影响
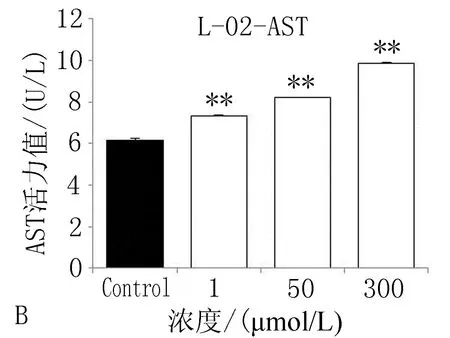
B: 对L-02细胞中AST的影响

C:对 L-02细胞中ALT的影响

D:对H9C2细胞中CK的影响
图7美迪紫檀素对H9C2和L-02细胞中AST、ALT、CK的影响(注:与对照组比较,*P<0.05,**P<0.01)
3讨论
美迪紫檀素作为常见植物中存在的异黄酮类化合物,目前的研究多为对植物提取物或单体的骨保护作用、抗肿瘤等活性研究,但缺乏其安全性的相关研究。本实验采用体外试验评价其对人体或者动物的重要器官(如心、肝、肾及血管)的细胞毒性,以此来预测美迪紫檀素的体外安全性。
本研究通过MTT法测定美迪紫檀素对正常细胞增殖的影响,表明美迪紫檀素在0.1~300 μmol/L的浓度范围内对大鼠心肌细胞株H9C2没有抑制作用;对人胚肝细胞株L-02有显著的抑制作用,且呈剂量依赖性,随美迪紫檀素浓度的增大而毒性作用增加;对大鼠主动脉血管平滑肌细胞株VSMC增殖显示出抑制作用;在0.1~200 μmol/L,其对人胚肾上皮细胞株HEK293没有抑制作用,在250~300 μmol/L范围内有一定的抑制作用。
本研究采用Hoechest33342荧光染色试验观察美迪紫檀素对H9C2、L-02、HEK293、VSMC细胞核形态及凋亡的影响,并利用LDH、AST、ALT、CK等指标考察其对正常细胞膜完整性的影响。结果发现,荧光染色试验中H9C2的细胞核完整,染色质均匀分布,较少发生凋亡现象; L-02和VSMC细胞有凋亡小体出现,细胞核破碎增加,与对照组比较,低浓度组(1 μmol/L)和中浓度组(50 μmol/L)HEK293细胞凋亡现象较少,在高浓度(300 μmol/L)时,出现凋亡小体。细胞膜完整性试验中,美迪紫檀素对H9C2细胞上清液中LDH、AST和CK的含量无影响(P>0.05),能增加L-02、VSMC细胞上清液中LDH的含量(P<0.05),可使L-02细胞中的AST和ALT活性也显著升高,且呈一定的剂量相关性,随着浓度的增大,活性更高,并在高浓度(300 μmol/L)时使HEK293细胞上清液中LDH含量显著增加(P<0.01)。这些结果与MTT检测结果相符,进一步说明美迪紫檀素可诱导L-02、VSMC细胞发生凋亡,使细胞膜受到损伤,并仅在高浓度(300 μmol/L)时引发HEK293细胞凋亡。
本研究考察了美迪紫檀素在体外对正常细胞的毒性或活性作用,高浓度的美迪紫檀素对肝、肾、血管细胞生长可能有一定的影响,而不影响心肌细胞的生长,对以美迪紫檀素为活性成分的新药开发提供早期安全性评价依据。
参考文献:
[1]李伟东,阚毓铭,洪敏,等.后莫紫檀素、美迪紫檀素对人肝癌细胞抑制作用的研究[J].沈阳药科大学学报,2011,18(3):211-212.
[2]杨杰,王丽莉,周鑫堂,等.黄花草木犀化学成分研究[J].中草药, 2014,45(5):622-625.
[3]刘毅,海力茜,赵玉英,等.天山岩黄芪化学成分研究[J].中国药事, 2008,22(7):568-569.
[4]李国玉,王金辉,李铣,等.苦马豆果皮中紫檀烷和异黄酮类化合物的分离与鉴定[J].中国药物化学杂志, 2015,13(4):215-218.
[5]周秋丽.现代中药基础研究与临床[M].天津:天津科技翻译出版公司,2012:529.
[6]孙琳,李占林,彭静波,等.白车轴草化学成分的分离与鉴定[J].沈阳药科大学学报, 2010,27(1):40-43.
[7]崔浩然,杨浩宏,席琳乔,等.新疆昭苏县定居牧户马匹饲养管理现状调查与分析[J].草食家畜, 2014,7(4):21-26.
[8]张强强.昭苏马场不同建植年限混播人工草地稳定性研究[D].乌鲁木齐:新疆医科大学,2010.
[9]Bhargavan B, Singh D, Gautam AK,et al. Medicarpin, a legume phytoalexin, stimulates osteoblast differentiation and promotes peak bone mass achievement in rats:evidence for estrogen receptor β-mediated osteogenic action of medicarpin [J]. J Nutr Biochem,2012,23 :27-38.
[10]石荣火. 刺果甘草化学成分及抗肿瘤活性研究[D].南京:南京中医药大学,2001.
[11]Rayanil KO, Bunchornmaspan P, Tuntiwachwuttikul P. A New Phenolic Compound with Anticancer Activity from the Wood of Millettia leucantha [J]. Arch Pharm Res,2011,34(6):881-886.
[12]Gatouillat G,Magid AA, Bertin E,et al. Cytotoxicity and Apoptosis Induced by Alfalfa (Medicago sativa) Leaf Extracts in Sensitive and Multidrug-Resistant Tumor Cells [J]. Nutr Cancer, 2014,66(3):483-491.
[13]黎雄.资源植物朝鲜槐的化学成分、生物活性及其质量控制研究[D].沈阳:沈阳药科大学,2011.
[14]Taneja I, Raju KS, Challagundla M, et al. LC-ESI-MS/MS method for bioanalytical determination of osteogenic phytoalexin, medicarpin, and its application to preliminary pharmacokinetic studies in rats [J]. J Chromatogr B,2015,1001:9-16.
[15]温贤涛,王蕊,贾璇,等.镍离子体外细胞毒性研究[J].中国医药器械杂志,2015,39(3):212-215.
[16]黄健,魏秀岩,孙博航,等.冬凌草甲素诱导HepG2肝癌细胞凋亡机制的研究[J].中国现代中药,2010,12(12):28-31.
[17]刘扬,李竹琴.外源性棕榈酸减轻儿茶酚胺和血管紧张素II共同介导的大鼠乳鼠心肌细胞损伤机制的初步探讨[J].川北医学院学报,2015,30(5):694-698.
[18]谭珍媛,梁秋云,黄慧学,等.油茶皂苷对LO-2和HK-2细胞的毒性作用研究[J].广西中医药,2014,37(3):78-80.
[19]陈军,武延庆,姚莉.艾迪注射液对肺癌SPC-A-1细胞的增殖抑制作用及其机制[J].中成药,2015,37(3):630-633.
[20]冯燕,张波,王少兰,等. H2O2诱导SD大鼠视网膜细胞凋亡过程中细胞内钙离子浓度的变化[J].西安交通大学学报:医学版,2015,36(5):580-586.
[21]肖露,王静,朱凌鹏,等.合成红景天苷对H9C2细胞氧化应激损伤的保护作用研究[J].药学与临床研究, 2014,22(2):105-108.
[22]高丽,张哲,许树钦,等.赤芍总苷对过氧化氢所致H9C2心肌细胞损伤的保护作用[J].时珍国医国药, 2011,22(5):1195-1195.
[23]蔡晶,张庆,肖峰,等.五味子乙素对人肝细胞氧化损伤的保护作用[J].皖南医学院学报,2014,33(1):1-5.
(本文编辑施洋)
Study of cytotoxicity of Medicarpin In vitro
ZHAO Jing1, MAO Xuwen2, ZHU Xiaoxue1, GAO Xiaoli1
(1CollegeofPharmacy;2CollegeofBasicMedical,XinjiangMedicalUniversity,Urumqi830011,China)
Abstract:ObjectiveTo investigate the cytotoxicity of Medicarpin on normal cells lines , including VSMC, H9C2, L-02, and HEK293. MethodsThe in vitro cultured VSMC, H9C2, L-02, and HEK293 was exposured in Medicarpin solutions at different concentrations (from 0.1, 1, 5, 10, 50, 100, 200, 250, to 300 μmol/L). measure the inhibitory effect was measured using MTT assay. Apoptosis was assayed by Hoechst 33342 staining, and the supernates were collected respectively after different treatment to measure LDH, AST, ALT and CK levels under the concentrations of 1, 50 and 300 μmol/L. ResultsCompared with control group, Medicarpin at the concentrations of 0.1-300 μmol/L showed no significant inhibitory effects and apoptosis on H9C2 cells, the levels of LDH, AST and ALT had no significant changing (P>0.05). whereas for L-02 and VSMC cells, Medicarpin at the concentrations of 0.1-300 μmol/L showed significantly inhibitory effects, the apoptotic cells could be seen, the levels of LDH remarkably increased, and the AST and ALT activities of L-02 cells also pronouncedly increased (P<0.05). For HEK293 cells, Medicarpin at the concentrations of 250-300 μmol/L showed inhibitory effects and apoptosis, the levels of LDH increased. Furthermore, the inhibitory effects for L-02 and HEK293 cells increased in concentration-dependent way. ConclusionMedicarpin showed no influence on H9C2 cells, but had effects on the growth of L-02 and VSMC cells, so did HEK293 during the concentration of 250~300 μmol/L.
Keywords:Medicarpin; H9C2; L-02; HEK293; VSMC; cytotoxicity
[收稿日期:2016-01-10]
doi:10.3969/j.issn.1009-5551.2016.05.015
中图分类号:R966
文献标识码:A
文章编号:1009-5551(2016)05-0586-05
作者简介:赵静(1988-),女,在读硕士,研究方向:新药新剂型开发。通信作者:高晓黎,女,博士,教授,博士生导师,研究方向:新药新剂型开发,E-mail:xli_g@sina.com。
基金项目:新疆维吾尔自治区重大科技专项资助项目(101130101-4)
