小麦品种潍麦8号2AS染色体上的抗叶锈病QTL定位
2016-05-27王佳真师令智任志宽刘大群
朱 琳,王佳真,师令智,任志宽,李 星,刘大群
(河北省农作物病虫害生物防治工程技术研究中心,河北农业大学植物保护学院,河北保定 071001)
小麦品种潍麦8号2AS染色体上的抗叶锈病QTL定位
朱 琳,王佳真,师令智,任志宽,李 星,刘大群
(河北省农作物病虫害生物防治工程技术研究中心,河北农业大学植物保护学院,河北保定 071001)
摘要:为了解小麦品种潍麦8号抗叶锈基因在染色体上的位置,利用EST标记对潍麦8号2AS染色体上的抗叶锈病QTL进行检测和分子作图。2011-2013年,对抗病品种潍麦8号×感病品种郑州5389杂交得到的179个F2:3家系及其亲本进行成株期抗叶锈病鉴定,得到表型数据。前期研究已利用SSR标记在潍麦8号2AS染色体上检测到一个主效QTL,为了寻找与该QTL距离更近的标记,本试验通过35个位于2AS染色体上的EST标记检测亲本及其F2:3家系,结果表明,4个EST标记与抗叶锈病QTL连锁,该QTL位点被定位在BE444541和CD452782之间,区间距离为11.3 cM,3年解释的遗传变异分别为63.59%、62.48%和62.43%。
关键词:小麦;叶锈病;EST标记;QTL作图
小麦叶锈病是由叶锈菌(Puccinia triticina)侵染引起的真菌性病害,对我国小麦生产具有严重危害。该病害直接为害小麦叶片,通过影响其光合作用,导致小麦产量和品质下降,造成严重的经济损失。应用抗病品种和提高小麦品种的抗病性是防治小麦叶锈病最重要的途径。
表达序列标签(Expression sequenee tag,EST),是将mRNA转录为cDNA并克隆到载体构建cDNA文库,然后大规模随机挑选cDNA克隆,对其5′或3′端进行一步法测序,通过将所获序列与已知基因库序列进行比较,获得对生物体生长发育、繁殖分化、遗传变异和衰老死亡等生命过程认识的技术[1]。由于EST序列是基因的一部分,因此其多态性与功能直接相关。其次,EST标记资源丰富,成本低廉,可用于进行大量目的基因的筛选,特别适合数量性状位点的比较[2]。
小麦数量性状位点(Quantitative trait loci,QTL)控制数量性状基因,一般在小麦成株期对叶锈病表现非小种专化抗性,因此又叫成株抗性(adult-plant resistance,APR)或慢病性。慢病性受多基因控制[3-5],表现为数量性状和持久抗病性。已经发现的慢叶锈性基因有 Lr34[6]、 Lr46[7]、 Lr67[8]、 Lr68[9],在田间均表现出良好的抗性。但目前发现的小麦抗叶锈QTL仅有80多个,主要集中在1BS、1BL、2BS、6BS、7BL上[10],所以有必要开发更多更有效的QTL及其相关分子标记。
潍麦8号是由山东潍坊市农科院作物所以88-3149为母本、以Aus621108为父本经过有性杂交选育成的小麦新品种。该品种综合农艺性状良好,同时高抗白粉病和叶锈病,是一个良好的小麦抗叶锈性资源[11]。本实验室前期研究中利用SSR引物对淮麦8号抗叶锈QTL进行了定位,发现在2AS染色体上存在一个主效QTL[12]。为了筛选与该位点距离更近的标记,本研究通过EST标记对潍麦8号品种2AS染色体上的抗叶锈QTL进行分子作图,以期为利用潍麦8号培育抗叶锈病小麦新品种提供理论依据。
1材料与方法
1.1小麦材料和叶锈菌菌种
供试小麦材料为抗病亲本潍麦8号和感病亲本郑州5389及其杂交获得的179个F2:3家系。供试叶锈菌生理小种为THTT、THTS和THTQ,用于小麦成株期田间的接种鉴定。以上材料均由河北农业大学植物免疫研究室提供。
1.2小麦成株期叶锈病田间严重度调查
2010-2012年连续3年11月初在河北农业大学实验田采用条播法种植,行长1.5 m,每行种50粒,行距25 cm。每10行种植1行对照(感病品种郑州5389),在与试验材料垂直的方向种植诱发行(感病品种郑州5389)。在每年的小麦分蘖阶段(保定地区每年在四月中旬)将等量叶锈菌生理小种THTT、THTS和THTQ混合,配置成0.05%吐温20孢子悬浮液,喷施于诱发行。接种后用塑料薄膜覆盖,隔夜保湿15 h左右后去除薄膜。在进行田间鉴定前要注意浇水,保证田间微气候湿润,为发病创造适宜条件。待郑州5389发病严重度达到50%以上时(即叶锈菌面积占叶片面积比例50%以上),进行田间第一次鉴定,之后每周鉴定一次,直到郑州5389发病严重度达到100%、群体发病严重度达到最大,此时所达到的严重度称为最终严重度(Final disease severity,FDS),用作最终QTL分析的表型数据。
1.3抗感小群体的建立
选取最终严重度最低及最高的家系各5个,分别作为抗病和感病小群体,用于后续筛选EST标记。
1.4小麦DNA的提取及PCR扩增
参照Sharp等[13]的CTAB法提取小麦幼嫩叶片的DNA,略作改进。10 μL PCR反应体系中分别加入模板DNA (30 ng·μL-1) 1 μL,10× PCR buffer (含MgCl2) 1 μL,dNTP (10 mmol·L-1) 0.2 μL,引物(4 μmol·L-1)1 μL,10 U·μL-1TaqDNA聚合酶0.1 μL,超纯水6.7 μL。PCR反应程序为:94 ℃预变性5 min;然后94 ℃变性45 s,55 ℃(根据不同引物略有变化)退火45 s,72 ℃延伸1 min,共进行35个循环,最后72 ℃延伸10 min。4 ℃保存PCR产物。10%非变性聚丙烯酰胺凝胶电泳对其进行检测。电泳后的凝胶参照Bassam等[14]的方法银染检测,记录结果。
1.5EST分子标记的筛选
本实验室前期研究已利用SSR标记在潍麦8号2AS染色体检测到一个主效QTL[12],为了寻找与此QTL距离更近的分子标记,因此用分布在2AS染色体上的35对EST引物进一步筛选亲本和抗感小群体是否存在多态性,并利用多态性引物对群体进行筛选。EST引物由上海生工生物工程技术服务有限公司合成。
1.6QTL连锁图谱构建
用筛选出来的分子标记检测179个F2:3家系,PCR扩增带型结合表型数据进行连锁分析,通过Map Manager QTXb20软件构建遗传连锁图谱。用QTL Icimapping 3.2做QTL检测,LOD阈值设为2.5。
2结果与分析
2.1潍麦8号田间抗病性鉴定结果
2011-2013连续3年在田间对潍麦8号和郑州5389及其F2:3代家系抗叶锈病表型数据进行鉴定,得出3年的最终严重度分布数据(图1)。在感病亲本郑州5389发病严重度达到100%时,潍麦8号连续3年的最终严重度均为10%。F2:3代家系的最终严重度呈连续分布,符合数量性状遗传特点,说明潍麦8号中可能存在若干控制小麦抗叶锈病的QTL位点。由于小麦成株抗性与环境相关,田间调查数据显示,在2011年和2013年,各家系最终严重度的分布趋势相近,而与2012年各家系最终严重度的分布趋势不同;比较各年份间田间表型数据可知,2012年整体发病较严重。

图1 潍麦8号×郑州5389及其179个F2:3家系叶锈病三年最终严重度的分布
2.2标记筛选结果
用小麦2AS染色体上的35对EST引物对抗感亲本和抗感小群体进行筛选,其中有4对引物可以扩增出多态性片段,可以推断这4对引物可能与位于2AS染色体上的数量性状位点相关联。4对EST引物分别为:BE444659_cp (上游5′-TAA GGAGGCAATTGACAGGG-3′,下游5′-GCA AACTCCACAGCCTCTTC-3′)、BE444541_cp(上游5′-CTTAGGAGTACCCCTTGGGC-3′,下游5′-GCAAATGAAGAAGCGTGTGA-3′)、CD452782_cp (上游5′-TCACACCTTCCCCAAGTTTC-3′,下游5′-TCACACGCTTCTTCATTTGC-3′)、BE405597_cp (上游5′-GTGTTTTCACTGGC AAGCAA-3′,下游5′-GCCTATTAGTCGCAGC AAGG-3′)。它们均在抗病亲本与感病亲本中扩增出特异性带(图2)。用这4对引物继续对179个F2:3代家系进行筛选,发现引物BE405597_cp在群体中多态性不稳定,个别家系出现带型与表型不吻合的现象,其余三对引物在群体中多态性表现较稳定。
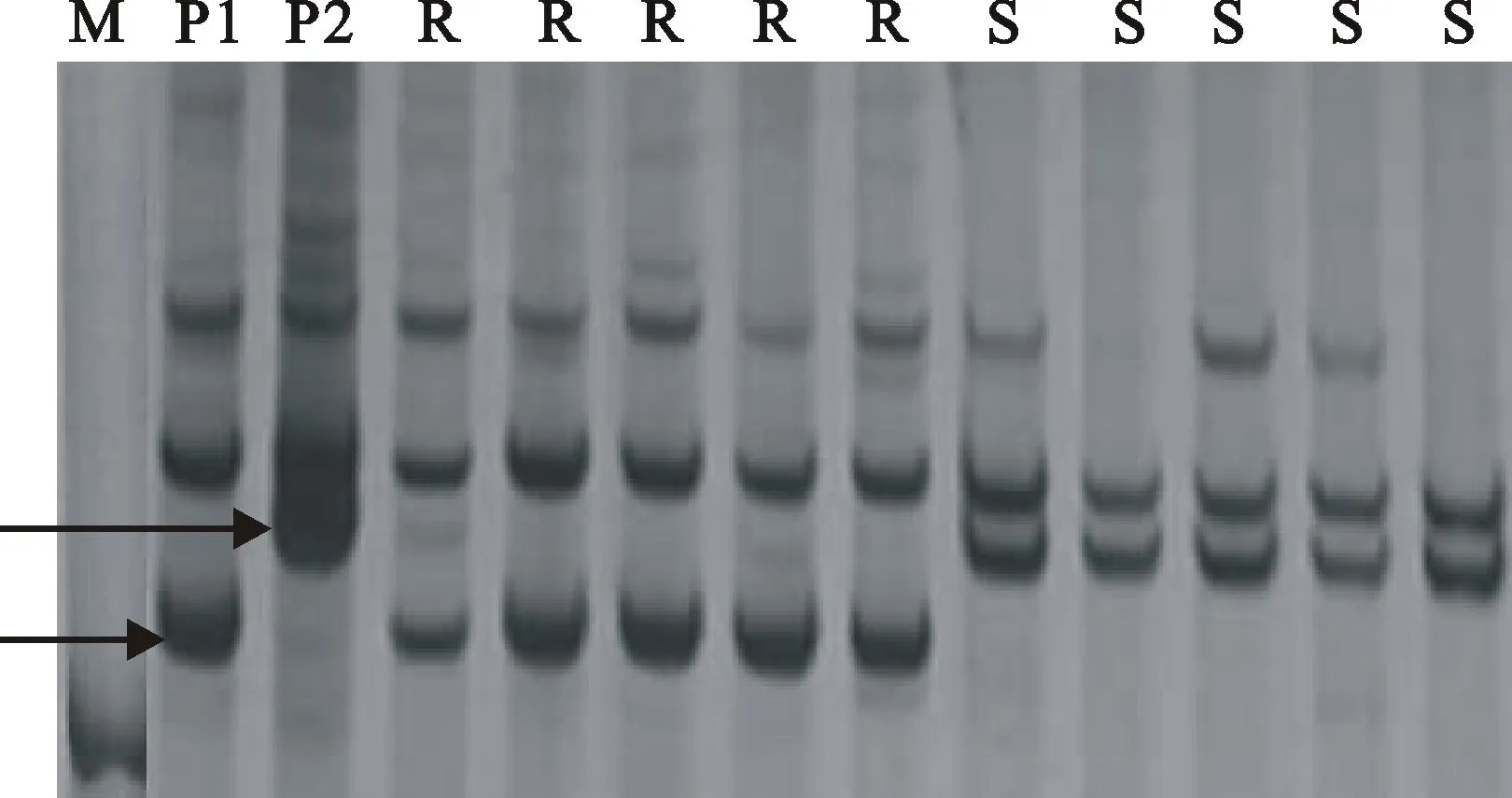
M:DL 2000 Marker;P1:抗病亲本潍麦8号;P2:感病亲本郑州5389;R:抗病单株;S:感病单株;箭头指示特异性条带
M: DL 2000 Marker; P1: Resistant parent Weimai 8; P2: Susceptible parent Zhengzhou 5389; R: Resistant individual; S: Susceptible individual;Arrows indicate specific bands
图2引物BE444659_cp在抗感小群体中的PCR扩增
Fig.2PCR amplification with primer BE444659_cp
in resistant and susceptible plants
2.3QTL连锁图谱
根据潍麦8号和郑州5389杂交所得的179个F2:3家系连续三年的田间鉴定表型数据进行EST标记筛选,利用分析软件Map Manager QTXb20和QTL Icimapping 3.2进行结果分析,最终在小麦2AS染色体上检测到1个控制成株抗叶锈的QTL位点,发现3个分子标记与潍麦8号抗叶锈QTL连锁,分别为BE444659、BE444541和CD452782(图3)。三个标记的区间距离为11.3 cM,该位点在连续三年的田间鉴定中解释的遗传变异分别为63.59%、62.48%和62.43%(表1)。距离该QTL最近的两个位点为CD452782和BE444659,距离为7.1 cM。
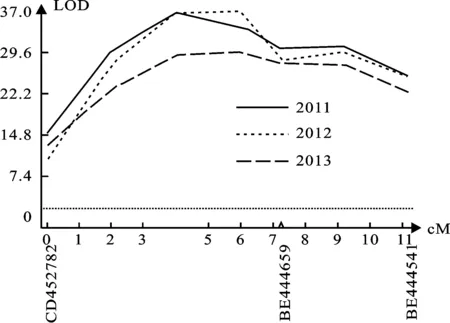
图3 2AS染色体上控制小麦成株抗叶锈QTL的位置
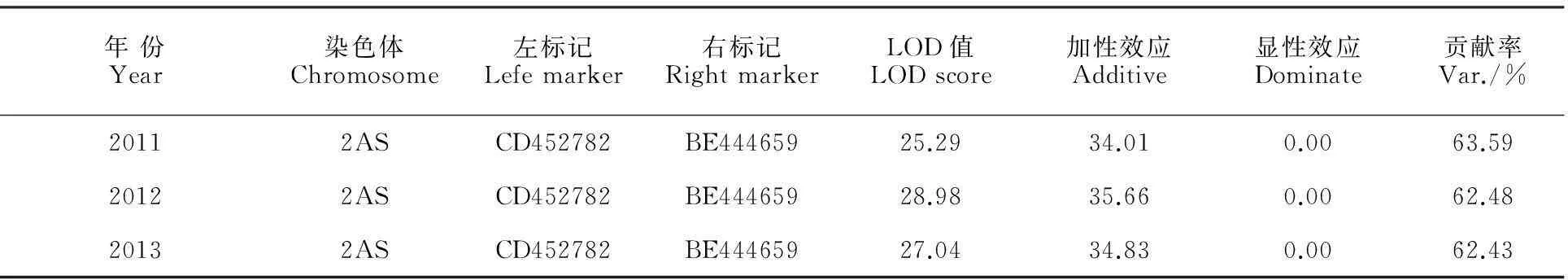
年份Year染色体Chromosome左标记Lefemarker右标记RightmarkerLOD值LODscore加性效应Additive显性效应Dominate贡献率Var./%20112ASCD452782BE44465925.2934.010.0063.5920122ASCD452782BE44465928.9835.660.0062.4820132ASCD452782BE44465927.0434.830.0062.43
3讨 论
本研究通过EST标记对小麦品种潍麦8号2AS染色体上一个QTL进行了定位,但在结果中发现个别EST引物在F2:3代家系中多态性不稳定。为了提高EST标记的多态性,可以对无多态扩增产物进行酶切,以揭示剪切扩增多态性(Cleavage Amplified Polymorphism,CAP);或改进对PCR产物的分析手段,如采用分辨率较高的变性梯度胶分离PCR产物,提高多态检测率[15]。
通过Map Manager QTXb20软件构建遗传连锁图谱,用QTL Icimapping 3.2进行结果分析,QTL被定位在BE444659和CD452782之间,区间距离为7.1 cM,三年解释的遗传变异分别为63.59%、62.48%和62.43%,从而证实此QTL位点可信度较高,并且效应较大。
成株抗病性由多个数量性状位点控制,相对于小种专化抗性具有抗病持久的优点,此外由于成株抗病性QTL具有一因多效的特点,加强对慢病性基因的合理利用有利于同时防治小麦白粉、条锈等多种病害[16]。本实验在2AS染色体上检测出一个QTL,且具有较大效应,对存在于其他染色体上的QTL还需要通过SSR、EST等进行进一步检测。目前,位于2AS染色体上已知的小麦抗叶锈基因有 Lr37[17],该基因来源于偏凸山羊草(Aegilopsventricosa)2N染色体,表现出优异的成株抗性。 Lr37基因与抗条锈基因 Yr17和抗杆锈基因 Sr38紧密连锁, Lr37-Yr17-Sr38连锁群被Helguera等[18]运用RFLP标记 cmwg682定位在2AS上10 cM左右。根据2004年Somers等[19]绘制的得到国际公认的面包小麦高密度SSR标记图谱可知,本实验在淮麦8号中发现的QTL位点被定位在2A染色体短臂末端,与 Lr37存在一定距离。 Lr37与本实验标记的QTL之间的关系还需要进一步通过高通量SNP分子标记进行验证。
参考文献:
[1]忻 雅,崔海瑞.植物表达序列标签(EST)标记及其应用研究进展[J].生物学通报,2004,39(8):4-6.
Xin Y,Cui H R.Advances in research on the marker development based on plant express sequenced taqs(EST) and its applications [J].BulletinofBiology,2004,39(8):4-6.
[2]梅铭凤.小麦EST标记的开发及其应用研究[D].南京农业大学硕士学位论文,2006.
Mei M F.Development of EST marker in wheat and their applications [D].MsD Dissertation of Nanjing Agriculture University,2006.
[3]Ribeiro Do Vale F X,Parlevliet J E,Zambolim L.Concepts in plant disease resistance [J].FitopatologiaBrasileira,2001,26:577-589.
[4]Johnson R,Law C N.Cytogenetic studies in the resistance of the wheat variety Bersée to Puccinia striiformis [J].CerealRustsBulletin,1973,1:38-43.
[5]Das M K,Rajaram S,Mundt C C,etal.Inheritance of slow rusting resistance in wheat [J].CropScience,1992,32:1452-1456.
[6]Dyck P L.Genetics of leaf rust reactions in three introductions of common wheat [J].CanadianJournalofGeneticsandCytology,1977,19:711-716
[7]Singh R P,Mujeeb-Kazi A,Huerta-Espino J. Lr46:A gene conferring slow-rusting resistance to leaf rust in wheat [J].Phytopathology,1998,88:890-894
[8]Mcintosh R A,Dubcovsky J,Rogers W J,etal.Catalogue of gene symbols for wheat:2011 supplement [J].AnnualWheatNewsletter,2011,57:303-321
[9]Herrera-Foessel S A,Singh R P,Huerta-Espino J,etal. Lr68:a new gene conferring slow rusting resistance to leaf rust in wheat [J].TheoreticalandAppliedGenetics,2012,124(8):1475-1486.
[10]李欢.小麦品系L224-3苗期及成株抗叶锈病基因的分子作图[D].河北农业大学硕士学位论文,2013.
Li H.Molecular mapping of leaf rust resistance gene in Chinese wheat line L224-3[D].MsD Dissertation of Hebei Agriculture University,2013.
[11]张其鲁.潍麦8号的株型特征及影响因素分析[D].中国农业大学硕士学位论文,2004.
Zhang Q L.Studies on morphologic characteristics of Weimai 8 and the Ideotype of wheat [D].MsD Dissertation of China Agricultural University,2004.
[12]王佳真,师令智,朱 琳,等.小麦品种潍麦8号成株抗叶锈QTL定位[J].植物遗传资源学报,2015,16(4):868-871.
Wang J Z,Shi L Z,Zhu L,etal.Molecular mapping of QTL for leaf rust resistance in Chinese wheat cultivar Weimai 8 [J].JournalofPlantGeneticResources,2015,16(4):868-871.
[13]Sharp P J,Kreis M,Shewry P R,etal.Location of bamylase sequence in wheat and its relatives [J].TheoreticalandAppliedGenetics,1988,75:286-290.
[14]Bassam B J,Caetano-Anolles G,Gresshoff P M.Fast and sensitive silver staining of DNA in polyacrylamide gels [J].AnalyticalBiochemistry,1991,196:80-83.
[15]Temesgen B,Brown G R,Harry D E.Genetic mapping of expressed sequence tag polymorphism (ESTP) marker in loblolly (PinustaedaL.) [J].TheoreticalandAppliedGenetics,2001,102:664-675.
[16]韩柳莎.中国小麦蓝兰天9号成株抗叶锈QTL作图[D].河北农业大学硕士学位论文,2014.
Han L S.QTL mapping for adult-plant resistance gene to leaf rust in Chinese wheat cultivai Lantian 9 [D].MsD Dissertation of Hebei Agriculture University,2014.
[17]Bariana H S,McIntosh R A.Location of rust resistance genes in VPM1 and their genetic linkage with other disease resistance genes in chromosome 2A [J].Genome,1993,36:476-482.
[18]Helguera M,Khan I A,Kolmer J,etal.PCR assays for the Lr37-Yr17-Sr38 cluster of rust resistance genes and their use to develop isogenic hard red spring wheat lines [J].CropScience,2003,43(5):1839-1847
[19]Somers D J,Isaac P,Edwards K.A high-density microsatellite consensus map for bread wheat (TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2004,109(6):1105-1114.
QTL Mapping of Leaf Rust Resistance in 2AS Chromosomal of the Wheat Cultivar Weimai 8
ZHU Lin,WANG Jiazhen,SHI Lingzhi,REN Zhikuan,LI Xing,LIU Daqun
(Biological Control Center of Plant Diseases and Pests of Hebei Province,College of Plant Protection,Agricultural University of Hebei,Baoding,Hebei 071001,China)
Abstract:To understand the chromosomal position of leaf rust resistance genes in Chinese wheat cultivar Weimai 8,molecular mapping of the leaf rust resistance loci was conducted using EST markers in this study. In 2011-2013,179 F2:3lines derived from the cross of Weimai 8 × Zhengzhou 5389 and the parents to obtain the phenotypic data on their reactions to leaf rust at the adult plant stage. A major effective QTL on chromosome 2AS of Weimai 8 has been found using SSR markers.In order to find closer markers of the QTL,thirty-five EST markers located on chromosome 2AS were screened between the parents and F2:3lines. The results indicated that four EST markers linked to the QTL for leaf rust resistance were identified,which was located between markers BE444541 and CD452782,with an interval distance of 11.3 cM. This QTL explained 63.59%,62.48% and 62.43% of the phenotypic variations in the three years tests,respectively.
Key words:Wheat; Leaf rust; EST marker; QTL mapping
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)02-0145-05
通讯作者:李 星(E-mail: lixing@hebau.edu.cn);刘大群(E-mail: ldq@hebau.edu.cn)
基金项目:国家自然科学基金国际(地区)合作与交流项目(31361140367);高等学校博士学科点专项科研基金联合资助课题(20131302120004);植物病虫害生物学国家重点实验室开放基金资助课题(SKLOF201513);河北省引进留学人员资助项目(C2015003033)
收稿日期:2015-09-14修回日期:2015-11-25
网络出版时间:2016-01-26
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160126.1944.006.html
第一作者E-mail: ezzhulin@sina.com(朱 琳);858189486@qq.com(王佳真,并列第一作者)
