节节麦幼胚再生体系的建立
2016-05-27李春莲柴乖强王中华
徐 凤,李春莲,李 扬,柴乖强,王中华
(西北农林科技大学农学院,陕西杨凌 712100)
节节麦幼胚再生体系的建立
徐 凤,李春莲,李 扬,柴乖强,王中华
(西北农林科技大学农学院,陕西杨凌 712100)
摘要:为建立高效的节节麦幼胚再生体系,以节节麦幼胚为外植体,通过正交设计,探索基本培养基、2,4-D、碳源、KT等因素对幼胚愈伤组织诱导、分化及植株再生效果的影响。结果表明,4 种因素中,基本培养基对节节麦幼胚愈伤组织诱导的影响最显著(P<0.05),2,4-D浓度对节节麦幼胚愈伤组织诱导也有显著影响(P<0.05),添加3.0 mg·L-12,4-D的培养基诱导出的愈伤组织质量高,淡黄色,表面呈不规则颗粒状,质地致密,再生频率可以达到17.62%。KT浓度对节节麦愈伤分化影响最显著,基本培养基、2,4-D和碳源对节节麦幼胚愈伤分化均无显著影响。不同碳源对节节麦幼胚愈伤组织诱导和分化的影响均不显著,为节约成本可直接选用30 g·L-1蔗糖作为碳源。节节麦幼胚组织培养的最佳组合是:愈伤诱导培养基为MS培养基+3 mg·L-12,4-D+ 15 g·L-1蔗糖+15 g·L-1甘露醇,愈伤分化培养基为MS培养基+15 g·L-1蔗糖+15 g·L-1甘露醇+1.0 mg·L-1KT。
关键词:节节麦;幼胚;胚性愈伤;愈伤分化
采用现代基因工程方法将优良基因导入小麦对其进行遗传改良是当前小麦育种的一个新方向。目前小麦基因工程育种进展缓慢,这一方面是由于普通小麦基因组序列庞大,它含有A、B、D三个同源染色体组,基因组约包含170亿个碱基,这一数值是玉米的7倍和水稻的35倍,约有124 000个基因[1],而且基因之间存在冗余、干扰等现象,使其功能基因的研究十分困难;另一方面由于小麦的遗传转化效率很低,使得基因工程育种无法得到广泛应用。节节麦(Aegilopstauschii)作为小麦D基因组的供体,其基因组小、遗传背景简单。节节麦的D基因组对小麦基因组的研究具有重要的参考价值,它的序列已经广泛应用到小麦基因序列分析中,因而节节麦成为小麦育种的重要资源[2]。节节麦具有较高的遗传多样性和较强的抵抗各种生物和非生物胁迫的能力,这些性状都有助于小麦品种的改良[3-4]。此外,D基因组提供了许多与小麦品质相关的基因,节节麦可以为小麦品质改良及小麦D基因组功能研究提供参考。
要研究节节麦的基因功能,首先要建立一个高效而稳定的遗传转化体系,而遗传转化效率的高低主要取决于组织培养中植株再生频率的高低。目前,小麦组织培养技术已十分成熟,在研究过程中积累了丰富的经验,这为节节麦组织培养体系的建立提供了重要参考。前人研究表明,影响小麦组织培养的主要因素有基因型、外植体、外源激素、培养基类型等[5-10]。另外,还有研究者通过调整碳源的种类和比例来改善愈伤组织的质量[11]。但到目前为止,关于节节麦幼胚再生体系的研究尚未见报道。基于前人关于小麦组织培养的研究成果,笔者选择节节麦幼胚为外植体,通过4因素16水平的正交设计试验,探索基本培养基、2,4-D、碳源、KT等因素对节节麦幼胚愈伤组织诱导、分化及植株再生的影响,旨在筛选适合节节麦幼胚组织培养的体系,为节节麦遗传转化研究奠定基础。
1材料与方法
1.1试验材料
试验所用节节麦的种子由西北农林科技大学标本区提供。
1.2试验方法
1.2.1正交试验设计
采用SPSS 18.0软件进行4因素不同水平正交试验设计,各因素水平如下:基本培养基分为3个水平,分别为MS培养基(Ⅰ)、N6培养基(Ⅱ)、B5培养基(Ⅲ);2,4-D浓度分为4个水平,分别为1.0、2.0、3.0、4.0 mg·L-1;碳源分为4个水平,分别为30 g·L-1蔗糖(A)、30 g·L-1麦芽糖(B)、15 g·L-1蔗糖+15 g·L-1甘露醇(C)、15 g·L-1蔗糖+15 g·L-1山梨醇(D);KT浓度分为3个水平,分别为1.0、1.5、2.0 mg·L-1,实验设计如表1所示,共16个组合。
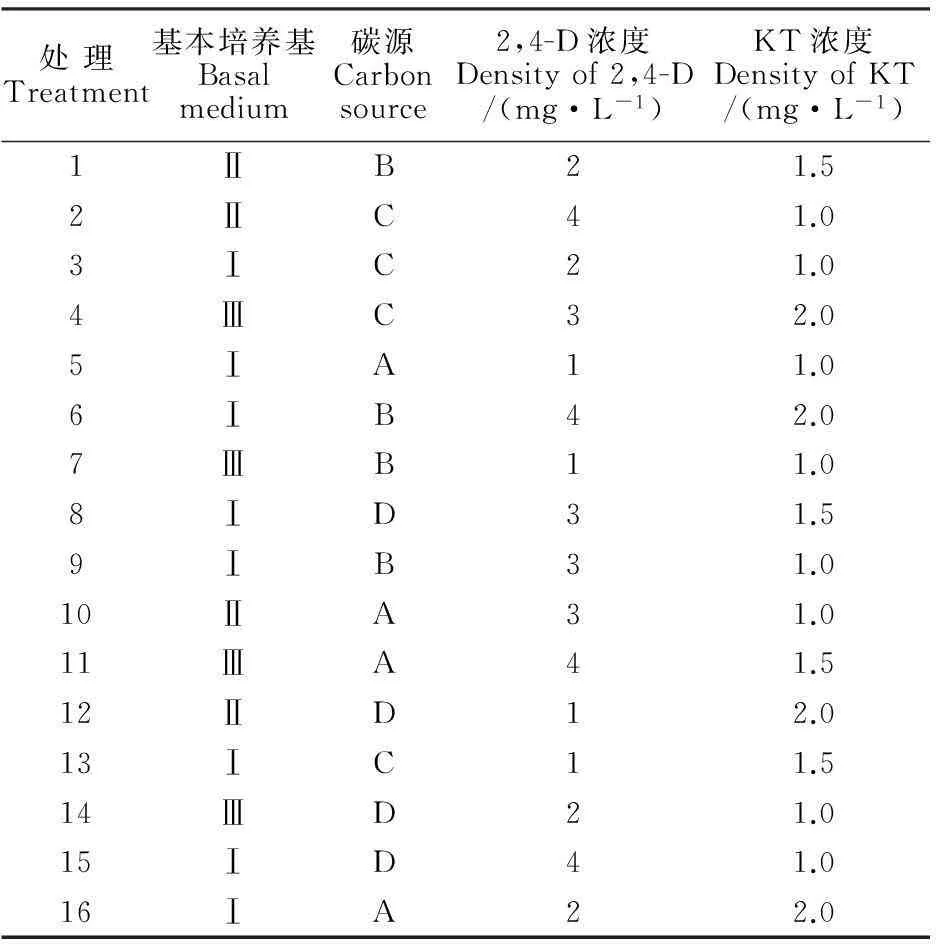
表1 4因素不同水平的正交设计
以上培养基pH值均为5.8,121 ℃高压灭菌20 min后备用。
1.2.2幼胚的选择及消毒
节节麦抽穗扬花时进行挂牌标记,扬花后10~12 d取标记穗子带回实验室,插入水中以免失水幼胚活性降低,置于4 ℃冰箱中低温处理1~2 d,然后用镊子剥出籽粒,75%酒精表面消毒约 1 min,无菌水冲洗2~3遍,15%NaClO消毒20 min,无菌水冲洗3~5遍。
1.2.3愈伤组织诱导及分化
消毒后的节节麦未成熟种子用镊子固定,用手术刀挑出幼胚(大小约为0.5~1.5 mm),盾片朝上接种在相应的愈伤组织诱导培养基上,每一皿培养基上接种大约80枚幼胚,每个处理重复3次,25 ± 1 ℃黑暗条件下培养,每两周更换一次培养基。将诱导30 d的愈伤组织转至相应的分化培养基上进行分化培养,此时应转入光照培养箱中培养,光强为2 500~3 000 lx,每天光照16 h,温度为25 ± 1 ℃,每两周更换一次培养基。
1.2.4生根和壮苗
将愈伤组织表面出现绿点、绿色芽苗及叶状结构的愈伤块转接于新鲜的分化培养基上进行芽苗诱导。待芽苗长至3~5 cm高时将这些芽苗或分蘖基部的愈伤块切除,再将芽苗转至生根培养基上进行生根培养。
1.2.5组培苗的移栽
准备好育苗基质,用水浸透。挑选根的长度为3~5 cm的组培苗进行移栽,移栽过程中尽可能清除多余的培养基。在移栽后的花钵上覆盖一层保鲜袋,防止植株失水,同时将移栽苗放在弱光条件下2 d,再除去保鲜袋,转在正常光照下培养。
1.3愈伤组织的观察和记录
幼胚接种到愈伤组织诱导培养基15 d后,观察愈伤组织出愈质量,并记录质量等级。“+”表示愈伤组织质量差,水浸状,质软,苍白色或者褐变,甚至死亡,或者愈伤块长有大量毛状根;“+ +”表示愈伤组织质量中等,淡黄色,比较干燥,有颗粒状胚性愈伤出现; “+++ ”表示愈伤组织质量高,黄色或淡黄色,表面呈不规则颗粒状,质地致密。
1.4数据统计
接种幼胚后7d统计诱导出的愈伤数,计算出愈率;转移至分化培养基之前,统计胚性愈伤数,计算胚性愈伤率;分化培养40 d后,统计愈伤组织分化率;分化出的绿芽转至生根培养基,计算成苗率。所有数据通过SPSS 18.0软件方进行差分析,显著性水平为P=0.05。
出愈率= 形成愈伤组织的幼胚数/接种幼胚数×100%;
胚性愈伤率= 形成胚性愈伤组织的幼胚数/ 接种幼胚数×100%;
愈伤分化率= 分化出绿芽原基或绿芽的愈伤组织块数/接种的愈伤组织数×100%;
成苗率=成苗数/接种愈伤组织数×100%。
2结果与分析
2.1不同处理对节节麦幼胚的诱导、分化及再生的影响
从图1和表2 可以看出,第3、8、9、16处理下节节麦的愈伤组织质量最高,第2、7、11、12、15处理的愈伤组织质量较差;出愈率较高的处理有3、5、15、16(分别为94.76%、93.62%、93.30%、94.38%),出愈率较低的处理有2、7、12、13(分别为83.41%、84.68%、85.77%、85.50%);胚性愈伤率较高的处理有3、8、9、16(分别为85.02%、78.10%、80.22%、82.40%),胚性愈伤率较低的处理有2、7、11、12(分别为50.22%、46.77%、44.84%、55.65%);愈伤分化率较高的处理有3、5、9、10(分别为59.29%、34.47%、63.12%、38.66%),愈伤分化率较低的处理有6、11、12、16(愈伤分化率分别为2.94%、3.59%、2.92%、3.97%);成苗率较高的处理有3、8、9、10(分别为16.21%、6.35%、17.62%、10.92%),成苗率较低的处理有6、12、13、16(分别为0、0、1.34%、0)。节节麦再生体系的建立最重要的是要得到组培再生苗,本实验16个处理中处理9的成苗率最高,因此这16个组合中处理9为最佳组合。
2.2试验因素重要性比较
综合分析影响节节麦幼胚愈伤组织诱导的各个因素,从表3可以看出,各因素的重要性依次为基本培养基> 2,4-D > 碳源,根据各因素的最佳水平,初步可以推断节节麦幼胚胚性愈伤率最高的组合为:MS培养基,2,4-D浓度为2 mg·L-1,碳源为麦芽糖。对试验各个因素进行方差分析,表3结果显示,基本培养基和2,4-D各水平间胚性愈伤率差异达显著水平(P<0.05),而碳源各水平间的胚性愈伤率差异不显著(P>0.05)。说明基本培养基和2,4-D对节节麦幼胚胚性愈伤组织诱导有很大影响,而碳源的作用并不明显。
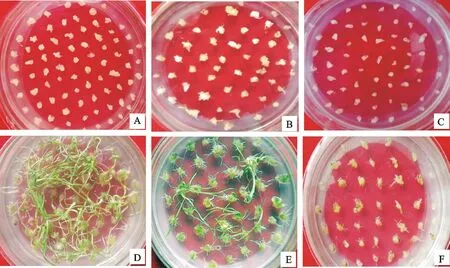
A、B、C分别为处理9、10、11诱导30 d的愈伤组织,D、E、F分别为处理9、10、11分化培养45 d的分化情况
The fig.A,B,C are the callus of treatment 9,10,11 induced for 30 days,respectively;The fig.D,E,F are the callus of treatment 9,10,11 induced for 45 days,respectively
图1节节麦幼胚部分处理的胚性愈伤及愈伤分化
Fig.1Images of embryonic callus and callus differentiation ofAegilopstauschiiimmature embryo for part of treatment
综合分析影响节节麦幼胚愈伤组织分化的各个因素,从表4可以看出,各因素的重要性依次为 KT>2,4-D>基本培养基>碳源。根据各因素的最佳水平,初步可以推断节节麦幼胚愈伤分化率最高的组合为:KT浓度为1.0 mg·L-1,2,4-D浓度为3 mg·L-1,MS培养基,碳源是15 mg·L-1蔗糖+15 mg·L-1甘露醇。对各个因素进行方差分析,结果显示KT各水平间愈伤分化率差异达显著水平(P<0.05),而2,4-D浓度、基本培养基和碳源的各水平间的愈伤分化率差异不显著(表4)。表明KT浓度对节节麦幼胚愈伤的分化有很大影响,而2,4-D浓度、基本培养基和碳源的作用不明显。为寻找各因素相应的最佳水平,还需进一步对试验各因素的不同水平进行多重比较。
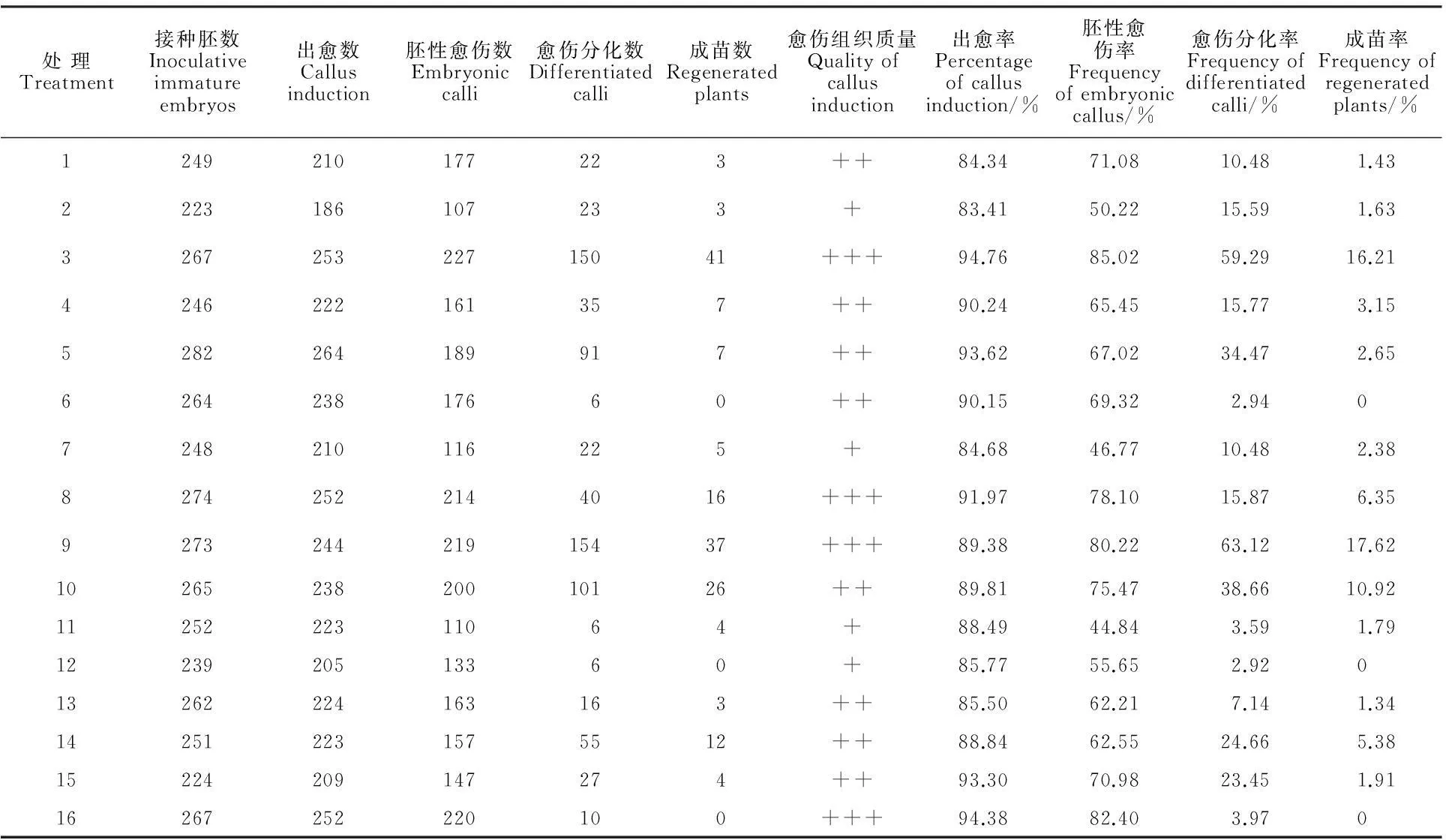
表2 不同处理对节节麦幼胚诱导、分化及再生的影响
“+”表示愈伤组织质量差;“+ +”表示愈伤组织质量中等;“+++ ”表示愈伤组织质量高
“+” shows poor quality of callus; “+ +” shows medium quality of callus; “+++” shows high quality of callus
2.3各试验因素对节节麦幼胚胚性愈伤率的影响
2.3.1基本培养基对胚性愈伤率的影响
表3结果表明,在本试验的3个因素中,基本培养基对胚性愈伤率影响最显著。3种培养基中,胚性愈伤率最高的是MS培养基,为74.41%;其次为N6培养基,为63.11%;最后是B5培养基,为54.41%。MS培养基与N6培养基对应的胚性愈伤率之间差异不显著,但与B5培养基对应的胚性愈伤率之间差异显著。就愈伤组织质量而言,MS培养基的愈伤组织质量最高,B5培养基培养基的愈伤组织易长出毛状根,质量最差。上述结果表明,在节节麦胚性愈伤组织诱导中MS培养基明显优于B5培养基,MS和N6两种基本培养基均可选用。
2.3.22,4-D浓度对胚性愈伤率的影响
从表3中可以看出,胚性愈伤率随2,4-D浓度的升高呈先升高后下降的趋势,当浓度达到2 mg·L-1时,胚性愈伤率达到最高(75.26%),而后明显下降。2,4-D浓度为2 mg·L-1时,所对应的胚性愈伤率显著高于浓度为1 mg·L-1和 4 mg·L-1的,但与浓度为3 mg·L-1时所对应的胚性愈伤率(74.81%)差异不显著。2,4-D浓度为1 mg·L-1时,愈伤组织易向分化方向发展,易长出毛状根和实生芽,导致愈伤组织质量下降,而当2,4-D浓度达到4 mg·L-1时,又会抑制胚性愈伤组织的形成,并导致所形成的愈伤组织生长较慢。据此推断,节节麦幼胚诱导愈伤组织2,4-D的最佳浓度为2 mg·L-1。
2.3.3碳源对胚性愈伤率的影响
由表3可知,碳源各水平所对应的胚性愈伤率之间的差异未达到显著水平。碳源各水平中,胚性愈伤率最高的是30 g·L-1麦芽糖(67.43%),最低的是15 mg·L-1蔗糖+15 mg·L-1山梨醇(65.73%)。由于四种碳源对节节麦胚性愈伤的诱导差异不显著,因此四种碳源均可选用。在实际操作中,为节省成本,可以直接选用蔗糖作为碳源。

表3 不同因素水平下的胚性愈伤率及水平间的差异显著性
同行数据后不同小写字母表示0.05水平上差异显著,不同大写字母表示0.01水平上差异显著。表4同
Different lower-case letters in the same line mean differences significant at 0.05 levels,and different upper-case letters mean difference significant at 0.01 levels,respectively.The same as in the table 4
2.4各试验因素对节节麦幼胚愈伤分化率的影响
2.4.1KT浓度对愈伤分化率的影响
表4结果表明,本研究的4个因素中,KT浓度对节节麦愈伤分化率影响最显著。愈伤分化率随KT浓度增加而减小,KT浓度为1 mg·L-1时愈伤分化率最高(33.71%),当浓度增加为1.5 mg·L-1和2 mg·L-1时愈伤分化率下降为9.27%和6.40%。KT浓度为1 mg·L-1时与浓度为1.5 mg·L-1和2.0 mg·L-1时愈伤分化率差异均达到显著水平,而KT浓度为1.5 mg·L-1时与2.0 mg·L-1时愈伤分化率差异不显著。因此,分化培养基中KT浓度选用1.0 mg·L-1时最好。
2.4.22,4-D浓度对愈伤分化率的影响
从表4中可以看出,愈伤分化率随2,4-D浓度的升高呈先升高后下降的趋势,当浓度达到3 mg·L-1时,愈伤分化率达到最高(33.35%),但2,4-D浓度的四个水平所对应的愈伤分化率之间并无显著差异,结合2,4-D对胚性愈伤率的影响,故应选用2,4-D的浓度为3 mg·L-1。
2.4.3基本培养基对愈伤分化率的影响
从表4可知,3种培养基中,愈伤分化率最高的是MS培养基(26.28%),其次为N6和B5培养基(分别为16.91%和13.62%),但MS培养基与N6和B5培养基对应的愈伤分化率之间的差异并不显著,表明在节节麦愈伤分化过程中三种培养基均可选用,结合基本培养基对胚性愈伤率的影响,应选用MS培养基。
2.4.4碳源对愈伤分化率的影响
四种碳源对应的愈伤分化率间的差异均未达到显著水平,四种碳源中愈伤分化率最高的是15 g·L-1蔗糖+15 g·L-1甘露醇(24.45%),其次为30 g·L-1蔗糖和30 g·L-1麦芽糖,愈伤分化率最低的是蔗糖+15 g·L-1山梨醇(16.73%)。因此,四种碳源均可选用,为节约成本,可选用蔗糖作为碳源。

表4 不同因素水平下的愈伤分化率及水平间的差异显著性
3讨 论
多数研究者认为,幼胚具有较高的愈伤组织诱导能力和较强的植株再生能力,是一种最有效最理想的外植体来源[12]。小麦幼胚高效再生体系的研究主要集中在幼胚基因型选取、培养基类型以及培养基中添加的激素种类和浓度等方面,并取得了一定的进展[5-10]。在基本培养基的选择上,大多数研究者认为MS培养基是适合小麦幼胚愈伤组织诱导的培养基,但王新国等[13]对小麦幼胚离体培养的研究发现,在MS、N6B5MS、B5和L3 这4 种培养基中,L3 培养基的出愈率及分化率最高。本研究选用MS、N6和B5三种基本培养基,发现在节节麦幼胚诱导愈伤过程中不同基本培养基对胚性愈伤率的影响程度最大,MS培养基不但愈伤质量最高而且出愈率和胚性愈伤率均最高,其次为N6培养基, B5培养基在愈伤诱导过程中愈伤块易长出一些毛状根,从而降低了愈伤质量,因此节节麦幼胚培养适宜选用MS培养基。本研究结果与大部分同类研究相似。在节节麦愈伤分化过程中,MS培养基对应的愈伤分化率最高,但不同基本培养基对应的愈伤分化率之间差异并不显著。
植物激素是培养基中的关键成分之一,其中,2,4-D和KT分别是小麦幼胚愈伤组织诱导和分化阶段常用的激素。多数研究者认为,在幼胚培养中2,4-D的适宜用量为2.0 mg·L-1[14-15]。KT的作用是促使细胞分裂,同时使得分裂朝着器官分化的方向进行,不同浓度的KT对小麦幼胚分化有较大影响。本研究结果表明,2,4-D对节节麦胚性愈伤的诱导影响十分显著,但不同浓度2,4-D对愈伤分化率影响并不显著。胚性愈伤率和愈伤分化率随2,4-D浓度的增加呈单峰曲线变化,胚性愈伤率最高时的2,4-D浓度为2 mg·L-1,愈伤分化率最高的2,4-D浓度为3 mg·L-1,这与在普通小麦中的研究结果相似[16-18]。最高的胚性愈伤率和愈伤分化率所对应的2,4-D浓度不同,其原因可能是由于节节麦幼胚在愈伤诱导过程中易长实生芽,适当提高2,4-D浓度有利于抑制实生芽的生成,提高愈伤组织的质量,从而提高愈伤分化率。因此,为提高节节麦幼胚再生率2,4-D浓度宜选用3 mg·L-1。在节节麦愈伤分化的研究中,KT对节节麦愈伤分化率影响最显著,愈伤分化率随KT浓度增加而减小,KT浓度为1 mg·L-1时愈伤分化率最高,且与浓度为1.5 mg·L-1和2.0 mg·L-1时愈伤分化率差异均达到显著水平。因此,分化培养基中KT浓度宜选用1.0 mg·L-1。
碳源不仅提供愈伤组织生长所需的能量,还起到调节培养基渗透压的作用。范学科等[12]在小麦幼胚愈伤组织诱导过程中发现,将蔗糖浓度从30 g·L-1降为15 g·L-1,同时加入15 g·L-1的甘露醇或山梨醇,能明显改善愈伤组织生长状态。本试验以30 g·L-1麦芽糖为碳源,胚性愈伤率要高于另外3种碳源,这与Francisco[19]的研究结果相同;以15 g·L-1蔗糖+15 g·L-1甘露醇为碳源时,愈伤分化率高于另外3种碳源,但四种碳源之间不论是胚性愈伤率还是愈伤分化率差异都不显著。因此在碳源的选择上可以直接选用30 g·L-1蔗糖。
本试验所研究的16个处理中,节节麦幼胚培养最佳体系为第9个处理,即诱导培养基为MS培养基+ 3.0 mg·L-12,4-D+30 g·L-1麦芽糖,分化培养基为:MS培养基+30 g·L-1麦芽糖+1.0 mg·L-1KT 。而通过正交设计的计算结果,推算出的最佳组合为诱导培养基:MS培养基+3.0 mg·L-12,4-D+15 g·L-1蔗糖+15 g·L-1甘露醇;分化培养基:MS培养基+15 g·L-1蔗糖+15 g·L-1甘露醇+ 1.0 mg·L-1KT。两个培养体系之所以有差异是因为本试验所研究的16个处理是4因素完全正交所对应的144个处理中的一小部分,因此,经推论所得出的结果才是理论上所有处理中最优的节节麦再生体系。
参考文献:
[1]喻修道,徐兆师,陈 明,等.小麦转基因技术研究及其应用[J].中国农业科学,2010,43(8):1539-1553.
Yu X D,Xu Z S,Chen M,etal.The progress and application of wheat transformation technology [J].ScientiaAgriculturaSinica,2010,43(8):1539-1553.
[2]Brenchley R.Analysis of the bread wheat genome using whole-genomeshotgun sequencing [J].Nature,2012,491:705-710.
[3]Reif J C,Zhang P,Dreisigacker S,etal.Wheat genetic diversity trends during domestication and breeding [J].TheoriticalandAppliedGenetics,2005,110:859-864.
[4]Colmer T D,Flowers J,Munns R,etal.Use of wild relatives to improve salt tolerance in wheat [J].JournalofExperimentBotany,2006,57:1059-1078.
[5]邢莉萍,王华忠,蒋正宁,等.小麦幼胚再生培养体系优化及优良转化受体基因型的筛选[J].麦类作物学报,2008,28(2):187 -192.
Xing L P,Wang H Z,Jiang Z N,etal.Optimiztion of regeneration culture system from immature embryos and selection of the suitable genotype as transformation acceptor in wheat [J].JournalofTriticeaeCrops,2008,28(2):187-192.
[6]王 姗,闵东红.关中地区不同小麦品种幼胚离体培养特性差异比较[J].安徽农学通报,2012,18(2):20-22.
Wang S,Min D H.Difference comparison of immature embryo culture in vitro of different wheat cultivars in Guanzhong area [J].AnhuiAgriculturalScienceBulletin,2012,18(2):20-22.
[7]林 毅,高俊山,李 艳,等.不同培养基对小麦幼胚再生能力的影响[J].安徽农业大学学报,2003,30(1):6-9.
Lin Y,Gao J S,Li Y,etal.Effects of different media on regenerative ability about wheat embryos [J].JournalofAnhuiAgriculturalUniversity,2003,30(1):6-9.
[8]赵占军,陈茂盛,王贵娟,等.胚龄和激素对小麦幼胚组织培养的影响[J].生物技术,2003,13(5):7-8.
Zhao Z J,Chen M S,Wang G J,etal.Effect of age of immature embryos and exogenous hormones on the tissue culture from immature embryos of wheat [J].Biotechnology,2003,13(5):7-8.
[9]蒋 苏,马鸿翔,魏芳,等.NAA或潮霉素对小麦成熟胚愈伤组织分化的影响[J].分子植物育种,2012,10(1):35-41.
Jiang S,Ma H X,Wei F,etal.Effects of NAA or hygromycin on differentiation of calli induced from mature embryo in wheat [J].MolecularPlantBreeding,2012,10(1):35-41.
[10]别晓敏,杜丽璞,佘茂云,等.不同生长素类型及ABA 搭配对小麦幼胚再生效果的影响[J].核农学,2011,25(5):1023-1028.
Bie X M,Du L P,She M Y,etal.Effects of different auxins and combining application with ABA on regeneration of immature embryos of wheat [J].JournalofNuclearAgriculturalSciences,2011,25(5):1023-1028.
[11]范学科,王亚红,奚亚军,等.小麦幼胚愈伤组织诱导影响因素的研究[J].中国农学通报,2007,23(11):68-71.
Fang X K,Wang Y H,Xi Y J,etal.Studies on the factors affecting callus induction from wheat immature embryo [J].ChineseAgriculturalScienceBulletin,2007,23(11):68-70.
[12]Li J R,Ye X G,An B Y,etal.Genetic transformation of wheat:current status and future prospects [J].PlantBiotechnologyReports,2012,6:183-193.
[13]王新国,任江萍,李 磊,等.不同培养基及激素配比对小麦幼胚离体培养的影响[J].麦类作物学报,2005,25(2):5-8.
Wang X G,Ren J P,Li L,etal.Effects of different media and hormone proportions on wheat embryos culture in vitro [J].JournalofTriticeaeCrops,2005,25(2):5-8.
[14]Redway F A,Vasil V,Vasil I K.Characterization and regeneration of wheat (TriticumaestivumL.) embryogenic cell suspension cultures[J].PlantCellReports,1990,8(12):714 -717.
[15]Altpeter F,Vasil V,Srivastava V,etal.Accelerated production of transgenic wheat (TriticumaestivumL.) plants[J].PlantCellReports,1996,16:12-17.
[16]余桂荣,尹 钧,郭天财,等.小麦幼胚培养基因型的筛选[J].麦类作物学报,2003,23(2):14-18.
Yu G R,Yi J,Guo T C,etal.Selection of the optimum genotype for immature embryo culture of wheat [J].JournalofTriticeaeCrops,2003,23(2):14-18.
[17]Ozias-Aking P.Plant regeneration from cultured immature embryos and inflorescences ofTriticumaestivumL.(wheat): evidence for somatic embryogenesis [J].Prltoplasma,1982,110:95-105.
[18]陈学虎,陈耀锋,王 丽,等.基因型和2,4-D浓度对小麦不同外植体离体培养特性的影响[J].麦类作物学报,2013,33(3):450-454.
Chen X H,Chen Y F,Wang L,etal.Study on the effects of genotypes and 2,4-D concentration on in vitro culture traits of explants[J].JournalofTriticeaeCrops,2013,33(3):450-454.
[19]Francisco S,Antonio M,Paul A L,etal.Medium optimization for efficient somatic embryo genesis and plant regeneration from immature,inflorescences and immature scutella of elite cultivars of wheat,barley and tritordeum [J].Euphytica,1999,108:161-167.
Establishment of Regeneration System for Immature Embryo ofAegilopstauschii
XU Feng,LI Chunlian,LI Yang,CHAI Guaiqiang,WANG Zhonghua
(Northwest A&F University,College of Agronomy,Yangling,Shaanxi 712100,China)
Abstract:Establishment of a high efficient regeneration system for immature embryo (IEs) of Aegilops tauschii will provide a convenient tool for tissue culture and transformation,thereby facilitating the transformation of foreign genes into wheat. By using the IEs derived from an elite Ae.tauschii ssp. strangulata accession AW1,the effects of some factors,including basal medium,carbon sources,two auxins,2,4-Dichlorophenoxyacetic acid (2,4-D) and 6-Furfurylaminopurine (KT),on callus induction and plant regeneration were evaluated. The results indicated that MS basal medium significantly affects the callus induction and differentiation of Ae.tauschii IEs. The concentration of 2,4-D has a significant effect on the capacity of embryogenic callus. The media supplemented with 3.0 mg·L-12,4-D led to the induction of most high-quality embryogenic calli with pale,smooth,and compact nodules. KT played an important role in IEs differentiation. There is no significant difference among the basal medium,2,4-D and carbon source for IEs differentiation. The differences of the effects of carbon source on embryogenic callus induction and differentiation of IEs are not significant and 30 g·L-1sucrose is optimal in practice for cost saving. Overall,culture system of MS+15 g·L-1sucrose+15 g·L-1mannitol +3.0 mg·L-12,4-D is optimal for embryogenic callus induction and culture system of MS+15 g·L-1sucrose+15 g·L-1mannitol is optimal for plant regeneration of Ae.tauschii IEs.
Key words:Aegilops tauschii; Immature embryo culture; Callus induction; Plant regeneration
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)02-0150-07
通讯作者:王中华(E-mail:zhonghuawang@nwsuaf.edu.cn)
基金项目:国家自然科学基金项目(31271794)
收稿日期:2015-10-30修回日期:2015-11-15
网络出版时间:2016-01-26
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160126.1944.008.html
第一作者E-mail:xufeng100201@163.com
