小麦体细胞无性系HMW-GS组成、蛋白质和赖氨酸含量及SSR位点变异分析
2016-05-27杨随庄叶春雷欧巧明王红梅罗俊杰
王 炜,杨随庄,叶春雷,陈 琛,欧巧明,王红梅,罗俊杰
(1.甘肃省农业科学院生物技术研究所,甘肃兰州 730070; 2.西南科技大学生命科学与工程学院,四川绵阳 621010)
小麦体细胞无性系HMW-GS组成、蛋白质和赖氨酸含量及SSR位点变异分析
王 炜1,杨随庄2,叶春雷1,陈 琛1,欧巧明1,王红梅1,罗俊杰1
(1.甘肃省农业科学院生物技术研究所,甘肃兰州 730070; 2.西南科技大学生命科学与工程学院,四川绵阳 621010)
摘要:为明确小麦体细胞无性系后代材料的蛋白质和赖氨酸含量、HMW-GS及SSR位点变异情况,对宁春4号、陇春21号和花培9355三个小麦品种的无性系R4和R5代材料的蛋白质和赖氨酸含量、HMW-GS组成及SSR位点进行检测和鉴定,并分析其变异情况。结果表明,三个小麦品种无性系后代中,编码HMW-GS的三个位点均可发生变异,不同基因型材料的无性系后代的变异频率和位点并不相同,同一基因型无性系后代的不同编码位点的变异频率也不相同;蛋白质和赖氨酸含量出现超亲变异,其中大部分材料在R4代中表现出的变异性状能够稳定传递到R5代中。小麦体细胞无性系SSR位点的变异具有基因型依赖性,蛋白质和赖氨酸含量的变异频率与SSR位点变异频率无直接的相关性。
关键词:小麦;体细胞无性系;变异;品质育种
小麦品质包括营养品质和加工品质。小麦籽粒的蛋白质含量对其营养品质和加工品质均有重要影响,蛋白质含量的提高,有利于小麦品质的改善[1]。小麦蛋白质的氨基酸组成极不平衡,赖氨酸、苏氨酸、异亮氨酸等含量较低,其中赖氨酸的含量只能满足人体需要的45%,因此被称为小麦的第一限制性氨基酸[2]。麦谷蛋白约占小麦籽粒总蛋白质的10%和面筋蛋白的35%,对小麦的加工品质有决定作用[3]。利用SDS-PAGE技术,可将小麦麦谷蛋白分为高分子量麦谷蛋白亚基(HMW-GS)和低分子量麦谷蛋白亚基(LMW-GS),其中HMW-GS的组成和含量是影响小麦烘烤品质的重要因素[4-5],也是目前国内小麦品种烘烤品质的主要限制因子[6]。因此,提高小麦籽粒的蛋白质和赖氨酸含量、改变HMW-GS的组成,是目前我国小麦品质育种的优先目标和重要任务[2,7-8]。
大量研究表明,体细胞无性系变异是植物组织培养过程中出现的普遍现象,且绝大多数变异可以遗传,因此可用于作物的遗传改良[9-14]。对小麦体细胞无性系变异的研究表明,小麦籽粒蛋白质和氨基酸含量、HMW-GS亚基组成均可产生明显变异[15-18],提示利用体细胞无性系变异可进行小麦品质性状改良。目前,对于小麦体细胞无性系变异的大部分研究仅局限于单一品质性状,如蛋白质或赖氨酸含量、HMW-GS组成,对小麦体细胞无性系变异后代在不同品质性状变异上的相关性、变异的生化与分子基础方面的报道较少。本研究以小麦品种宁春4号、陇春21号和花培9355及其农艺性状已稳定的194份R4和R5代体细胞无性系后代为材料,检测、鉴定这些材料的蛋白质含量、赖氨酸含量、HMW-GS组成及SSR位点,分析这些性状的变异情况,以期获得具有优异品质性状的体细胞无性系小麦种质材料,为补充和完善体细胞无性系品质变异机理提供一定支持,为利用体细胞无性系变异进行小麦种质资源创制和品质改良提供理论依据。
1材料与方法
1.1供试材料
以小麦品种宁春4号、陇春21号、花培9355及其幼胚培养所获得的农艺性状已稳定的194个R4代及R5代为试验材料,其中宁春4号无性系后代材料40份,陇春21号无性系后代材料62份,花培9355无性系后代材料92份。194个材料的获得和培养方法同前期工作[14]。
1.2检测项目与方法
1.2.1小麦籽粒蛋白质和赖氨酸含量测定
选取完整无虫蛀的无性系R4和R5代小麦种子(50 g)置于60℃恒温箱中干燥5~6 h,待室温后用旋式粉碎机磨碎,过0.25 mm筛后于磨口瓶中备用。蛋白质含量测定采用凯氏法(GB5511-85);赖氨酸含量测定采用染料结合法(GB4801-1984)。以各自当年收获的供体亲本种子为对照,结果均以全麦粉干基表示。
1.2.2HMW-GS组成检测
参考欧巧明等[6]和叶春雷等[19]的方法,采用不连续SDS-PAGE法对小麦宁春4号、陇春21号和花培9355的各6份R5代无性系后代材料进行HMW-GS组成检测,亚基的编码和命名参照Payne等的方法[20]。
1.2.3SSR位点的PCR扩增
参考杨随庄等[21]方法,利用所筛选的多态性较好的30对SSR引物对小麦宁春4号、陇春21号和花培9355的各6份R5无性系后代材料进行PCR扩增,引物序列代号分别为Xgwm6-4D、Xgwm33-1A、Xgwm47-2A、Xgwm60-7A、Xgwm72-3B、Xgwm88-6B、Xgwm95-2A、Xgwm99-1A、Xgwm113-4B、Xgwm120-2B、Xgwm131-1B、Xgwm157-2D、Xgwm159-5B、Xgwm161-3D、Xgwm169-6A、Xgwm194-4D、Xgwm219-6B、Xgwm257-2B、 Xgwm272-5D、Xgwm325-6D、Xgwm339-2A、Xgwm340-3B、Xgwm357-1A、Xgwm495-3B、Xgwm512-2A、Xgwm513-4B、 Xgwm537-7B、Xgwm539-2D、Xgwm577-7B、Xgwm583-5D,由上海生工生物工程技术服务有限公司合成。
1.3数据处理
利用SPSS 13.0软件进行方差分析和多重比较;利用EXCEL 2003软件作图。
2结果与分析
2.1蛋白质含量的变异与遗传
由图1可知,42份宁春4号(WSNC 4)、60份陇春21号(WSLC 21)和92份花培9355(WSHP 9355)的无性系R4代材料中,籽粒蛋白质含量较亲本显著增高的比例均超过50%(P<0.05),显著低于亲本的材料比例均小于10%。以WSNC 4为例,亲本的蛋白质含量为13.89%,其42份R4代无性系材料的蛋白质含量介于12.52%~17.97%之间,平均值为16.27%,蛋白质含量平均较亲本提高了17.13%;27份材料的蛋白质含量显著高于对照,占测定材料数的64.29%;与亲本差异不显著的有12份,占28.57%;显著低于亲本的仅有3份,占7.14%。WSLC 21和WSHP 9355的无性系R4代材料的籽粒蛋白质含量的分布规律与WSNC4相似。可见, WSNC 4、WSLC 21和WSHP 9355无性系R4代蛋白质含量变异均有向高蛋白质含量方向变异的趋势,平均比亲本高17.13%、26.62%和9.38%。WSNC 4、WSLC 21和WSHP 9355的无性系R5代材料的蛋白质含量显著高于相应亲本的分别占52.38%、51.67%和63.04%。说明小麦无性系材料在R4代表现出的蛋白质含量变异性状能够较稳定地传递到R5代。
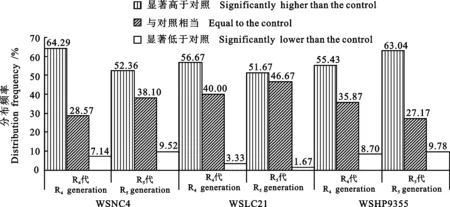
图1 小麦体细胞无性系R4和R5代材料蛋白质含量的分布频率
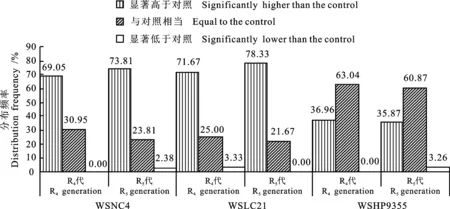
图2 小麦体细胞无性系R4和R5代材料赖氨酸含量的分布频率
2.2赖氨酸含量的变异与遗传
WSNC 4的赖氨酸含量为0.45%,参试的42份R4无性系后代材料的赖氨酸含量介于0.44%~0.60%之间,平均值为0.55%,赖氨酸含量平均较亲本提高了22.22%;29份(69.05%)材料的赖氨酸含量显著高于亲本(P<0.05),13份(30.95%)材料与亲本差异不显著(图2)。WSLC 21的R4无性系后代的赖氨酸含量平均较亲本提高了12.50%,有43份(71.67%)材料的赖氨酸含量显著高于亲本。WSHP 9355的R4代无性系材料的赖氨酸含量平均较亲本提高了6.52%,34份(36.96%)材料的赖氨酸含量显著高于亲本,63.04%材料与其亲本差异不显著。与其蛋白质含量进行比较发现,相同蛋白质含量时,WSNC4、WSLC21的R4无性系后代材料的赖氨酸含量有提高变异趋势,WSHP9355的R4后代高赖氨酸含量有降低变异趋势。3个小麦品种的R5代无性系材料的赖氨酸含量与R4代变化趋势相同,WSNC 4、WSLC 21和WSHP 9355的R5代无性系材料的赖氨酸含量分别有73.81%、78.33%和35.87%显著高于相应的亲本。说明大部分材料在无性系R4代表现出的赖氨酸含量变异性状亦能够稳定传递到R5代。
2.3HMW-GS变异分析
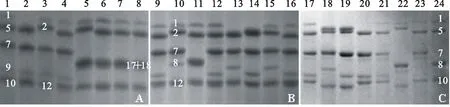
1:Zhongyou 9507;2 WSNC 4-1; 3:WSNC 4-2; 4: WSNC 4-3; 5: WSNC 4-4; 6: WSNC 4-5; 7:WSNC 4-6; 8: WSNC 4; 9 : Zhongyou 9507: 10: WSLC 21; 11:WSLC 21-1; 12:WSLC 21-2; 13:WSLC 21-3; 14:WSLC 21-4; 15:WSLC 21-5; 16: WSLC 21-6; 17 :Zhongyou 9507; 18:WSHP 9355-1; 19:WSHP 9355-2; 20: WSHP 9355-3; 21:WSHP 93554-4; 22:WSHP 9355-5; 23:WSHP 9355-6; 24: WSHP 9355
图3WSNC 4(A)、WSLC 21(B)和WSHP 9355(C)及其亲本无性系R5代的HMW-GS组成比较
Fig.3HMW-GS composition of wheat R5somaclonal lines and their donor parents
从WSNC 4、WSLC 21和WSHP 9355的R5代无性系后代中各随机选取6份材料,利用SDS-PAGE电泳法对其HMW-GS组成进行鉴定分析。结果显示,大部分材料的亚基组成发生了变异(图3)。WSNC 4的HMW-GS组成为1、17+18、5+10,在被测的6份无性系R5代材料中,4份材料(WSNC 4-1至WSNC 4-4)的HMW-GS组成发生了变异,变异频率为66.67%,其中在两个位点发生变异的有WSNC 4-1和WSNC 4-2,WSNC 4-1在Glu-A1位点的表达产物缺失,在 Glu-B1位点的表达产物由供体亲本的17+18亚基变为7+9;WSNC 4-2在 Glu-B1位点的表达由17+18变为7+9,在 Glu-D1位点由5+10变为2+12;WSNC 4-3在 Glu-B1位点的表达由17+18变为7+9;WSNC 4-4在 Glu-D1位点的表达由5+10变为2+12。
WSLC 21的HMW-GS组成为1、7+8、2+12,参试的6份无性系R5代材料(WSLC21-1至WSLC21-6)的HMW-GS组成均发生了变异,变异频率为100%。WSLC 21-1在 Glu-B1位点的表达由供体亲本的7+8变为17+18,在 Glu-D1位点2+12变为5+10;WSLC 21-2在 Glu-B1位点的表达由7+8变为7+9, Glu-D1位点由2+12变为5+10;WSLC 21-3在 Glu-A1位点的表达缺失, Glu-D1位点由2+12变为5+10;WSLC 21-4的表达 Glu-A1位点的表达缺失,在 Glu-B1位点的表达由7+8变为7+9;WSLC 21-5在 Glu-B1位点的表达由7+8变为7+8*;WSLC 21-6在 Glu-B1位点的表达由7+8变为7+9,在 Glu-D1位点的表达由2+12变为5+10。
WSHP 9355的HMW-GS组成为1、7+8、5+10,参试的6份无性系R5材料(WSHP 9355-1至WSHP 9355-6)的HMW-GS亚基组成均发生了变异,变异频率为100%。其中WSHP 9355-1和WSHP 9355-2在 Glu-A1位点基因的表达产物由供体亲本的1变为1*,在 Glu-D1则由5+10变为2+12;WSHP 9355-2在 Glu-B1位点的表达由7+8变为7+9;WSHP 9355-3在 Glu-A1位点缺失,在 Glu-B1位点的表达由7+8变为7+9;WSHP 9355-4在 Glu-B1位点的表达由7+8变为7+9;WSHP 9355-5在 Glu-D1位点的表达由5+10变为2+12;WSHP 9355-6在 Glu-B1位点的表达由7+8变为7+9。
由上可知,无性系材料在HMW-GS的所有位点均可产生变异,不同基因型材料的无性系后代HMW-GS变异频率和编码位点并不相同,同一基因型的无性系后代的不同HMW-GS编码位点的变异频率也不相同。总体来说, Glu-B1位点的变异频率最高,为77.78%,其次为 Glu-D1位点,为55.56%, Glu-A1位点的变异频率最低,为27.68%。
2.4无性系SSR位点变异分析

1: WSNC 4-1; 2:WSNC 4-2; 3:WSNC 4-3; 4:WSNC 4-4; 5:WSNC 4-5; 6:WSNC 4-6; CK(A):WSNC 4,M:Marker (200bp); 7:WSLC 21-1; 8:WSLC 21-2; 9:WSLC 21-3; 10:WSLC 21-4; 11:WSLC 21-5; 12:WSLC 21-6 ; CK(B):WSLC 21; 13:WSHP 9355-1; 14:WSHP 9355-2; 15:WSHP 9355-3;16:WSHP 9355-4; 17:WSHP 9355-5; 18:WSHP 9355-6; CK(C):WSHP 9355
图4用Xgwm 495(A)、Xgwm 513(B)、Xgwm 495(C) 对R5无性系后代及其亲本的PCR扩增图
Fig.4PCR amplification in wheat R5somaclonal lines and their donor parents
using Xgwm 495(A),Xgwm 513(B),Xgwm 495(C)
分别利用所筛选的多态性较好的30对SSR引物对3个小麦品种的R5无性系后代材料进行PCR扩增,结果显示,被测材料均出现多态性位点(图4),PCR扩增片段迁移率增大或减小的出现频率显著高于缺失或出现新的PCR扩增片段的频率(表1)。WSNC 4中,PCR扩增片段增大的平均为3.2个位点,减小的为2.6个位点,片段增加和缺失的均为0.6个位点,SSR位点的平均变异频率为23.33%;WSLC 21中,PCR扩增片段增大的平均为3.4个位点,减小的为3.6个位点,片段增加的为0.4个位点,缺失的为0.6个位点,SSR位点的平均变异频率为27.22%;WSHP 9355中,PCR扩增片段增大和减小的位点平均分别为4.9和4.8,片段增加的为0.4个位点,缺失的为1.4个位点,SSR位点的平均变异频率为35.09%。由此可以看出,不同小麦品种的R5无性系后代材料的变异频率不尽相同,说明在无性系材料中,SSR位点的变异具有基因型依赖性。蛋白质和赖氨酸含量的变异幅度与SSR位点变异频率无相关性(表1),如WSNC 4-1的蛋白质和赖氨酸含量分别为17.56%和0.52%,其SSR位点变异频率为20.00%,WSNC 4-3的蛋白质和赖氨酸含量分别为13.66%和0.49%,其SSR位点变异频率为36.67%。
3讨 论
小麦籽粒蛋白质含量是衡量其加工品质和营养品质的重要指标,也是小麦品种审定和商品小麦定级的主要指标之一。小麦籽粒蛋白质含量是由多基因控制的数量性状,同时受环境因素的影响[7,22],应用常规育种方法很难获得超高品种。研究表明,采用组织培养[15-16]、外源DNA导入[6]和辐射诱变[23]等手段,可增加小麦籽粒蛋白质含量变异频率,促进小麦的品质改良。本研究通过对3个小麦品种的幼胚进行培养,在R4代获得了蛋白质含量与原亲本有明显差异的无性系后代变异材料,且绝大部分材料蛋白质含量的超亲变异性状能够遗传到R5代,与朱至清[13]等、王 培[15]等研究结果类似,进一步证明了利用体细胞无性系变异提高小麦籽粒蛋白含量的有效性和可行性。
小麦是我国北方地区人民重要的食物和营养来源。小麦籽粒中赖氨酸含量很低,远远不能满足人体的需要,因此提高小麦蛋白质中赖氨酸含量至关重要[24]。已有研究表明,在高蛋白质含量的小麦体细胞无性系材料中,各种氨基酸绝对含量也相应增高[16]。本研究结果表明,小麦体细胞无性系后代材料的赖氨酸含量具有超亲变异并可遗传。在蛋白质含量超过亲本的无性系材料中,有85%的无性系材料的赖氨酸含量超过其亲本,然而赖氨酸含量与蛋白质含量并不相关,这与宋亚珍等的报道相似[25]。
麦谷蛋白是小麦蛋白的主要成分之一,对小麦的加工品质有重要影响[6,8,17]。小麦高分子量麦谷蛋白(HMW-GS)由遗传控制,其等位变异丰富,HMW-GS的3个位点(Glu-A1、Glu-B1和Glu-D1)对品质的贡献存在加性效应,是影响小麦面筋品质的重要因素[3,24]。目前普遍认为 Glu-A1位点编码的1、2*、Glu-B1位点编码的7+8、17+18、Glu-D1位点编码的5+10等亚基通常赋予面团良好的弹性和韧性,具有较好的品质效应。检测小麦品种的 HMW-GS 组成已成为国内外评价和预测小麦品质的主要依据[19,26]。研究表明,经组织培养所获得的体细胞无性系后代材料的HMW-GS亚基组成可产生变异并可稳定遗传[27]。本研究中,3个小麦品种的R5代无性系材料的HMW-GS亚基组成均有变异且变异频率较高。宁春4号和花培9355均具有较好的优质亚基组成,其HMW-GS位点发生的变异主要为负向变异,即由优质亚基变为劣质亚基,陇春21号的无性系后代材料中,存在劣质亚基(2+12)变为优质亚基(5+10)的现象。结合张怀刚等人的研究[17,27],认为体细胞无性系变异是对HMW-GS亚基组成较差的品种进行改良的途径之一。
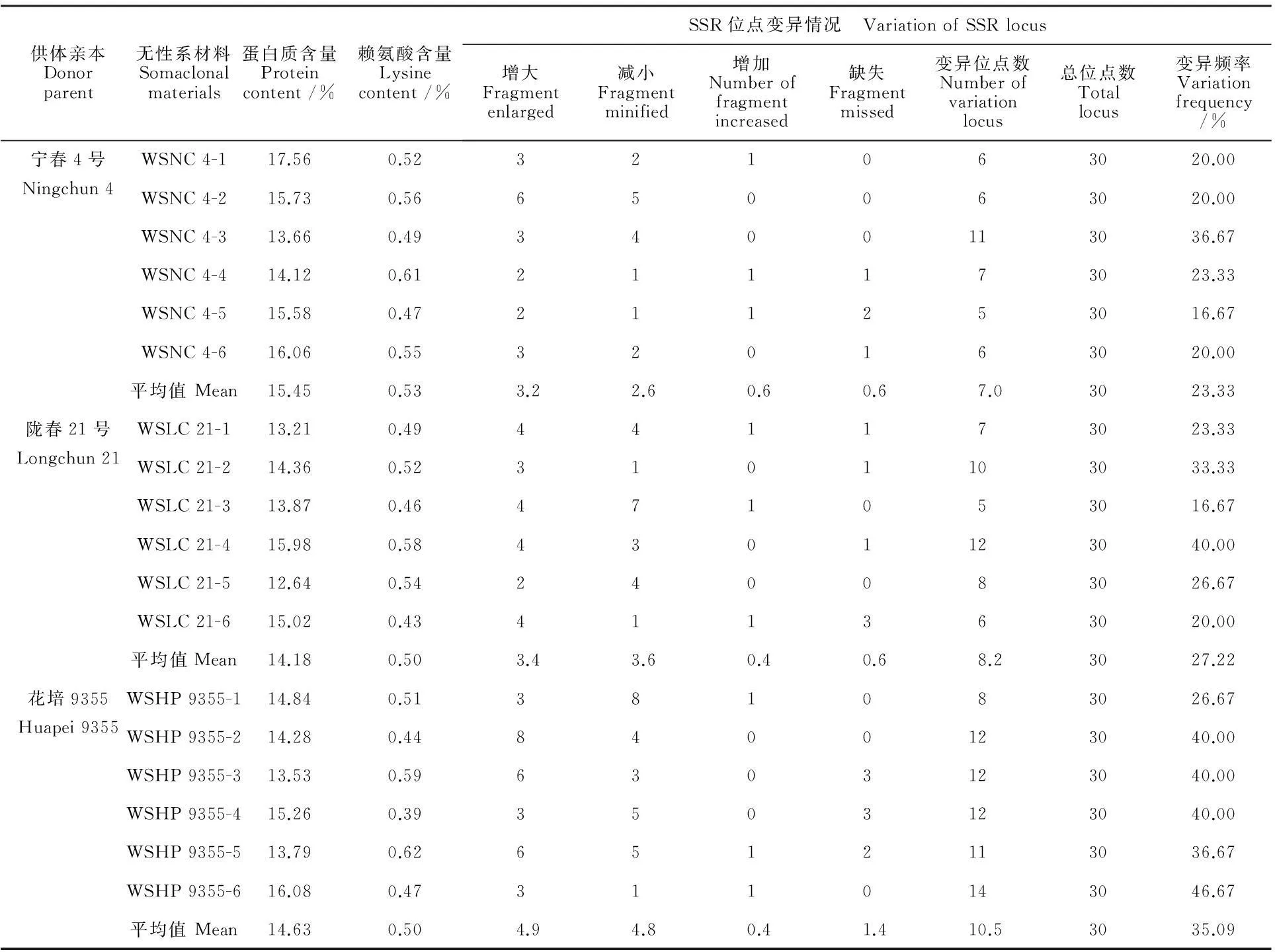
表1 3个小麦品种体细胞无性系R5代材料的SSR位点变异
Ryan[9]、胡尚连[28]等研究结果表明,蛋白质含量变异能够遗传。本研究中,3个小麦品种的R5无性系后代材料存在HMW-GS亚基组成较原亲本差、籽粒蛋白质和赖氨酸含量比相应亲本低的情况,这进一步说明体细胞无性系变异的双向性。由于变异的后代中会出现亚基组成较优、蛋白质和赖氨酸含量较高的株系,因而体细胞无性系变异方法不失为一种小麦品质改良的有效手段。
植物组织培养所产生的无性系变异有其遗传基础,目前的研究认为体细胞无性系变异是由于染色体核型的改变、基因突变、碱基序列改变、基因扩增或丢失、基因重排、DNA甲基化、转座子插入而影响基因的表达等原因所造成[27,29-31]。前期研究表明,在小麦体细胞无性系后代材料中的SSR位点发生了变异,出现PCR扩增片段的增大、减小、增加或缺失的现象,SSR位点变异频率和基因型有关[21],本研究的结果与此类似,并发现蛋白质和赖氨酸含量的变异幅度与SSR位点变异频率并无直接的相关性。由SDS-PAGE电泳法进行小麦HMW-GS检测发现,小麦无性系后代的HMW-GS编码基因或调节基因与亲本有一定变异,其确切的分子机制有待于进一步的研究。
4结 论
4.1小麦体细胞无性系后代蛋白质和赖氨酸含量具有超亲变异,其中大部分材料在R4代中表现出的这种变异性状能够稳定传递到R5代中。
4.2小麦体细胞无性系材料在三个编码HMW-GS的位点均可产生变异,不同基因型材料的无性系后代的HMW-GS变异频率和编码位点并不相同,同一基因型的无性系后代的不同HMW-GS编码位点变异频率也不相同。
4.3小麦体细胞无性系SSR位点的变异具有基因型依赖性;蛋白质和赖氨酸含量的变异幅度与SSR位点变异频率无直接的相关性。
参考文献:
[1]张 钟,程美林,王 丽,等.发芽对小麦品质的影响[J].中国粮油学报,2014,29(1):11-16.
Zhang Z,Cheng M L,Wang L,etal.Effect of germination on the quality of wheat [J].JournalofChineseCerealsandOilsAssociation,2014,29(1):11-16.
[2]姜小苓,关西贞,茹振钢,等.中国小麦微核心种质籽粒赖氨酸含量分析[J].中国粮油学报,2012,27(11):1-5.
Jiang X L,Guan X Z,Ru Z G,etal.Analysis of lysine concentration in grains of Chinese wheat micro-core collections [J].JournalofChineseCerealsandOilsAssociation,2012,27(11):1-5.
[3]雷振生,刘 丽,王美芳,等.HMW-GS和LMW-GS组成对小麦加工品质的影响[J].作物学报,2009,35(2):203-210.
Lei Z S,Liu L,Wang M F,etal.Effect of HMW and LMW glutenin subunits on processing quality in common wheat [J].ActaAgronomicaSinica,2009,35(2):203-210.
[4]相吉山,马晓岗.青海省小麦主栽品种高分子量谷蛋白亚基组成分析[J].麦类作物学报,2008,28(2):238-242.
Xiang J S,Ma X G..Analysis on the high molecular weight glutenin subunits (HMW-GS) of main wheat cultivars in Qinghai province [J].JournalofTriticeaeCrops,2008,28(2):238-242.
[5]郭志富,衣 莹,龙翔宇,等.东北春小麦及部分外引小麦高分子量谷蛋白亚基组成分析[J].华北农学报,2008,23(2):72-76.
Guo Z F,Yi Y,Long X Y,etal.Analysis on high-molecular-weight glutenin subunit composition of spring wheat in Northeast China and introduced wheat [J].ActaAgriculturaeBoreali-Sinica,2008,23(2):72-76.
[6]欧巧明,倪建福,崔文娟,等.高粱DNA导入引起小麦HMW-GS的变异及其品质改良和变异机理分析[J].中国粮油学报,2011,26(1):15-19.
Ou Q M,Ni J F,Cui W J,etal.Introducing sorghum DNA into spring wheat HMW-GS variation quality improvement and its mechanisms [J].JournalofChineseCerealsandOilsAssociation,2011,26(1):15-19.
[7]Balyan H S,Gupta P K,Kumar S,etal.Genetic improvement of grain protein content and other health-related constituents of wheat grain [J].PlantBreeding,2013,132(5):446-457.
[8]陈新民,张 艳,夏先春,等.高分子量麦谷蛋白亚基分子标记在小麦品种改良中的应用[J].麦类作物学报,2012,32(5):960-966.
Chen X M,Zhang Y,Xia X C,etal.Application of molecular markers of HMW-GS in wheat improvement [J].JournalofTriticeaeCrops,2012,32(5):960-966.
[9]Ryan S A,Larkin P J,Ellison F W.Somaclonal variation in some agronomic and quality characters in wheat [J].TheoreticalandAppliedGenetics,1987,74(1):77-82.
[10]孙光祖,王广金,陈义纯,等.小麦抗赤霉病突变体的选育及其变异研究[J].核农学报,1995,9(1):1-6.
Sun G Z,Wang G J,Chen Y C,etal.Variations and selection of wheat mutant resistant to scab [J].JournalofAgriculturalNuclearSciences,1995,9(1):1-6.
[11]Mohan S J.Tissue culture derived variation in crop improvement [J].Euphytica,2001,118(2):153-160.
[12]孙振元,韩 蕾,李银凤.植物体细胞无性系变异的研究与应用[J].核农学报,2005,19(6):479-484.
Sun Z Y,Han L,Li Y F.Progress in the study and application of plant somaclonal variation[J].JournalofAgriculturalNuclearSciences,2005,19(6):479-484.
[13]汪勋清,刘录祥.植物细胞工程研究应用与展望[J].核农学报,2008,22(5):635-639.
Wang X Q,Liu L X.Plant cell engineering:current research,application and future prospects [J].JournalofAgriculturalNuclearSciences,2008,22(5):635-639.
[14]王 炜,杨随庄,谢志军,等.小麦体细胞无性系变异及4-8抗条锈遗传分析[J].核农学报,2014,28(10):1751-1759.
Wang W,Yang S Z,Xie Z J,etal.Wheat somaclonal variation and genetic analysisi on the resistance toPucciniastriiformisf.sp.Triticiin somaclonal line 4-8 [J].JournalofAgriculturalNuclearSciences,2014,28(10):1751-1759.
[15]Carver B F,Johnson B B.Partitioning of variation derived from tissue culture of winter wheat [J].TheoreticalandAppliedGenetics,1989,78(3):405-410.
[16]朱至清,桑建利,王玉秀,等.体细胞无性系变异培育高蛋白小麦种质[J].植物学报(英文版),1992,34(12):912-918.
Zhu Z Q,Sang J L,Wang Y X,etal.High protein somaclones selected from somaclonal varients inTriticumaestivumL.[J].JournalofIntegrativePlantBiology,1992,34(12):912-918.
[17]张怀刚,陈集贤,赵绪兰,等.小麦体细胞无性系HMW-GS变异及其变异体的研究 [J].科学通报,1995,40(21):1990-1993.
Zhang H G,Chen J X,Zhao X L,etal.Study on variation of HMW-GS in wheat somalonal variants [J].ChineseScienceBulletin,1995,40(21):1990-1993.
[18]王 培,朱至清.冬小麦体细胞无性系种子蛋白质含量的遗传[J].华北农学报,1995,10(3):6-9.
Wang P,Zhu Z Q.Heredity of grainprotein content of somaclones in winter wheat [J].ActaAgriculturaeBoreali-Sinica,1995,10(3):6-9.
[19]叶春雷,王红梅,李玉芳,等.甘肃春小麦农家品种与育成品种HMW-GS变异及品质效应比较[J].西北农业学报,2012,21(2):31-37.
Ye C L,Wang H M,Li Y F,etal.Allelic variations of HMW-GS and their effects on quality of Gansu spring wheat land races and improved varieties [J].ActaAgriculturaeBoreali-OccidentalisSinica,2012,21(2):31-37.
[20]Payne P I,Nightingale M A,Krattiger A F,etal.The relationship between HMW glutenin subunit composition and the bread-making quality of British-grown wheat varieties [J].JournaloftheScienceofFoodandAgriculture,1987,40(1):51-65.
[21]杨随庄,王红梅,杨晓明,等.小麦体细胞无性系SSR位点的遗传变异特性分析[J].植物生理学通讯,2007,43(4):678-682.
Yang S Z,Wang H M,Yang X M,etal.Analysis of genetic variation character on SSR loci of somaclones in wheat (TriricumaestivumL.) [J].PlantPhysiologyCommmunications,2007,43(4):678-682.
[22]张艳菲,王晨阳,马冬云,等.花后渍水、高温及其复合胁迫对小麦籽粒蛋白质含量和面粉白度的影响[J].作物学报,2014,40(6):1102-1108.
Zhang Y F,Wang C Y,Ma D Y,etal.Effects of waterlogging,high temperature and their interaction after anthesis on grain protein components and flour color in wheat [J].ActaAgronomicaSinica,2014,40(6):1102-1108.
[23]朱守晶,王 敏,张从宇.60Co-γ辐射诱变小麦M3代品质性状的遗传变异分析[J].激光生物学报,2010,19(6):764-771.
Zhu S J,Wang M,Zhang C Y.Genetic variation analysis of quality characters of M3radiated by60Co-γ in wheat [J].ActaLaserBiologySinica,2010,19(6):764-771.
[24]杨文雄.甘肃小麦生产技术指导[M].北京:中国农业科学技术出版社,2009:116-135.
Yang W X.Guidance of Wheat Production Technology in Gansu [M].Beijing:China Agricultural Science and Techonoly Press,2009:116-135.
[25]宋亚珍.小麦高分子量麦谷蛋白亚基品质遗传分析[D].杨凌:西北农林科技大学,2006:3-4.
Song Y Z.Research on Quality Inheritance of HMW-GS in Common Wheat [D].Yangling:Northwest A & F University,2006:3-4.
[26]姚 玮,庞斌双,张立平,等.二系杂交小麦HMW-GS组合与品质关系的研究[J].中国粮油学报,2012,27(4):9-14.
Yao W,Pang B S,Zhang L P,etal.The studies on relationship between the combination of high molecular weight glutenin subunits and their effects on quality in two-line system hybrid wheat [J].JournalofChineseCerealsandOilsAssociation,2012,27(4):9-14.
[27]张怀刚,陈集贤,胡 含.小麦体细胞无性系Glu-1基因突变体的遗传分析[J].遗传,1997,19(1):23.
Zhang H G,Chen J X,Hu H.Genetic analysis of a Glu-1 somaclonal mutant in wheat [J].Hereditas,1997,19(1):23.
[28]胡尚连,李文雄,曾寒冰.小麦未熟胚离体培养的研究-再生植株后代籽粒醇溶蛋白和谷蛋白亚基及蛋白质含量变化[J].作物学报,1998,24(2):204-212.
Hu S L,Li W X,Zeng H B.The studies of immature embryo culture in vitro in wheat-the variation of gliadin and glutenin subunits and protein content in seed of progenies from regenerated plants [J].ActaAgronomicaSinica,1998,24(2):204-212.
[29]王立新,顏 暘,石海波,等.小麦体细胞无性系的DNA突变[J].分子植物育种,2005,3(6):105-111.
Wang L X,Yan Y,Shi H B,etal.DNA mutations in a wheat somaclonal line [J].MolecularPlantBreeding,2005,3(6):105-111.
[30]李晓玲,丛 娟,于晓明,等.植物体细胞无性系变异研究进展[J].植物学通报,2008,25(1):121-128.
Li X L,Cong J,Yu X M,etal.Progress in plant somaclonal variation [J].ChineseBulletinofBotany,2008,25(1):121-128.
[31]Mujib A,Banerjee S,Ghosh P D.Tissue culture induced variability in some horticultural important ornamentals:chromosomal and molecular basis—a review [J].Biotechnology,2013,12(6):213-224.
Analysis of HMW-GS Composition,Protein Content, Lysine Content and SSR Allelic Variations in Wheat Somaclonal Lines
WANG Wei1,YANG Suizhuang2,YE Chunlei1,CHEN Chen1,OU Qiaoming1,WANG Hongmei1,LUO Junjie1
(1.Bio-technology Institute,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China;2.College of Life Science and Engineering,Southwest University of Science and Technology,Mianyang,Sichuan 621010,China)
Abstract:In order to clarify the variations in HMW-GS subunit composition,SSR loci,and protein and lysine content in the wheat lines derived from somaclonal variation,the HMW-GS subunit composition,protein content,lysine content and SSR loci in R4 and R5 somaclonal progenies of three genotypes Ningchun 4,Longchun 21 and Huapei 9355 were determined and detected. The results indicated there were variations at all the three loci encoding HMW-GS; the variation frequency and locus in somaclonal lines of different genotypes was not identical; the variation frequency of different loci in somaclonal lines with the same genotype was also different; ultra-parent variations of protein and lysine content were found in somaclonal lines and the traits in most of the R4 generation lines could be passed on to the R5 generation; the variation of SSR locus in somaclonal lines was genotype-dependent; and there was no direct correlation between the variation frequency of protein content,lysine content and that of SSR locus in somaclonal lines. The results will further provide scientific basis for creating germplasm resource and quality breeding in wheat by taking advantage of somaclonal variation.
Key words:Wheat; Somaclonal line; Variation; Quality breeding
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)02-0157-08
通讯作者:杨随庄(E-mail: yangs_z@163.com); 罗俊杰(E-mail:hnsljjie@163.com)
基金项目:甘肃省自然科学基金项目(096RJZA027);甘肃省农科院农业科技创新基金项目(2013GAAS27);甘肃省农业生物技术研究与应用开发项目(GNSW-2014-15);甘肃省农科院科技创新工程学科团队项目(2014GAAS06)
收稿日期:2015-08-26修回日期:2015-09-27
网络出版时间:2016-01-26
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160126.1944.010.html
第一作者E-mail:haploidbreeding@163.com
