小麦K-CMS恢复系1BL/ 1RS和非1BL/ 1RS核型的鉴定及育性恢复基因的效应分析
2016-05-27闫鹏娇石晓艺蒙立颖叶佳丽刘子涵宋喜悦
闫鹏娇,齐 智,石晓艺,蒙立颖,段 阳,姚 盟,叶佳丽,刘子涵,宋喜悦
(西北农林科技大学农学院,陕西杨凌 712100)
小麦K-CMS恢复系1BL/ 1RS和非1BL/ 1RS核型的鉴定及育性恢复基因的效应分析
闫鹏娇,齐 智,石晓艺,蒙立颖,段 阳,姚 盟,叶佳丽,刘子涵,宋喜悦
(西北农林科技大学农学院,陕西杨凌 712100)
摘要:为给K型小麦细胞质雄性不育系(K-CMS,本文简称K型不育系)的易恢性及恢复系的恢复度研究提供参考,以三个K型不育系及69份恢复系为材料,综合采用特异性分子标记及醇溶蛋白的A-PAGE检测方法对恢复系进行1BL/1RS核型鉴定,并初步推断恢复系恢复基因的遗传组成及其效应。结果表明,69份恢复系材料中,有65份属于非1BL/1RS类型(占94.2%),4份属于1BL/1RS类型(占5.8%);三个K型不育系的易恢性强弱依次为KTM3315A、KTP3315A、K3315A,且三个不育系间无显著差异。各恢复系间的恢复力表现出较大差异,其中恢复系KR8-1-2的恢复能力较强且稳定。初步推测K型不育系的育性恢复主效基因多位于1BS染色体上,恢复基因 Rfv1效应约为60%,恢复基因 Rfv2的效应约为10%。
关键词:细胞质雄性不育;粘果山羊草;育性恢复;恢复基因
K型小麦细胞质雄性不育系(K type Cytoplasmic male sterility,K-CMS,以下简称“K型不育系”)是以粘果山羊草(Ae.kotschyi)为细胞质源,以斯卑尔脱小麦(T.speltaL.)、莫迦(T.machaL.)小麦和普通小麦1BL/1RS易位系莎尔蒙(T.salmonL.)为细胞核供体,通过核质置换选育成的一类小麦雄性不育系,被认为是一种杂交小麦研究的理想细胞质不育类型。K型不育系具有易保持、易恢复、恢复源广且种子饱满,发芽率高等特点[1],但是,随着研究的深入人们逐渐发现K型不育系还存在诸多缺点,例如,多数1BL/1RS类型的K型不育系随着小麦条锈病生理小种的变迁会逐渐丧失抗条锈性,有的还会产生一定频率的单倍体,以及品质欠佳、遇雨穗发芽等[2]。为此,何蓓如等[3]利用染色体转移方法,将T.spelta小麦的1BS染色体片段导入K型不育系,选育出非1BL/1RS类型的K型不育系。前人对1BL/1RS和非1BL/1RS类型的K型不育系已有很多的研究,但对1BL/1RS和非1BL/1RS类型恢复系的遗传效应研究甚少。
制约小麦K型不育系生产应用的关键问题之一是难以选育出恢复度较高的恢复系。因此本研究同时也对小麦K型不育系的易恢性及恢复系的恢复度进行比较研究,以期为优良不育系和恢复系的选育以及不育系育性恢复遗传机理的研究提供参考。
1材料与方法
1.1材 料
本研究所用材料包括:三个具有粘果山羊草细胞质(Ae.kotschyi)的K型小麦雄性不育系K3315A、KTP3315A、KTM3315A,其中K3315A为1BL/1RS类型,KTP3315A和KTM3315A分别为含有斯卑尔脱(T.speltaL.)与莫迦(T.machaL.)小麦1BS染色体片段的非1BL/1RS类型;恢复系为FN3665、XY6、TB902等69份材料,以中国春和黑麦作为对照。以上材料均来自西北农林科技大学K型杂交小麦课题组。
1.2方 法
1.2.1田间调查和恢复度统计
田间试验于2013-2014年度在西北农林科技大学试验农场进行。2013年4月,69个恢复系分别与上述三种同质异核的K型不育系组配杂交。2013年10月,各组合F1分别单粒点播,行长1 m,行距25 cm,株距6.7 cm,4行区,栽培管理措施按常规进行。次年灌浆中后期每行随机抽取5株,调查单株有效穗数、有效小穗数、穗粒数,籽粒成熟后收套袋穗。恢复度采用国内法计算:恢复度=[有效小穗基部两朵小花结实数/(有效小穗数×2)]×100%数据采用Excel、SPSS处理分析。
1.2.2小麦基因组总DNA的提取
基因组总DNA提取参照Cota-Sánchez[4]。提取完毕后用1%琼脂糖凝胶电泳检测DNA纯度,并用微量紫外分光光度计测定其浓度,最终稀释至统一浓度(50~100 ng·μL-1)。
1.2.31BL/1RS易位系的特异性PCR检测
根据文献[5-10]合成2对特异性引物AF1/AF4(F:5′-GGAGACATCATGAAACATTG-3′,R:5′-CTGTTGTTGGGCAGAAAG-3′)、Glu-B3 (F:5′-GGTACCAACAACAACAACCC-3′,R:5′-GTT GCTGCTGAGGTTGGTTC-3′)作为1BL/1RS的筛选标记,其中,Glu-B3位于小麦1BS上,AF1/AF4位于黑麦1RS上,以上引物均由上海生工生物工程技术公司合成。
PCR反应体系(15 μL):0.2 μLTaqDNA聚合酶(5 U·μL-1)、 1.6 μL 10×Buffer(含Mg2+) 、1.2 μL dNTPs(2.5 μmol·mL-1)、2 μL引物(20 μmol·mL-1)和2 μL模板DNA。扩增程序为94 ℃预变性 5 min,接着32个循环。每循环为94 ℃变性40 s,60 ℃退火50 s,72 ℃延伸50 s,72 ℃终延伸10 min。PCR扩增产物中加入3 μL 1×loading buffer,0.8%~2%琼脂糖凝胶中加入适量核酸染料(10 μL/100 mL),在1×TAE缓冲液中电泳检测,胶片在GPS-8000凝胶成像仪扫描照相后,统计结果。
1.2.41BL/1RS易位系醇溶蛋白的A-PAGE检测
溶液的配制:丙烯酰胺10%,亚甲基丙烯酰胺0.4%,尿素6%,抗坏血酸0.1%,硫酸亚铁0.005%。
(1)醇溶蛋白的提取及电泳
取单粒种子磨粉后装入1.5 mL离心管中,加入500 μL蛋白提取液,充分混匀后室温浸提过夜,使用前8 000 r·min-1离心15 min,取上清液点样。凝胶制备:量取凝胶液20 mL倒入烧杯,立即加入15 μL 10%过硫酸铵(APS),5 μL TEMED,迅速摇匀,倒入凝胶玻璃板之间,插好样品梳。加样:拔出样品梳,加入适量的电极缓冲液,每个点样孔中依次加入5~10 μL醇溶蛋白样品,保证各孔中加样量一致。电泳:先将电压调节为350 V,电泳20 min,再将电压调至500 V,电泳时间为甲基绿迁移时间的2~2.5倍,通常约2.5 h。固定和染色:固定与染色同时进行,每板胶需100 mL 10%三氯乙酸溶液,再加入3.5 mL 1.0%考马斯亮蓝溶液,充分混匀后,放入胶片,染色1~2 d。脱色:将胶片从染色液中取出,用自来水仔细反复冲洗,直至电泳条带清晰可见,照相,记录结果。
(2)醇溶蛋白的A-PAGE检测
醇溶蛋白A-PAGE检测方法参照国际种子检验协会(ISTA)1986年颁布的小麦醇溶蛋白检验的标准方法[11],电泳结果观察参见刘丽[12]和王瑞[13]方法。
1.2.5SSR分析
SSR引物选用Song等[14]利用KTP116A//TP116B/WM5-5回交群体定位于1BS上的 Xgwm11、Xgwm18、Xbarc137、Xgwm413,2AL上的Xwmc644、Xwmc198、 Xgwm294、Xwmc474等8对引物。PCR反应体系及程序参照1.2.3。扩增产物中加入3 μL 1×loading buffer,用6%聚丙烯酰胺凝胶电泳技术检测PCR产物。统计标记带型,根据SSR标记和杂交组合F1的恢复度综合分析恢复系的恢复基因组成和效应(以恢复系WM5-5组合F1的自交结实率为对照)。
2结果与分析
2.1K型不育小麦恢复系1BL/1RS核型的特异性检测结果
以中国春和黑麦作为对照,对FN3665、XY6、TB902等69个恢复系材料进行特异PCR检测,结果发现,所有材料均可以扩增出各引物对应的特征条带。如图1所示,选用黑麦1RS染色体上的特异引物AF1/AF4(F:5′-GGAGACATCATGAAACATTG-3′,R:5′-CTGTTGTTGGGCAGAAAG-3′)进行扩增,黑麦、JK29、2007A6-6-1、SY3-1、906E2均可以扩增出1.5 kb的特异条带,而中国春、N9209、LM1、K659-2-1、R22均未扩增出该特异条带;利用小麦1BS染色体上的特异引物Glu-B3 (F:5′-GGTACCAACAACAACAACCC-3′,R:5′-GTTGCTGCTGAGGTTGGTTC-3′)进行扩增,中国春、N9209、LM1、K659-2-1、R22均能扩增出630bp的特异条带。因此可以推断,若材料为1BL/1RS易位纯合体,则能在位于黑麦1RS的标记中扩增出条带;若为非1BL/1RS易位的小麦材料,则能在位于小麦1BS的标记中扩增出条带;若为1BL/1RS易位杂合体,则能在1RS、1BS的标记中同时扩增出条带。
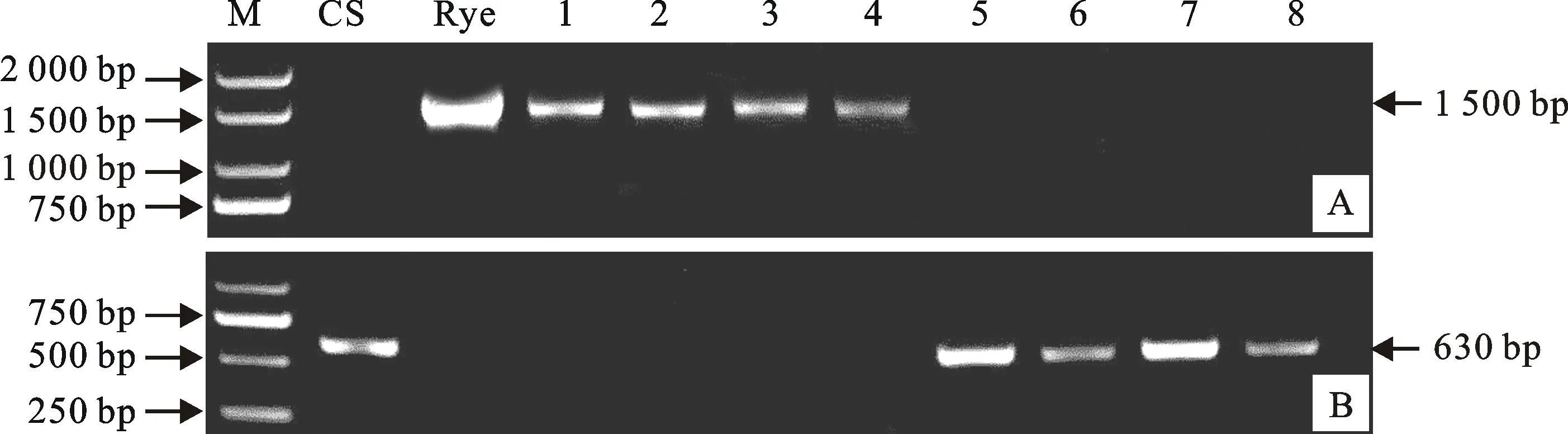
M:DL2000; CS:中国春 Chinese Spring; Rye:黑麦;1:JK29; 2:2007A6-6-1; 3:SY3-1; 4:906E2; 5:N9209; 6:LM1; 7:K659-2-1; 8:R22;A:AF1/AF4; B:Glu-B3
图1部分参试材料1BL/1RS的PCR分子检测结果
Fig.1Identification of 1BL/ 1RS translocation with the PCR marker in partial tested materials
2.2K型不育小麦恢复系1BL/1RS类型的醇溶蛋白检测结果

1:中国春 CS;2:黑麦 Rye;3:SY3-1;4:N9209;5:LM1;6:906E2;7:JK29;8:2007A6-6-1;9:K659-2-1;10:R22;11:黑麦 Rye;12:中国春 CS
图2部分恢复系材料的醇溶蛋白A-PAGE图谱
Fig.2Gliadin electrophoregram of part restorer lines
用A-PAGE方法对69个恢复系材料以及中国春(CS)和黑麦(Rye)醇溶蛋白进行电泳分析后发现,不同恢复系材料间醇溶蛋白的组分存在较大的差异。如图2所示,与普通小麦相比,黑麦在高分子量区(ω区)含有较多的谱带,而普通小麦的谱带较少。张 红等[15]研究表明,黑麦在醇溶蛋白ω区有特异带型,而普通小麦中国春则没有。由于黑麦ω区醇溶蛋白的多态性,因此利用此区的谱带就可将黑麦与普通小麦区分开。如图2所示,在ω区,黑麦的醇溶蛋白谱带与小麦具有明显的差异且清晰可见。因此,与黑麦ω区谱带相同的材料为1BL/1RS类型恢复系,与中国春ω区谱带相同的为非1BL/1RS类型恢复系。经检测,恢复系SY3-1、906E2、JK29、2007A6-6-1在ω区具有与黑麦相同的谱带,而N9209、LM1等恢复系在ω区无此特征带(表1),说明前述4个恢复系材料属于1BL/1RS类型(占所有恢复系总数的5.8%),其余恢复系为非1BL/1RS类型(占所有材料的94.2%)。对两种方法的鉴定结果进行比较,发现所有恢复系的核型鉴定结果均一致,说明用这两种方法鉴定的恢复系1BL/1RS与非1BL/1RS类型都是准确的。
2.3K型不育小麦恢复系的恢复能力及不育系的易恢性
从表1可以看出,每个恢复系与三个不育系杂交组合的恢复度都表现出较大的差异。K3315A与各恢复系杂交组合F1的平均结实率为60.92%,而KTP3315A和KTM3315A与各恢复系杂交组合F1的平均结实率分别为64.18%和64.54%,比K3315A分别提高了3.26和3.62个百分点。三类组合平均值的标准差都相对较大(18.98%、20.64%和17.89%),说明各组合结实率的平均值变异幅度较大,但不同不育系的平均恢复度无显著性差异(P1=0.319>0.05,P2=0.269>0.05,P3=0.912>0.05)。KTP3315A组合F1的平均结实率和KTM3315A组合F1的平均结实率相差很小,但KTP3315A与各恢复系材料组合F1结实率变异幅度较大,标准差高达20.64%;而KTM3315A与各恢复系材料组合F1的结实率变异幅度相对较小,标准差为17.89%。不同恢复系间杂交组合F1结实率的平均值及其标准差也表现出差异,恢复度较高的恢复系为KR8-1-2,其与K3315A、KTP3315A、KTM3315A组合F1的结实率分别为82.42%、79.80%和80.17%,三者平均值为80.80%,标准差仅为1.42%,说明该恢复系对K型不育系的恢复能力较强且稳定,是K型不育系的理想恢复系材料。
2.4K型不育小麦恢复系恢复基因 Rfv1和 Rfv2的效应
在Song等[14]研究小麦1BS、2AL染色体上与育性恢复基因连锁的8对分子标记中,本实验选用位于1BS染色体上与育性恢复基因 Rfv1连锁的标记 Xbarc137和位于2AL染色体上与育性恢复基因 Rfv2连锁的标记Xwmc644作为恢复基因效应分析的检测标记(图3)。
经扩增检测,除SY3-1、906E2、JK29、2007A6-6-1之外,其余恢复系均能在位于1BS染色体上与育性恢复基因 Rfv1紧密连锁的分子标记 Xbarc137[14]中扩增出多态性片段,不同恢复系扩增的片段大小有一定的多态性(图3),说明这些恢复系在1BS染色体上均含有不同的育性恢复基因;而所有恢复系均能在位于2AL染色体上与育性恢复基因 Rfv2紧密连锁分子标记Xwmc644中扩增出多态性条带,说明各恢复系材料中均携带有育性恢复基因 Rfv2。由此推断,恢复系材料SY3-1、906E2、JK29、2007A6-6-1中仅含有育性恢复基因 Rfv2。906E2与K3315A、KTP3315A、KTM3315A杂交组合F1结实率分别为7.16%、8.31%、15.75%,平均值为10.41%,说明位于2AL染色体上的育性恢复基因 Rfv2的育性恢复效应约为10%;SY3-1与K3315A、KTP3315A、KTM3315A组合F1结实率分别为77.24%、41.53%、71.45%,平均值为63.41%,说明除1BS染色体上含有K型不育小麦主效恢复基因外,其他染色体可能还含有K型不育的恢复基因,且恢复能力很强。另从图3结果可知,恢复系6-96B1和K659-2既含有恢复基因 Rfv1,又含有恢复基因 Rfv2,但其与三个不育系K3315A、KTP3315A、KTM3315A杂交F1结实率却相对较低。6-96B1与K3315A杂交F1结实率平均值为50.51%,但与KTP3315A、KTM3315A杂交结实率平均值均小于10%,分别为6.23%、3.80%,三种组合平均结实率为20.18%;K659-2与三个不育系杂交的结实率平均值为29.67%,与KTP3315A杂交F1结实率平均值相对较高,为44.96%,其余两个组合分别为14.54%和29.51%,说明这些恢复系可能含有影响恢复基因行使功能的基因。由表1中还可看出,大部分恢复系与三个不育系杂交组合F1结实率的平均值分布在60%~80%之间,因为WM5-5组合F1(对照)的恢复度为77.19%,而WM5-5细胞核内仅含有恢复基因 Rfv1和 Rfv2[14],说明恢复基因 Rfv1的效应约为60%。
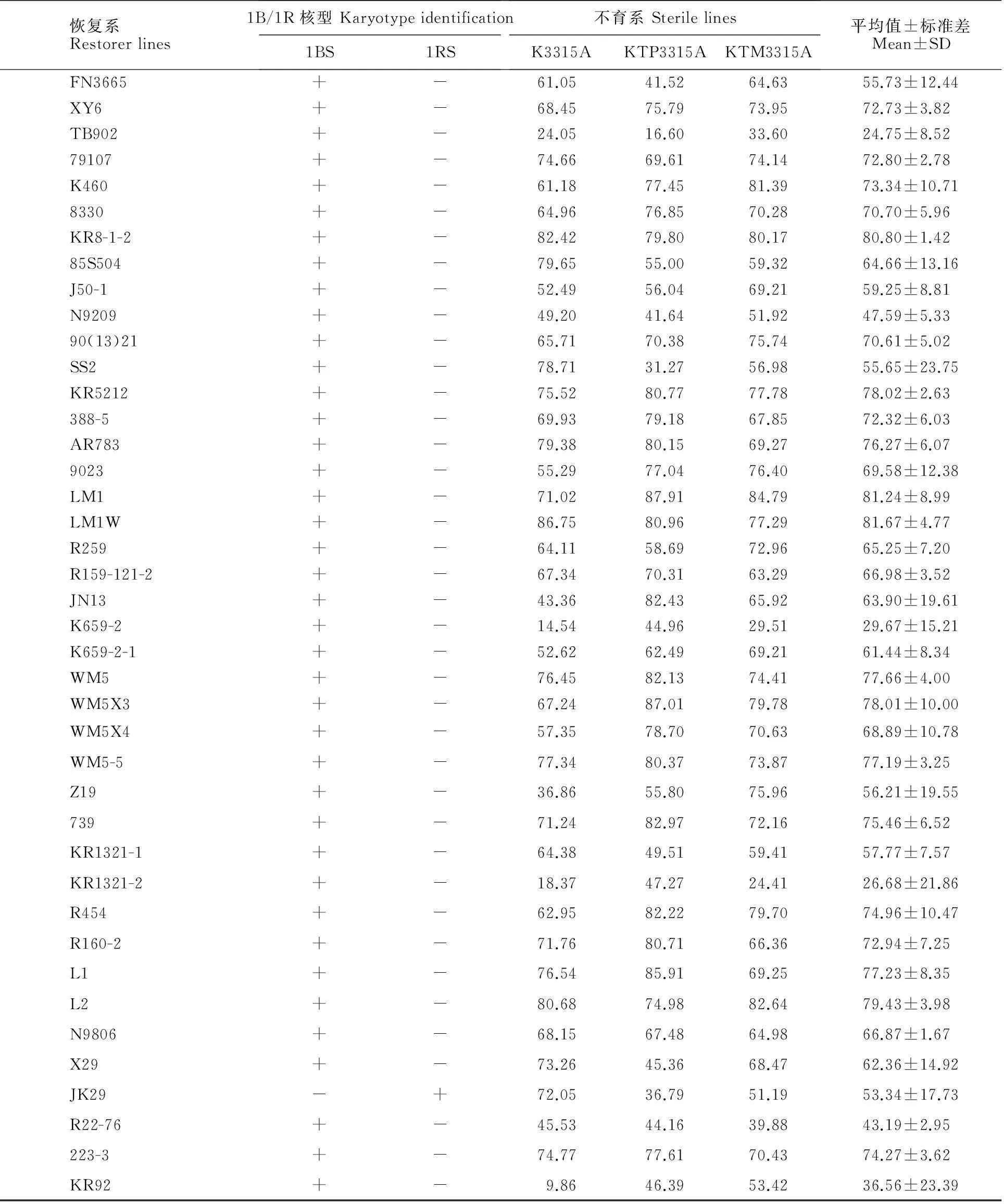
表1 69个恢复系与3个K型不育系杂交F1的自交结实率(%)
(续表1Continued table 1)
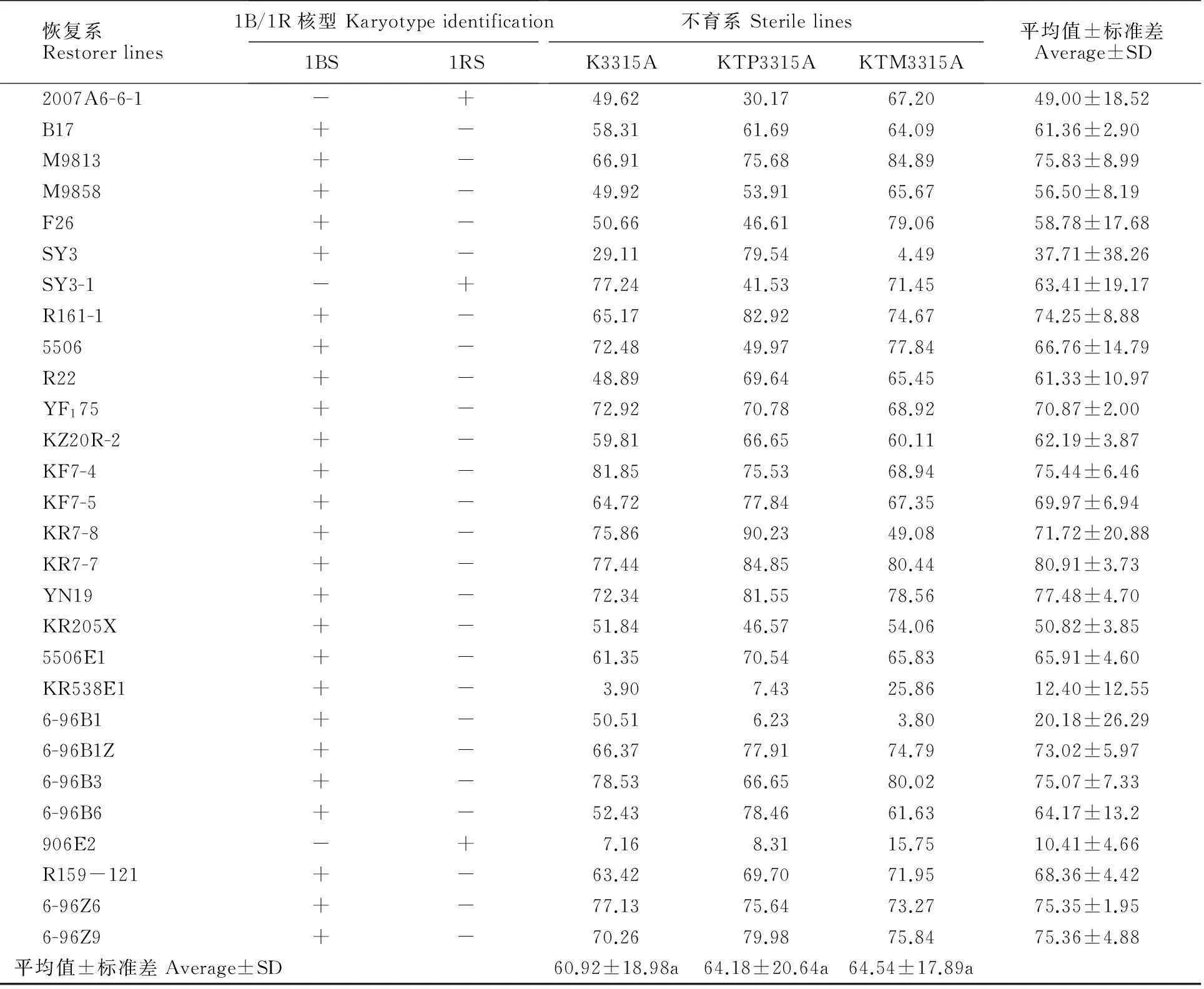
恢复系Restorerlines1B/1R核型Karyotypeidentification1BS1RS不育系SterilelinesK3315AKTP3315AKTM3315A平均值±标准差Average±SD2007A6-6-1-+49.6230.1767.2049.00±18.52B17+-58.3161.6964.0961.36±2.90M9813+-66.9175.6884.8975.83±8.99M9858+-49.9253.9165.6756.50±8.19F26+-50.6646.6179.0658.78±17.68SY3+-29.1179.544.4937.71±38.26SY3-1-+77.2441.5371.4563.41±19.17R161-1+-65.1782.9274.6774.25±8.885506+-72.4849.9777.8466.76±14.79R22+-48.8969.6465.4561.33±10.97YF175+-72.9270.7868.9270.87±2.00KZ20R-2+-59.8166.6560.1162.19±3.87KF7-4+-81.8575.5368.9475.44±6.46KF7-5+-64.7277.8467.3569.97±6.94KR7-8+-75.8690.2349.0871.72±20.88KR7-7+-77.4484.8580.4480.91±3.73YN19+-72.3481.5578.5677.48±4.70KR205X+-51.8446.5754.0650.82±3.855506E1+-61.3570.5465.8365.91±4.60KR538E1+-3.907.4325.8612.40±12.556-96B1+-50.516.233.8020.18±26.296-96B1Z+-66.3777.9174.7973.02±5.976-96B3+-78.5366.6580.0275.07±7.336-96B6+-52.4378.4661.6364.17±13.2906E2-+7.168.3115.7510.41±4.66R159-121+-63.4269.7071.9568.36±4.426-96Z6+-77.1375.6473.2775.35±1.956-96Z9+-70.2679.9875.8475.36±4.88平均值±标准差Average±SD60.92±18.98a64.18±20.64a64.54±17.89a
“+”代表有该染色体的特异带,“-”代表无该染色体的特异带;a表示0.05显著水平
“+” represents has the specific band of the chromosome,“-” represents has no the specific band of the chromosome; “a” indicates 0.05 significance level

1:Maker 2;2:WM5-5;3:FN3665;4:XY6;5:N9209;6:6-96B1;7:K659-2;8LM1;9:K659-2-1;10:R22;11:K460;12:8330;13:85S504;14:N9806;15:KR8-1-2; 16:J50-1;17:90(13)21;18:SS2;19:KR7-7;20:388-5;21:AR783;22:9023;23:LM1W;24:R259;25:JN13;26:KF7-5;27:L1;28:223-3;29:B17;30:R161-1;31:F26;32:M9813;33:6-96B1;34:6-96Z6;35:R159-121
图3SSR标记Xbarc137和Xwmc644对部分恢复系的扩增结果
Fig.3SSR analysis on some restorers with primer Xbarc137 and Xwmc644
3讨 论
3.1K型不育小麦恢复系非1BL/1RS核型的检测
1BL/1RS易位系的检测有许多方法,主要包括细胞学鉴定、分子标记[16]、籽粒贮藏蛋白的A-PAGE[17]和SDS-PAGE[18]、单克隆抗体[19]、GISH、FISH、高效液相色谱[20]等。本研究采用来源于黑麦1RS的特异性STS-PCR、SCAR、SSR标记以及小麦1BS上的特异性标记对69份恢复系材料进行鉴定,辅以中国春和黑麦作为正反对照,两类标记相互验证,结果表明,恢复系中有4份1BL/1RS易位系,65份非1BL/1RS易位系。在所有选用标记中,来源于黑麦1RS的SCAR标记AF1/AF4与来源于小麦1BS的特异性标记Glu-B3琼脂糖检测谱带单一且清晰明显,因此认为这两个标记可作为K型不育小麦恢复系1BL/1RS核型检测的可靠有效标记。利用醇溶蛋白检测方法能有效鉴定出小麦1BL/1RS易位系,也可作为K型不育小麦恢复系分子鉴定的重要辅助手段。
3.2K型小麦不育系的易恢性及恢复系的恢复度差异
大量研究证实,杂交小麦的育性恢复受两方面遗传因素的影响,其一是不育系的易恢性差异,其二是恢复系的恢复能力差异[21]。杨天章等[22]研究认为,K型不育系育性恢复除与主效恢复基因相关外,还受到不育系微效基因、修饰基因、核质互作、育性基因间互作、遗传背景、外界环境等多因素的影响。张改生等[23]研究认为,不育系的核内含有两种不育基因类型,一是单对主效不育基因(或者是1RS的片段),二是单对主效不育基因+部分抑制基因,育性抑制基因会降低杂交组合F1的育性。不育系的易恢性和同一不育系与不同恢复系杂交组合F1育性会表现出很大的变异幅度,本试验的结果中也体现出这一点。本研究结果表明,非1BL/1RS类型不育系KTP3315A和KTM3315A的易恢性优于1BL/1RS类型不育系K3315A,说明由于斯卑尔脱(T.speltaL)与莫迦(T.machaL)1BS染色体的导入,有可能使K型不育系的易恢性得到提升。
3.3K型小麦不育系育性恢复基因的组成及其效应
众多研究表明,小麦K型不育系的育性恢复是由位于1BS染色体上 Rfv1单基因控制,而且还与部分修饰基因以及不育系的遗传背景有关[24-25]。刘曙东等[26]选用F1代及回交分离群体进行遗传分析发现,K型不育系育性恢复由两对基因控制,分别为恢复作用较强的基因 Rfk1和恢复作用较弱的 Rfk2,且两对基因的作用具有累加效应,当基因型为 Rfk1Rfk2时完全可育。孙兆全等[27]认为,K型不育系的恢复系恢复度高的携带有两对育性恢复基因,恢复度低的携带有一对恢复基因。刘保申等[25]研究认为,K型不育系具有一对主效育性恢复基因以及众多微效恢复基因。本研究结果表明,非1BL/1RS类型的恢复系携带有育性恢复基因 Rfv1,而1BL/1RS类型的恢复系中不含育性恢复基因 Rfv1;本研究的恢复系中均含有恢复基因 Rfv2,且 Rfv1恢复效应大于 Rfv2。不同1BL/1RS类型恢复系的恢复力存在明显的差异,而不同非1BL/1RS恢复系的恢复力也存在较大的差异。初步推断不同的恢复系材料含有的育性恢复基因数目及恢复基因的效应存在一定程度差异,这还需要进一步的深入研究。
参考文献:
[1]宋喜悦,方 鹏,马翎健,等.非1B/1R类型和1B/1R类型小麦K型雄性不育系比较研究[J].西北农林科技大学学报(自然科学版),2002,30(01):1-4.
Song X Y,Fang P,Ma L J,etal.A comparison of wheat CMS lines ofAe.Kotschyicytoplasm of no 1B/1R type and 1B/1R type[J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry(NaturalScienceEdition),2002,30(01):1-4.
[2]马翎健,陈亚鹏,宋喜悦,等T.spelta1BS染色体对K型小麦不育系及保持系的效应研究[J].西北农业学报,2006,15(05):25-28.
Ma L J,Cheng Y P,Song X Y,etal.Research on the effect ofT.spelta1BS chromosome to K wheat male-sterile lines and maintenance lines[J].ActaAgriculturaeBoreali-occidentalisSinica,2006,15(05):25-28.
[3]何蓓如,李宏斌,刘曙东.选育非1B/1R类型K型小麦雄性不育系的染色体转移方法[J].中国学术期刊文摘-科技快报,1997,3(4):499.
He B R,Li H B,Liu S D,etal.Breeding non 1B/1R K type sterile lines of chromosome transfer method[J].ChineseScienceAbstracts,1997,3(4):499.
[4]CotaSánchez J H,Remarchuk K,Ubayasena K.Ready-to-use DNA extracted with a CTAB method adapted for herbarium specimens and mucilaginous plant tissue[J].PlantMolecularBiologyReporter,2006,24(2):161-167.
[5]Mago R,Spielmeyer W,Lawrence G J,etal.Identification and mapping of molecular markers linked to rust resistance genes located on chromosome 1RS of rye using wheat-rye translocation lines[J].TheoreticalandAppliedGenetics,2002,104:1317-1324.
[6]刘志勇,孙其信,姜 岚,等.利用黑麦基因组特异PCR标记鉴定小麦K型雄性不育保持系[J].农业生物技术学报,1997,5(3):205-210.
Liu Z Y,Sun Q X,Jiang L,etal.Detection of 1B/1R maintainers for CMS wheat ofAegilopskotschyicytoplasm by rye genome specific DNA primers[J].JournalofAgricultureBiotechnology,1997,5(3):205-210.
[7]魏育明,郑有良,周永红,等.几种鉴定小麦背景中1BL/1RS易位染色体的分子标记方法比较研究[J].四川农业大学学报,2001,19(1):10-13.
Wei Y M,Zheng Y L,Zhou Y H,etal.Comparison of molecular methods for identifying the presence of 1BL/1RS translocation chromosomes in wheat[J].JournalofSichuanAgriculturalUniversit,2001,19(1):10-13.
[8]张立平,何中虎,陆美琴.用Glu-B3,Gli-B1和SEC-lb复合引物PCR检测普通小麦1BL/1RS易位系[J].中国农业科学,2003,36(12):1566-157.
Zhang L P,He Z H,Lu M Q.Identification of 1BL/1RS translocation via multiplex PCR markers of Glu-B3,Gli-B1 and SEC-1b in common wheat[J].ScientiaAgriculturaSinica,2003,36(12):1566-1570.
[9]Chail J F,Zhou R H,JiM J Z,et a1.Development and application of a new codominant PCR marker for detecting 1BL/1RS wheat-rye chromosome translocations[J].PlantBreeding,2006,125,302-304.
[10]Nagy E D,Lelley T.Genetic and physical mapping of sequence specific amplified polymorphic (SSAP) markers on the 1RS chromosome arm of rye in a wheat background[J].TheoreticalandAppliedGenetics,2003,107:1271-1277.
[11]Draper S R.ISTA variety committee report of the working group for biochemical tests for cultivar identification 1983-1986[J].SeedScienceandTechnology,1987,15:431-434.
[12]刘 丽,周 阳,何中虎,等.高、低分子量麦谷蛋白亚基等位变异对小麦加工品质性状的影响[J].中国农业科学,2004,01:8-14.
Liu L,Zhou Y,He Z H,etal.Effect of allelic variation in HMW and LMW glutenin subunits on the processing quality in common wheat[J].ScientiaAgriculturaSinica,2004,37(1):8-14.
[13]王 瑞,张改生,王 宏.小麦低分子量谷蛋白(Glu-3)亚基及高分子量醇溶蛋白(Gli-1)的分离图谱辨读方法[J].西北农业学报,2006,01:144-147.
Wang R,Zhang G S,Wang H,etal.Identifying allele variation of Glu-3 and Gli-1 loci by two-step SDS-PAGE and A-PAGE in wheat[J].ActaAgriculturaeBoreali-occidentalisSinica,2006,15(1):144-147,151.
[14]Song X Y,Qian H H,Zhang L L.Cytogenetic analysis of cytoplasmic male sterility in wheat line KTP116A and molecular mapping of two thermo-sensitive restoration genes[J].Euphytica,2014,196(1):129-136.
[15]张 红,苏荣存,李冬梅,等.新引进小黑麦的醇溶蛋白遗传多样性分析[J].德州学院学报,2006,22(3):104-107.
Zhang H,Su R C,Li D M,etal.Genetie diversity analysis of gliadin of tritieale materials newly introduced [J].JournalofDezhouUniversity,2006,22(3):104-107.
[16]Weng Y,Azhaguvel P,Devkota R N,etal.PCR-based markers for detection of different sources of 1AL·1RS and 1BL·1RS wheat-rye translocations in wheat background[J].PlantBreeding,2007,126(5):482-486.
[17]王秀娟,郭世华,郝云凤,等.中国部分冬、春小麦品种(系)1BL/1RS 易位系的A-PAGE 检测[J].麦类作物学报,2007.27(3):451-455.
Wang X J,Guo S H,Hao Y F,etal.Detection of 1BL/1RS translocation line in partial spring and winter wheat varieties (lines) in China by A-PAGE[J].JournalofTriticeaeCrops,2007,27(3):451-455.
[18]周 阳,何中虎,张改生,等.1BL/1RS易位系在我国小麦育种中的应用[J].作物学报,2004.30(6):531-535.
Zhou Y,He Z H,Zhang G S,etal.Utilization of 1BL/1RS translocation in wheat breeding in China[J].ActaAgronomicaSinica,2004,30 (6):531-535.
[19]Wang C.M,Zheng Q,Li L H,etal.Molecular cytogenetic characterization of a new T 2BL·1RS wheat rye chromosome translocation line resistant to stripe rust and powdery mildew[J].PlantDisease,2009,93(2):124-129.
[20]William A B,Michael G F.Biochemical,molecular,and cytogenetic technologies for characterizing 1RS in wheat:A review[J].Euphytica,1999,108 :1-19.
[21]范 濂,王福亭.提莫菲维核质体系杂交小麦杂种优势问题的初步探析[J].遗传学报,1978,5(1):31-40.
Fan L,Wang F T.A preliminary study on the hybid wheat heterosis of problem with thetriticumtimopheevinucleus and cytoplasm system [J].ActaGeneticaSinica,1978,5(1):31-40.
[22]杨天章,刘庆法,柴守诚.K型小麦雄性不育系应用问题研究II.恢复性和杂种优势问题[J].陕西农业科学,1990(3):2-4.
Yang T Z,Liu Q F,Chai S C,etal.Study on the application of K-type male sterile line in wheat:Ⅱ·fertility restoration and heterosis[J].ShaanxiJournalofAgriculturalScience,1990,(3):2-4.
[23]张改生,赵惠燕,陈新宏,等.几类异质1B/1R小麦雄性不育系育性稳定性与育性恢复性的研究[J].中国农业科学,1996,29(5):41-50.
Zhang G S,Zhao H Y,Chen X H,etal.Studies on fertility stability and restoration performance of some male sterile lines of alloplasmic 1B/1R wheat[J].ScientiaAgriculturaSinica,1996,29(5):41-50.
[24]张改生.粘、易型 1B/1R 小麦雄性不育系产生单倍体的遗传机理及育性恢复性能的研究[J].遗传学报,1992,19(3):266-277.
Zhang G S.Studies of genetic mechanism of haploid induced by male sterile lines of 1B/1R wheat withAe.kotschyi,Ae.variabiliscytoplasms and its performance of fertility restoration[J].ActaGeneticaSinica,1992,1(3):266-277.
[25]刘保申,孙其信,魏艳玲,等.K型小麦细胞质雄性不育系育性恢复基因的SSR分子标记分析[J].中国农业科学,2002(4):354-358.
Liu B S,Sun Q X,Wei Y L,etal.Mapping of fertility restoring gene for cytoplasmic male sterility in wheat using SSR markers[J].ScientiaAgriculturaSinica,2002(4):354-358.
[26]刘曙东,何蓓如.K型小麦雄性不育体系育性恢复的遗传分析[J].西北农业学报,1992,1(4):27-30.
Liu S D,He B R,Wang Z M,etal.Genetic anaysis of male fertility restorationin wheat withAe.kotschyicytoplasm[J].ActaAgriculturaeBoreali-OccidentalisSinica,1992,1(4):27-30.
[27]孙兆全,杨天章,刘宏伟.K型1B/1R易位小麦雄性不育系的育性恢复遗传[C]//杂种小麦研究进展.北京:中国农业出版社,1993:87-92.
Sun Z Q,Yang T Z,Liu H W.Genetic studies on restorer of fertility of K-type 1B/1R wheat male steille lines[C]//The Research of Hybrid Wheat Advance.Beijing:Aagricultural Press,1993:87-92.
Identification of 1BL/1RS and Non 1BL/1RS Type of the Restorer Lines and the Effect of Restoring Gene in K-type Cytoplasmic Male Sterility Lines of Wheat
YAN Pengjiao,QI Zhi,SHI Xiaoyi,MENG Liying,DUAN Yang,YAO Meng,YE Jiali,LIU Zihan,SONG Xiyue
(College of Agronomy,Northwest A&F University,Yangling,Shaanxi 712100,China)
Abstract:With 3 sterile lines and 69 restorer lines as test materials, the easy restoration of fertility among sterile lines and restoring degrees of different restorers for K male sterile lines were studied. The specific markers and the A-PAGE method for detecting the gliadins were used to distinguish 1BL/1RS type and non 1BL/1RS type of wheat. The composition of K-type restorer genes and its effects were indicated. Among 69 restorer lines, 65 species are non 1BL/1RS type, accounting for 94.2%; four restorer lines are 1BL/1RS type, accounting for 5.8%. The easy restoration of fertility in 3 sterile lines is ranked as KTM3315A, KTP3315A, and K3315A,and there is no significant difference on fertility restoration of the three lines. The restoring degree of different restorers also showed great differences. The restorer line KR8-1-2 has strong and stable recovery ability. It is preliminary inferred that the major fertility restoring genes are located on 1BS chromosome in wheat K male sterile line. The effect of restoration gene Rfv1 is approximately 60%, while the effect of restoration gene Rfv2 is about 10%.
Key words:CMS (Cytoplasmic male sterility); Aegilops kotschyi; Fertility restoration; Restorer gene
中图分类号:S512.1;S330
文献标识码:A
文章编号:1009-1041(2016)02-0136-09
通讯作者:宋喜悦(E-mail:songxiyue@126.com)
基金项目:国家自然科学基金项目(31271792); 陕西省农业攻关项目(2014K02-04-01); 西北农林科技大学唐仲英育种基金项目
收稿日期:2015-07-09修回日期:2015-09-08
网络出版时间:2016-01-26
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160126.1944.004.html
第一作者E-mail:1355808464@qq.com.
