miR-122在肾癌中的异常表达及其临床意义
2016-05-24赵春娟余振东
曹 拓,赵春娟,余振东
(1.北京大学深圳医院 a.检验科;b.生物治疗室,广东 深圳518036;2.汕头大学医学院;3.深圳市沙井人民医院)
miR-122在肾癌中的异常表达及其临床意义
曹拓1a,2,赵春娟3,余振东1b*
(1.北京大学深圳医院 a.检验科;b.生物治疗室,广东 深圳518036;2.汕头大学医学院;3.深圳市沙井人民医院)
摘要:目的探讨肾癌中miR-122的表达特点及临床意义。方法基于前期平行测序的工作基础,对51例肾癌及相应癌旁组织、15例肾癌患者血清及15例健康对照者血清中miR-122的表达水平进行RT-qPCR检测,分析miR-122的表达高低与肾癌患者临床病理特征之间的相关性;并通过在肾癌细胞系(786-O和ACHN)中转染miR-122 inhibitors,观察转染后细胞的增殖改变,初步探讨miR-122的生物学功能。结果相对于癌旁组织,肾癌组织中miR-122表达水平明显升高,上调率为82.35%;相比于健康对照者血清,肾癌患者血清中的miR-122表达亦明显升高,上调率为100%。肾癌组织中miR-122的表达水平与肾癌患者的临床病理特征无显著相关性(P>0.05)。在肾癌细胞系(786-O和ACHN)中转染miR-122 inhibitors后,肿瘤细胞的增殖受到抑制。结论miR-122可能参与到肾癌的病理过程,研究肾癌中miR-122的表达特点及生物学功能可能对早期诊断及治疗肾癌具有潜在的临床价值。
关键词:微小RNA;miR-122;肾细胞癌
(ChinJLabDiagn,2016,20:0559)
肾细胞癌(简称肾癌)是人群中最常见的十大恶性肿瘤之一[1]。在全球范围内,每年有超过270000例的新发肾癌病例被诊断出来,并导致每年发生110000死亡病例数[2]。尽管肾癌的致死率逐渐趋于平缓,但是肾癌的发生率仍在逐渐上升[2]。因此,本研究拟通过实时荧光定量PCR技术检测肾癌组织及肾癌病人血清中miR-122的表达情况,探讨其表达高低与患者临床病理特征之间的关联性;并通过在肾癌细胞系中转染miR-122 inhibitor的方法,来初步探究miR-122在肾癌中的生物学功能,为后续深入的功能及机制研究探索奠定基础。
1材料与方法
1.1材料
1.1.1组织和血清样本51例肾癌及配对的癌旁组织样本收集于北京大学深圳医院、安徽医科大学附属医院及中山大学附属肿瘤医院,组织标本剪碎后浸泡于RNAlater(Qiagen)中保存,再转移至-80℃冰箱冻存备用。15例肾癌患者血清样本及作对照用的15例健康者血清样本均从北京大学深圳医院检验科收集,血清样本分装于1.5 ml离心管后于-80℃冻存备用。所有肾癌组织样本取自于术前未经过任何形式的抗肿瘤治疗的患者,并且所获取组织样本全部经过经验丰富的病理医师确诊。肾癌标本的临床病理分期采用WHO肾癌分型标准和美国癌症联合会分期系统作为参考依据。实验样本(组织和血清)的获取及使用均获得患者知情同意,并通过了医院伦理委员会批准。
1.1.2主要试剂材料用于组织和血清中miRNAs提取、逆转录及荧光定量的试剂(miRNeasy Mini Kit、miRNeasy Serum/Plasma Kit、miScript Reverse Transcription Kit和miScript SYBR Green PCR Kit)均为Qiagen公司(德国)产品。miR-122荧光定量反应中上游特异性引物为5’-TGGAGTGTGACAATGGTGTTTG-3’,由Invitrogen 公司(美国)合成,其下游引物为试剂盒中提供的通用引物(详见miScript Reverse Transcription Kit说明书)。以U6为内参基因,作荧光定量检测的参比,特异性引物的上游及下游序列分别为5’-CTCGCTTCGGCAGCACA-3’和5’-AACGCTTCACGAATTTGCGT-3’,均由Invitrogen 公司(美国)合成。MTT试剂购自Sigma公司(美国)。转染试剂Lipofectamine 2000购自Invitrogen公司(美国)。DMEM培养基及胎牛血清(FBS)均为Gibco公司(美国)的产品。
1.1.3实验细胞系ACHN和786-O细胞购自ATCC(美国)。
1.2方法
1.2.1组织及血清miRNAs提取分别采用miRNeasy Mini Kit、miRNeasy Serum/Plasma Kit提取组织和血清中的miRNAs。按试剂盒说明书进行。
1.2.2miRNAs逆转录合成cDNA及实时荧光定量PCR检测参考miScript Reverse Transcription Kit 试剂盒说明书进行操作。参照miScript SYBR Green PCR Kit说明书进行荧光定量反应的体系设置。血清以及组织样本的荧光定量检测分为实验组与对照组。肾癌患者血清样本、肾癌组织样本中miRNAs表达量定义为实验组(c),健康志愿者血清样本及癌旁相应正常组织中miRNAs表达量定义为对照组(n)。miR-122作为检测目的基因,以U6的表达水平作为内参对荧光定量进行标准化处理。当定量PCR反应的荧光强度达到设定阈值时,所经过的循环反应数以CT值表示。ΔCTc=CTc目的-CTc内参,ΔCTn=CTn目的-CTn内参;公式中CTc目的代表肾癌或肾癌患者血清样本中miR-122的CT值,CTn目的代表癌旁正常组织或健康对照者血清样本中miR-122的CT值,CTc内参代表肾癌组织或肾癌患者血清样本中内参基因U6的CT值,CTn内参代表癌旁正常组织或健康对照者血清样本中内参基因U6的CT值。miR-122相对于对照组的表达水平(Re)采用ΔΔCT的方法进行分析处理:Re=2-ΔΔCT,ΔΔCT=ΔCTc-ΔCTn。依据miR-122的表达(log2Re)状况,将51例肾癌组织样本分为高表达组与低表达组;以log2Re等于2为界限, 大于或等于2的样本划为高表达组,小于2的样本划为低表达组。
1.2.3组织和血清样本RT-qPCR产物凝胶电泳将荧光定量PCR反应扩增产物与Loading buffer(6x)以5:1的比例均匀混合,在1%琼脂糖凝胶的中进行电泳,根据电泳条带的亮度来验证RT-qPCR数据的可靠性。
1.2.4肾癌细胞转染及转染后细胞增殖的检测转染分三组进行:(1)inhibitor组,即加入合成的miR-122 inhibitors和转染试剂脂质体;(2)inhibitor control组,即加入对照序列和脂质体;(3)mock组,仅加入脂质体。首先,将约6×103个细胞(ACHN和786-O细胞)接种于96孔板,24 h后将经opti-MEM稀释后的miR-122 inhibitors和对照序列(浓度均为50 nm/L)加入到细胞培养液中,空白组仅加入脂质体。在转染0 h,24 h,48 h,72 h后每孔加入20 μl MTT(5 mg/ml),继续于37℃温箱中孵育培养4 h。最后,小心移除培养孔中的液体,在每孔中加入150 μl DMSO,震荡混匀,直到无可见沉淀存在,以490 nm为检测波长、以630 nm为参考波长,在酶标仪上测定每孔的吸光值(OD值)。
1.2.5统计分析所有实验数据采用SPSS20.0统计软件进行分析。肾癌及相应癌旁组织、肾癌患者血清及配对健康对照者血清中的miR-122的表达水平的差异采用配对样本t检验方法进行分析;细胞转染实验中三个分组之间在同一时间点细胞数量(OD值)的差异采用方差分析来进行评估;肾癌组织中miR-122的相对表达水平与肾癌患者临床病理特征间的关系采用四格表卡方检验和R×C表Fisher的精确检验统计处理;差异有统计学意义的判定标准为P值小于0.05。
2结果
2.1miR-122在肾癌组织和肾癌患者血清中表达水平显著升高
如图1所示,miR-122在肾癌组织中呈现显著高表达(t=7.925,P<0.001),相对于癌旁的正常组织,在51例癌组织样本中,42例发生miR-122表达上调,上调率为82.35%。如图2所示,miR-122在肾癌患者血清中亦呈现显著高表达(t=4.32,P<0.001),在15例配对血清样本中,miR-122在全部肾癌患者血清中呈高表达,上调率为100%。

图1 miR-122在51例肾癌组织中的相对表达量
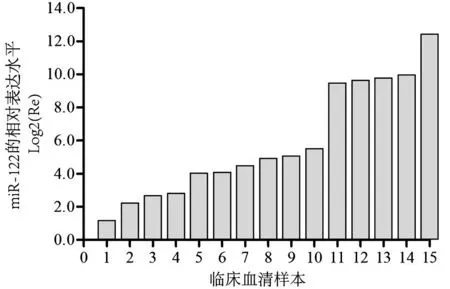
图2 miR-122在15例肾癌患者血清中的相对表达量
2.2组织和血清RT-qPCR产物凝胶电泳验证
组织和血清中miR-122荧光定量PCR产物凝胶电泳结果如图3所示,组织实验组(T)和血清实验组(S)条带C(cancerous)均要亮于条带N(normal),说明与配对的对照样本相比,miR-122在肾癌组织和肾癌患者血清中的表达均上调,与RT-qPCR实验数据分析结果相对应。
2.3转染miR-122 inhibitors可抑制肾癌细胞系的增殖
肾癌细胞系(ACHN和786-O)在转染miR-122 inhibitors后采用MTT法检测细胞系的增殖变化。如图4中A、B所示,miR-122 inhibitor组细胞生长曲线与inhibitor control组、mock组细胞生长曲线有明显差异;inhibitor control组与mock组之间无显著差异。采用ANOVA统计分析显示miR-122 inhibitors转染组的细胞增殖速度较其它两组细胞下降,说明降低miR-122的表达可能对肾癌细胞系ACHN、786-O的增殖有抑制作用。

M:marker;C:肾癌组织或肾癌患者血清;N:癌旁组织或健康对照者血清; T:组织样本;S:血清样本
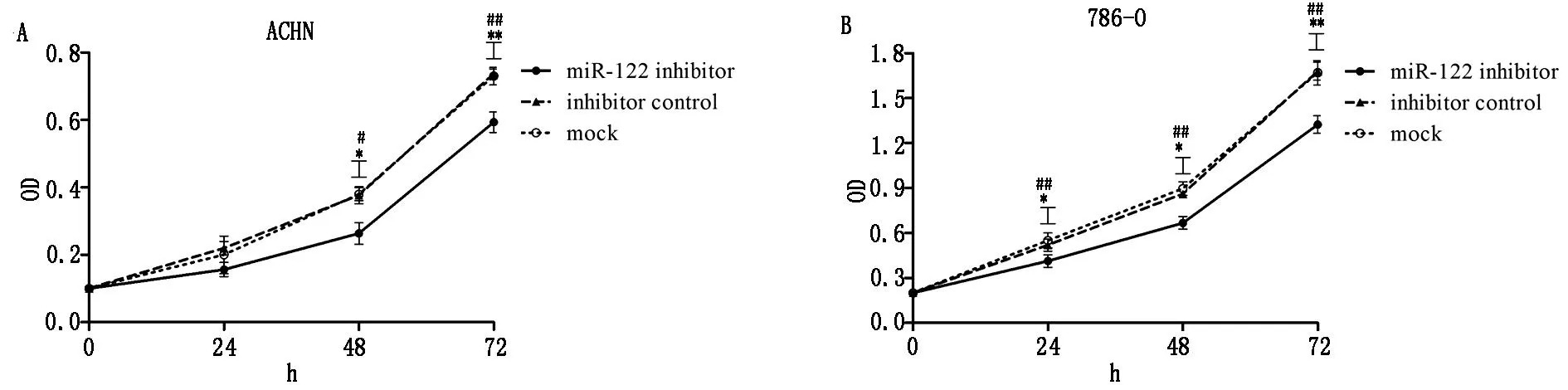
miR-122 inhibitors转染组与inhibitor control组、mock组之间在同一时间点的差异分别用*和#来表示,*或者#代表P<0.05,**或者##代表P<0.01
图4miR-122 inhibitors抑制肾癌细胞系786-O和ACHN的增殖
2.4肾癌组织中miR-122表达水平与肾癌患者临床病理特征之间的相关性
51例肾癌组织样本分为miR-122高表达组(36例)和低表达组(15例),分组的标准依据方法1.2.2所述进行。以55岁为界限,将患者分为两组。按性别统计患者中男性与女性的例数。采用卡方检验和R×C表Fisher的精确检验统计方法评估miR-122的表达水平与患者临床病理特征之间的相关性。如表1所示,采用四格表卡方检验分析发现,患者年龄、性别因素与miR-122的表达水平无相关性(P值均>0.05);采用R×C表Fisher确切概率计算发现,miR-122的表达水平与患者肿瘤的病理类型和TNM分期亦无显著相关性(P值均>0.05)。
表151例肾癌患者癌组织中miR-122的表达水平与临床病理特征的关系

临床病理特征病例数miR-122的表达水平高表达低表达检验统计量P值年龄/岁 ≦55241410 >55272253.2790.070性别 男28208 女231670.0210.884病理类型 透明细胞癌34268 乳头状癌1376 其他#4312.4070.248TNM分期 T1-2N0M0443113 T3-4N0M0431 不明*3210.3971.000
#病理类型不明确;*TNM分期不明确。
3讨论
MicroRNAs在正常细胞与和癌细胞中的表达有差异,它们能在一定程度上反映出组织特异性的表达特征,并且在不同的细胞及组织环境中促进或者抑制肿瘤的发生与发展,充当癌基因或抑癌基因[3,4]。研究特定类型的肿瘤中miRNAs的表达特征和功能作用为肿瘤的早期诊断、治疗和预后评估提供了方向和策略。MiR-122作为肝脏特异性的微小RNA,其在肝炎相关的损伤、非酒精性脂肪性肝病、药物诱导性肝脏疾病和肝脏肿瘤等疾病中的表达特征、生物学功能及分子机制都被深入研究[5-8]。miR-122的表达在肝脏肿瘤中发生显著下调,对于肝脏肿瘤的形成其主要发挥抑癌的作用[9]。而在我们前期肾癌组织测序的结果当中,miR-122是表达最显著上调的微小RNA之一,其在10例测序的肾癌组织中平均上调近25倍[10]。本研究通过对51例配对的肾癌及癌旁组织进行RT-qPCR检测,证实miR-122在肾癌组织中显著高表达,验证了前期我们的测序结果,提示miR-122在肾癌的发生发展中可能扮演促癌的角色。同时,我们对肾癌患者的血清也进行了表达水平的检测,发现miR-122在患者血清中也呈现高表达,与肾癌组织中miR-122表达水平的检测结果相印证。外周血中的miRNAs可以免受核糖核酸酶的降解作用而稳定存在是由于受其外周囊泡膜的保护,因此可以作为一种血清标志物而被检测[11]。MiR-122在15例肾癌患者的血清中都呈现高表达,提示其可能作为一种肾癌相关的血清标志物而具有早期诊断、预后评估的潜在临床价值。肾癌患者血清中miR-122高上调率(15/15)的出现可能与所检测的样本例数较少有关,更大样本量的血清有待于实验检测。
本研究通过在肾癌细胞系中转染miR-122的抑制物,观察肿瘤细胞的增殖改变,来初步探究miR-122在肾癌细胞中的生物学功能。在转染了miR-122的抑制物后,细胞增殖速率降低,结果具有统计学意义,提示miR-122充当癌基因而促进细胞增殖的可能性。靶向干扰miR-122的功能可能会减缓肾癌发展、起到缓解患者病情的作用。
在肝癌细胞系中过表达miR-122,能通过直接靶向降低AKT3的水平来抑制细胞增殖、迁移,并诱导肝癌细胞凋亡,发挥抑瘤作用[9];在乳腺癌中,miR-122通过特异性地降低IGF1R的表达水平,调节PI3K/Akt/mTOR/p70S6K信号通路来发挥肿瘤抑制作用[12]。与之相矛盾,本研究发现miR-122在肾癌的病理过程中可能发挥促癌作用。由于miRNAs通常以不完全互补的方式与其靶基因结合,从而发挥其调节功能,因此同一个miRNA可能会有多个靶基因,能通过不同的信号通路在不同的肿瘤类型中发挥不一致甚至截然相反的作用。本实验组探讨了miR-122在肾癌中的表达和生物学功能,但对于miR-122的作用机制需要进一步深入研究。
综上所述,本实验利用了实时荧光定量PCR技术证明了miR-122在肾癌组织中及肾癌患者血清中的高表达特点,且应用细胞转染技术初步探讨了miR-122在肾癌中起促癌作用的可能性,并分析阐明miR-122的相对表达水平与所选样本的临床病理特征无显著相关性。以上研究初步讨论了miR-122在肾癌病理过程中可能的重要作用和意义,为后续深入研究其在肾癌中的作用机制奠定基础,也为将miR-122作为肾脏肿瘤基因治疗的新靶点提供了参考和实验依据。
参考文献:
[1]Sudarshan S,Karam JA,Brugarolas J,et al.Metabolism of kidney cancer:from the lab to clinical practice[J].Eur Urol,2013,63(2):244.
[2]Qayyum T,Oades G,Horgan P,et al.The epidemiology and risk factors for renal cancer[J].Curr Urol,2013,6(4):169.
[3]Pichler M,Calin GA.MicroRNAs in cancer:from developmental genes in worms to their clinical application in patients[J].Br J Cancer,2015,113(4):569.
[4]Calin GA,Croce CM.MicroRNA signatures in human cancers[J].Nat Rev Cancer,2006,6(11):857.
[5]Yamada H,Ohashi K,Suzuki K,et al.Longitudinal study of circulating miR-122 in a rat model of non-alcoholic fatty liver disease[J].Clin Chim Acta,2015,446:267.
[6]Roderburg C,Benz F,Vargas Cardenas D,et al.Elevated miR-122 serum levels are an independent marker of liver injury in inflammatory diseases[J].Liver Int,2015,35(4):1172.
[7]Thakral S,Ghoshal K.miR-122 is a unique molecule with great potential in diagnosis,prognosis of liver disease,and therapy both as miRNA mimic and antimir[J].Curr Gene Ther,2015,15(2):142.
[8]Bandiera S,Pfeffer S,Baumert T F,et al.miR-122--a key factor and therapeutic target in liver disease[J].J Hepatol,2015,62(2):448.
[9]Nassirpour R,Mehta PP,Yin MJ.miR-122 regulates tumorigenesis in hepatocellular carcinoma by targeting AKT3[J].PLoS One,2013,8(11):e79655.
[10]Zhou L,Chen J,Li Z,et al.Integrated profiling of microRNAs and mRNAs:microRNAs located on Xq27.3 associate with clear cell renal cell carcinoma[J].PLoS One,2010,5(12):e15224.
[11]Turchinovich A,Weiz L,Langheinz A,et al.Characterization of extracellular circulating microRNA[J].Nucleic Acids Res,2011,39(16):7223.
[12]Wang B,Wang H,Yang Z.MiR-122 inhibits cell proliferation and tumorigenesis of breast cancer by targeting IGF1R[J].PLoS One,2012,7(10):e47053.
The abnormal expression of miR-122 in human renal cell carcinoma and its clinical significance
CAOTuo,ZHAOChun-juan,YUZhen-dong.
(DepartmentofClinicalLaboratory,PekingUniversityShenzhenHospital,Shenzhen518036,China)
Abstract:ObjectiveTo explore the expression levels of miR-122 in the tumor tissues and sera of patients with renal cell carcinoma and analyze its clinical significance.MethodsTotal RNAs from 51 pairs of human renal cell carcinoma and matched adjacent normal tissues were isolated and used for synthesis of the first-strand cDNA.Meanwhile,15 pairs of serum samples from cancer patients and matched healthy control subjects were subjected to RNA isolation and reverse transcription.The expression levels of miR-122 were analyzed by quantitative real-time PCR.Then,the relationship between the expression level of miR-122 in tumor tissue and clinicopathological characteristic was investigated.Furthermore,ACHN and 786-O cell lines were transfected with miR-122 inhibitors for characterization of the biological function of miR-122.ResultsCompared with the corresponding adjacent tissues and matched serum controls,the expression levels of miR-122 in tumor tissues and patients’ sera were significantly increased,with calculated ratio of upregulation at 82.35 percent and 100 percent,separately.However,there’s no correlation between the expression level of miR-122 and the age,gender,pathological classification and TNM stage of patients with renal cell carcinoma.MTT assay showed that tumor cells transfected with synthesized miR-122 inhibitors proliferated at a lower rate than that of control groups.ConclusionmiR-122 may be involved in the development and progression of renal cell carcinoma.This study of miR-122 expression may display potential application significance for the early diagnosis and treatment of renal cell carcinoma.
Key words:microRNAs;miR-122;renal cell carcinoma
(收稿日期:2015-01-29)
中图分类号:R737.11
文献标识码:A
*通讯作者
基金项目:深圳市科技计划项目(JCYJ20140415162543037);深圳市卫生计生系统科研项目(201401049)
文章编号:1007-4287(2016)04-0559-05
