线粒体动态学改变在DEHP致大鼠子代神经损伤中的作用
2016-05-24黄晓莉
初 阳,黄晓莉,崔 壮*
(1.天津医科大学,天津300070;2.山东大学齐鲁医院)
线粒体动态学改变在DEHP致大鼠子代神经损伤中的作用
初阳1,黄晓莉2,崔壮1*
(1.天津医科大学,天津300070;2.山东大学齐鲁医院)
摘要:目的探讨线粒体动态学改变是否在邻苯二甲酸二乙基己酯(DEHP)损伤子代大鼠神经细胞过程中发挥作用。方法用不同浓度的DEHP对妊娠期母鼠进行灌胃,待子鼠出生6周后,利用水迷宫定位航行和空间探索实验检测动物的神经行为学指标,利用酶联免疫吸附法(PCR)法和免疫蛋白(Western blot)法检测子鼠海马细胞线粒体融合基因Mfn1和分裂基因Drp1的mRNA和蛋白表达的变化。结果DEHP宫内暴露的子代大鼠寻找平台潜伏期明显延长(P<0.05)、游泳路线长度增加(P<0.05),平台所在象限游泳的时间/(长度)与总时间(长度)的比明显下降(P<0.05),融合基因Mfn1的mRNA和蛋白水平明显下降(P<0.05),而分裂基因Drp1的mRNA和蛋白表达水平明显上升。结论宫内暴露DEHP可致子代大鼠神经损伤,使神经行为发生改变,而线粒体动态失衡可能是DEHP改变大鼠神经行为的机制之一。
关键词:DEHP;神经;线粒体动态学;大鼠;水迷宫
(ChinJLabDiagn,2016,20:0525)
邻苯二甲酸二乙基己酯 (di-2-ethylhexyl phthalate,DEHP)属于邻苯二甲酯类化合物,是目前塑料工业中应用最广泛的增塑剂之一,可添加到塑料中以增强耐用性和使用寿命等。而随着广泛使用,大量邻苯二甲酯类化合物进入生态环境,因此在自然环境中分布的范围非常广,但其最终会通过食物链富集进入人体,而DEHP是人体中含量最高的邻苯二甲酯类化合物之一[1]。DEHP一旦被人体摄入便代谢为其单体形式MEHP(邻苯二甲酸-单-2-乙基己基酯),而MEHP更易被人体吸收进而影响人体健康。
已知DEHP及其代谢产物是机体内分泌干扰物,其宫内暴露可诱导子代神经系统的损伤,造成子代大鼠学习记忆能力的下降[2-4]。目前已知许多神经系统疾病与线粒体动态失衡相关[5],其可导致阿兹海默综合征及亨廷顿舞蹈症等[6,7],智力损伤也与线粒体动态失衡有关[8]。因此,线粒体动态学改变是否在DEHP致子代大鼠神经损伤中发挥作用是本文研究的重点。
1材料与方法
1.1主要试剂
DEHP (分析纯,美国Sigma 公司),TRIzol(美国Invitrogen公司),引物[生工生物工程(上海)股份有限公司],线粒体融合蛋白1(Mitofusin1,Mfn1)抗体和发动蛋白相关GTP 酶1(dynamin related GTPase 1,Drp1)抗体(美国Santa Cruz 生物公司)
1.2实验动物分组和染毒[3]
动物染毒:取SPF级Wistar大鼠共32只,其中雌鼠24只,雄鼠8只,适应性饲养1周后将雌鼠按体重随机分为4组,雌雄大鼠以1∶1同笼,第二日晨于盘底及阴道检查阴栓,查出阴栓者记为妊娠第0天,于妊娠第12天至第18天经口灌胃连续染毒7天,待其自然分娩。实验期间,大鼠自由摄食、饮水。
动物分组:每天对照组给予橄榄油,低、中和高剂量组分别给予10、100和500 mg/kg·BW DEHP。孕鼠产子后,单独哺养幼鼠。待子鼠出生满6周,每只孕鼠选取雌雄两只子代大鼠进行神经行为学测定。
1.3水迷宫实验
采用Morris水迷宫检测大鼠的空间学习记忆能力。Morris水迷宫圆形水池(直径2 m)、人为分为4个等大的象限。水池内加水后倒入墨汁使水呈不透明状,在其中一个象限正中放置一个直径12 cm圆形黑色平台,平台隐于水面下约2.0 cm处。利用Morris水迷宫图像自动采集和软件分析系统记录大鼠的游泳时间和距离。
定位航行实验:前5天为训练期,每只大鼠每天训练4次,每次从不同象限入水。寻找平台最长时间设定为1 min,平台停留时间为15 s,若在规定的时间内未找到平台,则引导大鼠至平台,停留15 s。第6天进行定位航行检测实验,每只大鼠从平台对侧象限入水,记录寻找平台的时间(潜伏期)及游泳路径长度。
空间探索实验:定期航行实验结束的次日进行。撤去平台,选择平台区域的对侧象限放入大鼠,记录60 s内大鼠在平台所在象限游泳的时间/(长度)与总时间(长度)的比。
1.4仔鼠海马Mfn1和Drp1 mRNA水平的检测
取仔鼠海马,利用TRIzol提取mRNA,参照逆转录试剂盒说明书进行逆转录,合成cDNA,以cDNA为模板加入相应反应体系的试剂进行PCR扩增。引物序列为:Mfn1上游引物为;5’-GCT GCA TAC AGA CAG ACA GCCT- 3’,下游引物为5’-GGT AAT GAC CTG TCT CAG GGC T-3’,产物浓度183bp;Drp1上游引物为5’-GGTGGAATTGGAGATGGTGGTCGA-3’,下游引物5’-TTCGTGCAACTGGAAGTGGCACA,产物浓度199 bp;β- actin上游引物为5’-AGT GGT GGC ACT AAT GGA G- 3’,下游引物为5’-TCT TTT GTC AGG GGT CGT TC- 3’,产物长度476 bp。PCR反应条件:95℃预变性1 min,95℃变性30 s,退火温度30 s,72℃延伸45 s,进行30个循环,最后72℃延伸7 min终止反应。电泳产物进行琼脂糖凝胶电泳,于凝胶成像分析仪上进行吸光度扫描,采用Quantity One软件分析条带灰度值。
1.5仔鼠海马Mfn1和Drp1 蛋白水平的检测
利用Western blot法检测Mfn1和Drp1蛋白水平,取海马组织与裂解液放入匀浆器中,冰上充分研磨后,4℃10 000 g离心15 min,上清为蛋白质。利用BCA蛋白定量试剂盒定量,98℃变性10 min。采用SDS-Page电泳分离不同分子量蛋白后,将蛋白转移至PVDF膜,5%脱脂牛奶封闭1 h后分别用Mfn1和Drp1抗体于4℃孵育过夜。洗膜后分别加入二抗孵育1小时,利用凝胶成像仪显示蛋白条带,用Quantity one软件对结果进行分析。
1.6数据分析
2结果
2.1DEHP对仔鼠定位航行能力影响
结果见表1,中、高剂量组潜伏期和游泳长度均明显高于对照组和低剂量组(P<0.05),高剂量组大鼠潜伏期和游泳长度均明显高于中剂量组(P<0.05),对照组与低剂量组无统计学差异(P>0.05)。
表1不同剂量DEHP暴露仔鼠定位航行能力的差异
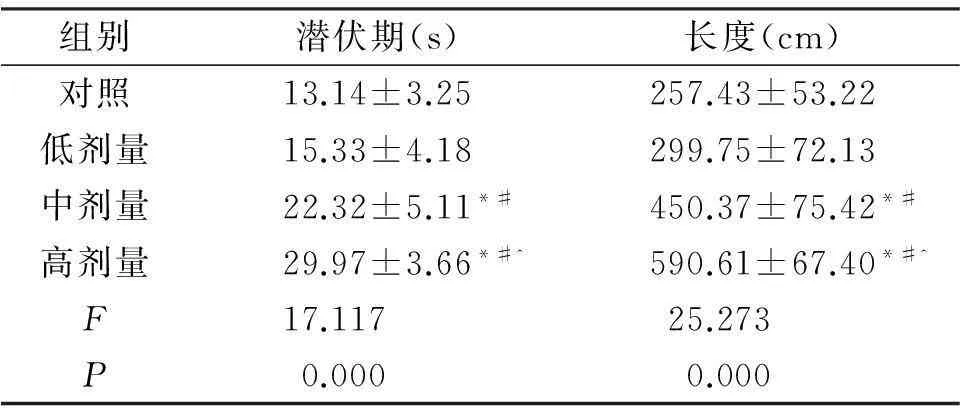
组别潜伏期(s)长度(cm)对照13.14±3.25257.43±53.22低剂量15.33±4.18299.75±72.13中剂量22.32±5.11*#450.37±75.42*#高剂量29.97±3.66*#^590.61±67.40*#^F17.11725.273P0.0000.000
注:*与对照组相比,P<0.05;#与低剂量组相比,P<0.05;^与中剂量组相比,P<0.05。
2.2DEHP对仔鼠空间探索能力影响
如表2所示,中、高剂量组平台所在象限游泳的时间/(长度)与总时间(长度)的比均明显低于对照组和低剂量组(P<0.05),对照组与低剂量组无统计学差异(P>0.05)。
表2不同剂量DEHP暴露仔鼠定位航行能力的差异

组别平台所在象限时间/总时间(%)平台所在象限长度/总长度(%)对照30.57±3.9128.41±2.88低剂量31.24±3.8828.55±3.04中剂量24.32±4.07*#21.35±3.42*#高剂量20.37±3.70*#20.18±2.96*#F8.94210.560P0.0010.000
注:*与对照组相比,P<0.05;#与低剂量组相比,P<0.05。
2.3DEHP对仔鼠海马Mfn1和Drp1 mRNA的影响
如表3和图1所示,相对于对照组及低剂量,中、高剂量组Mfn1 mRNA水平明显下降(P<0.05),而Drp1 mRNA水平明显上升(P<0.05),高剂量组Mfn1 mRNA水平低于中剂量组(P<0.05),而Drp1mRNA水平高于中剂量组(P<0.05)。
表3不同剂量DEHP暴露仔鼠Mfn1和Drp1 mRNA水平
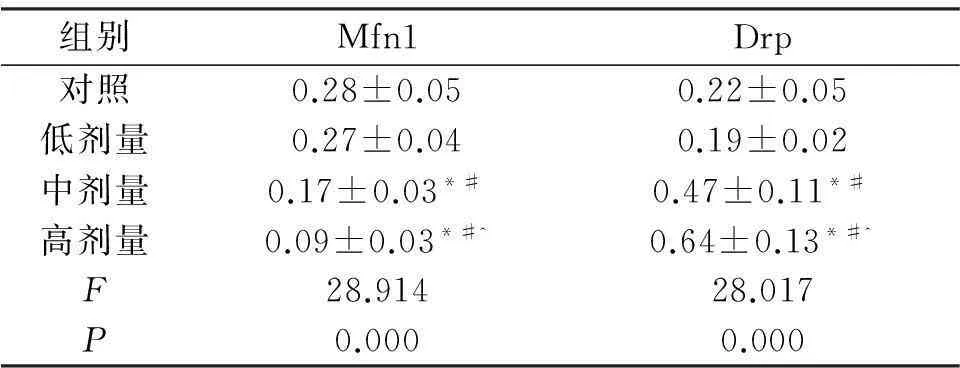
组别Mfn1Drp对照0.28±0.050.22±0.05低剂量0.27±0.040.19±0.02中剂量0.17±0.03*#0.47±0.11*#高剂量0.09±0.03*#^0.64±0.13*#^F28.91428.017P0.0000.000
注:*与对照组相比,P<0.05;#与低剂量组相比,P<0.05;^与中剂量组相比,P<0.05。
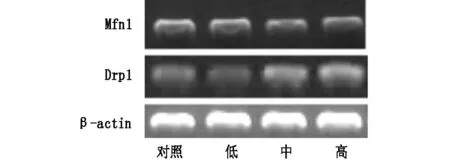
图1 不同剂量DEHP组仔鼠Mfn1和Drp1 mRNA水平
2.4DEHP对仔鼠海马Mfn1和Drp1 蛋白的影响
如表4和图2所示,相对于对照组及低剂量,中、高剂量组Mfn1蛋白水平明显下降(P<0.05),而Drp1蛋白水平明显上升(P<0.05),高剂量组Drp1蛋白水平高于中剂量组(P<0.05)。
表4不同剂量DEHP暴露仔鼠Mfn1和Drp1 蛋白水平

组别Mfn1Drp对照0.56±0.060.38±0.07低剂量0.58±0.180.40±0.12中剂量0.32±0.10*#0.59±0.07*#高剂量0.27±0.10*#0.75±0.07*#^F9.03721.250P0.010.000
注:*与对照组相比,P<0.05;#与低剂量组相比,P<0.05;^与中剂量组相比,P<0.05。

图2 不同剂量DEHP组仔鼠Mfn1和Drp1蛋白水平
3结论
DEHP可通过胃肠道系统、呼吸系统及皮肤进入机体,其中胃肠道是最主要的途径,其进入机体后可在胰腺酶等的作用下转化为MEHP,进而被吸收,吸收后的DEHP及MEHP主要分布于血液、肝脏、肾脏、胃肠道及脂肪组织[9]。DEHP的急性毒性较低,但其慢性毒性可对多种器官组织造成损伤。另外,研究发现孕妇广泛暴露于DEHP[10],其不但可对母体造成损伤,还可致子代肥胖[11]和肾脏损伤[12]。前期对DEHP的神经毒性的研究较少,但近几年研究发现宫内暴露的子鼠,神经系统明显受到损害,学习记忆能力等受到损伤[2-4]。而本研究也通过morris水迷宫实验发现,宫内暴露于DEHP的子代大鼠其定位航行能力及空间探索能力均受到损伤,神经行为发生了改变。
DEHP对子代大鼠神经行为的影响有多种机制,其可通过干扰神经类固醇CYP19A1 芳香化酶基因的转录[2],抑制海马内突触可塑性相关蛋白基因[4]等损失神经细胞,而线粒体动态学改变与DEHP致子代大鼠神经损伤之间的关系却未见报道。线粒体是细胞内产生ATP的重要细胞器,其也是一种动态的细胞器,它的数量和形态都是可变的,处在一种不断分裂和融合的动态平衡中,维持着细胞的正常功能,促进机体的生长和代谢,当线粒体动态平衡打破时,线粒体便无法保障细胞的正常功能。线粒体动态平衡对保证神经元末梢长距离运输和能量平均分布十分重要的,因此,线粒体融合分裂异常是许多神经变性疾病的致病因素之一,已经发现线粒体动态学改变与多种神经系统疾病的发病有关[5],已证实线粒体分离基因Drp1在氟中毒大鼠表达明显上升,与大脑神经细胞损失密切相关[13],因此,DEHP及代谢产物对神经细胞的损伤作用是否与线粒体动态失衡有关,是本研究的探索目的。本研究结果发现,DEHP暴露的子代大鼠线粒体融合基因Mfn1的基因和蛋白表达水平明显下降,分裂基因Drp1的基因和蛋白表达水平明显上升,证实DEHP在损伤神经细胞的过程中确实发生了线粒体动态失衡。
综上所述,宫内暴露于DEHP的子代大鼠神经行为学发生明显改变,线粒体动态失衡可能参与了这一过程。
参考文献:
[1]张晶莹,宋昕恬,孟令仪.不同剂量的DEHP对子代大鼠学习记忆的影响[J].中国实用医药,2012,7(10):246.
[2]李丹丹,刘尚辉,潘亮,等.塑化剂DEHP对子代大鼠神经毒性机制探讨[J].毒理学杂志,2012,05 (5):326.
[3]王永俊,张文众,贾旭东,等.孕期暴露邻苯二甲酸二(2-乙基己基)酯(DEHP)对子代大鼠神经发育毒性的影响[C].中国毒理学会第四届中青年学者科技论坛论文集2014.
[4]王永俊,李永宁,马宁,等.DEHP暴露对子代大鼠空间学习记忆能力和海马突触可塑性相关蛋白基因表达的影响[J].中国食品卫生杂志,2015,27(3):237.
[5]洪亢亢,曾爱源,李清华.线粒体融合相关蛋白与神经系统遗传性疾病[J].医学综述,2013,19(9):1561.
[6]Chen L,Winger AJ,Knowlton AA.Mitochondrial dynamic changes in health and genetic diseases[J].Mol Biol Rep,2014,41(11):7053.
[7]Arduíno DM,Esteves AR,Cardoso SM.Mitochondrial Fusion/Fission,Transport and Autophagy in Parkinson's Disease:When Mitochondria Get Nasty[J].Parkinson’s Disease,2011,2011:767230.
[8]Valla J,Schneider L,Niedzielko T,et al.Impaired platelet mitochondrial activity in Alzheimer’s disease and mild cognitive impairment[J].Mitochondrion,2006,6(6):323.
[9]蒋磊,徐维平,芮贝贝,等.邻苯二甲酸二乙基己酯体内代谢和毒性机制研究进展[J].中国药业,2015,24(5):1.
[10]陈晨,陈曦,陈叙,等.孕妇尿中3种邻苯二甲酸酯类代谢物的含量及影响因素[J].环境与健康杂志,2011,28(1):1.
[11]程雪佳.环境内分泌干扰物宫内暴露对子代小鼠肥胖的影响及作用机制研究[D].北京协和医学院中国医学科学院,2013.
[12]韦正峥.围产期暴露于DEHP对子代大鼠肾脏发育的影响及相关机制研究[D].华中科技大学,2013.
[13]楼迪栋,张凯琳,潘际刚,等.慢性氟中毒对大鼠神经细胞线粒体分裂蛋白Drp1表达的影响[J].中华预防医学杂志,2013,47(6):561.
Role of mitochondrial dynamic changes in DEHP-induced nerve injury of rat offspring
CHUYang,HUANGXiao-li,CUIZhuang.
(TianjinMedicalUniversity,Tianjin300070,China)
Abstract:ObjectiveTo investigate the role of mitochondrial dynamic changes in DEHP-induced nerve injury of rat offspring.MethodsThe pregnant mice were administered with different concentrations of DEHP.Positioning navigation and space exploration experiments was used to detect the neural behavior of 6 months old offspring rats.Enzyme-linked immunosorbent method (PCR) method and immune protein (Western blot) assay was used to detected the mRNA and protein levels of mitochondrial fusion genes Mfn1 and fission genes Drp1.ResultsIn the offspring rats of DEHP intrauterine exposure,Latency for seeking submarine platform was significantly prolonged(P<0.05),and the length of the swimming route was increased(P<0.05).The ratio of time / (length) and total length (length) of the platform is obviously decreased (P<0.05).The mRNA and protein levels of the fusion gene Mfn1 were significantly decreased (P<0.05),while the expression levels of mRNA and protein in the Drp1 were significantly increased (P<0.05).ConclusionIntrauterine exposure to DEHP can induce nerve injury in rats,and the changes of neural behavior may be caused by the imbalance of mitochondrial dynamics.
Key words:DEHP;nerve;mitochondrial dynamic changes;rat;water maze
(收稿日期:2015-09-19)
中图分类号:R741.02
文献标识码:A
*通讯作者
文章编号:1007-4287(2016)04-0525-04
