单增李斯特菌单克隆抗体的研制及特性分析
2016-05-23齐颖颖王怡雯谢远红张红星北京农学院食品科学与工程学院北京006河北省生物研究所河北石家庄05008
齐颖颖, 吴 萌, 王怡雯, 刘 慧, 谢远红, 张红星*(.北京农学院食品科学与工程学院,北京006;.河北省生物研究所,河北石家庄05008)
单增李斯特菌单克隆抗体的研制及特性分析
齐颖颖1,吴萌2,王怡雯1,刘慧1,谢远红1,张红星*1
(1.北京农学院食品科学与工程学院,北京102206;2.河北省生物研究所,河北石家庄050081)
摘要:运用辐照法和热灭菌法自制单增李斯特菌的免疫原、检测原,运用尾静脉免疫方法免疫BALB/c小鼠,运用杂交瘤技术进行细胞融合,制备得到抗单增李斯特菌的单克隆抗体,并对其进行免疫学特性分析。结果表明,成功筛选4株能稳定分泌抗单增李斯特菌的单克隆杂交瘤细胞株,腹水抗体效价为1∶102 400~1∶409 600,免疫球蛋白亚型为IgG1、Ig2a、Ig2b,亲和力常数在1×107~1×1010L/mol;经测定分析出最佳配对抗体;并与绵羊李斯特菌、英诺克李斯特菌及大肠杆菌、沙门氏菌、枯草杆菌、金黄色葡萄球菌、链球菌等菌属无明显交叉反应;进行双抗体夹心ELISA方法对模拟单增李斯特菌污染肉样检测其灵敏度达1×103CFU/mL。获得高效价、特异性强、灵敏度高的单克隆抗体,为食品中致病菌单增李斯特菌残留的免疫学检测方法奠定了基础。
关键词:单增李斯特菌;杂交瘤;单克隆抗体
民以食为天,食品安全关系到人类的生存和健康。随着经济全球化和食品贸易的日益扩大,危及人类健康、生命安全的重大食品安全事件屡屡发生,我国食品安全问题成为人们关注的热点。危害食品安全物质[1]包括环境污染、化学性危害(抗生素、激素等)、微生物危害(生物毒素、致病菌等)。其中致病菌近几年来给食品安全带来很大的威胁,主要的致病菌包括沙门氏菌、志贺氏菌、单增李斯特菌等等。
单核细胞增生李斯特菌[2](Listeria monocytogenes,LM)简称单增李斯特菌,为革兰氏阳性菌,需氧或兼性厌氧。LM是李斯特菌属中最重要的人畜共患的食源性致病菌,被列为居沙门氏菌之后第二位主要的食源性致死病菌。单增李斯特菌中毒严重的可以引起血液和脑组织感染,被LM感染后死亡率可达30%,新生婴幼儿和免疫力低下的人群中死亡率高达70%,常见病症包括脑膜炎、脑脊髓炎以及孕妇流产等[3]。单增李斯特菌在2~42℃下生存,能在冰箱内生存较长时间,生存环境可塑性大,其在酸性、碱性条件下和高盐浓度时也能存活并生长,适应范围很大,带菌较高的食品有乳制品、肉类等。单增李斯特菌不易被冻融,能耐受较高的渗透压,在土壤、地表水、污水、废水、植物中均有该菌存在,所以动物很容易食入该菌,30%以上的肉制品均被该菌污染,约占85%-90%的病例是由于被该菌污染而引起[4]。
目前检测单增李斯特菌有传统分离鉴定方法、分子生物检测法、免疫法[5]。其中传统的分离鉴定方法操作过程耗费大量的时间和劳动力,分子检测法的程序复杂、检测仪器昂贵、检测费用高。而免疫法应用抗原抗体的特异性识别作用,再通过酶催化底物的显色反应,将结果显示出来,具有快速、简便、灵敏度高、结果准确、简便等优点,适于大批量快速检测的需要,成为目前致病菌检测的主流技术,而基于该技术的快速检测产品占有绝大部分市场。
1 材料与方法
1.1试验动物
BALB/c小鼠:由北京实验动物中心提供。
1.2主要试剂和仪器
单增李斯特菌Listeria monocytogenes ATCC 54003、Listeria monocytogenes ATCC 54001,绵羊李斯特菌Listeria iuanuii ATCC 19119,英诺克李斯特菌Listeria innocua ATCC 33091,大肠杆菌E. coli O157 CMCC 44828,沙门氏菌Salmonella typhimurium ATCC13311,枯草杆菌Bacillus subtilis BD366,金黄色葡萄球菌Staphylococcus aureus CMCC26003及链球菌Streptococcus thermophilus G1等标准株:作者所在实验室保存。
小鼠SP2/0骨髓瘤细胞、单增李斯特菌免疫原和检测原:北京农学院食品科学与工程学院保存和制备。
李斯特菌培养基(国标GB 4789. 30-2010):北京陆桥技术有限责任公司。HAT培养基、HT培养基、PEG4000、完全佐剂和不完全佐剂以及小鼠单克隆抗体亚型鉴定试剂盒:Sigma公司;DMEM培养基、细胞培养板:GIBCO公司;HRP标记山羊抗小鼠IgG:北京华美生科生物技术有限公司。其他试剂均为分析纯。
1.3动物免疫
选取8只6周雌性BALB /c小鼠,初次基础免疫采用尾静脉注射[6]30 μg自制免疫原;二次基础免疫采用尾静脉20 μg自制免疫原。免疫间隔为2周。内眦取血并分离血清,间接ELISA检测小鼠血清抗体效价。选取最佳免疫小鼠,于融合前3天脾脏免疫注射免疫原20 μg加强免疫。
1.4杂交瘤细胞株的建立
取对数生长期的小鼠SP2/0骨髓瘤细胞与免疫脾细胞,按常规方法50% PEG进行细胞融合。检测培养上清液抗体效价,选择强阳性的细胞,从而进行数次有限稀释亚克隆筛选培养,直至100%阳性。制备出稳定的分泌高特异性、高效价、高亲和力抗体的杂交瘤细胞株,置于液氮中[7]。
1.5单克隆抗体的制备及抗体的特性分析
将抗单增李斯特菌杂交瘤细胞克隆及扩大培养接种于提前石蜡油致敏的雌性BALB/c小鼠腹腔[8],诱生腹水产生抗单增李斯特菌单克隆抗体。7~10 d后收集3~9 mL腹水进行抗体的ProteinG纯化[9],采用SDS-PAGE法检测抗体纯度[10],并用凝胶成像系统进行分析[11];采用紫外吸收法测定抗体浓度。
采用间接ELISA法进行抗体效价测定;采用sigma公司抗体亚型检测试剂盒鉴定抗体亚型。采用非竞争酶免疫试验对单克隆抗体的亲和力常数进行测定,采用高碘酸钠的方法进行抗体标酶。
1.6 ELISA相加试验及最佳配对
以单增李斯特菌自制检测原包被酶标板,分别加入一株McAb腹水温育后,再加入另一株McAbs腹水,温育后加入酶标记山羊抗小鼠IgG抗体,以四甲基联苯胺(TMB)为底物显色,终止反应后测得OD值。McAbs最佳配对的选择,按方阵交叉匹配法进行。分别以各种McAbs包被酶标板,以单增李斯特菌为中心抗原,和每种HRP标记的McAb逐一进行交叉匹配试验[12]。
1.7抗体特异性[13]与敏感性检测
用0.01 mol/L pH 9.6碳酸盐缓冲液将单克隆抗体稀释至5 μg/mL包被酶标板,4℃过夜;用PBS/T20洗板3次,每次3 min;用含10 %小牛血清的PBS/T20封闭,37℃孵育1 h,洗板;模拟污染肉样37℃孵育45 min,洗板;加入另一单克隆抗体HRP酶标抗体37℃孵育30 min,洗板;加入TMB显色液,37℃避光反应15 min后加入终止液;读取波长450 nm的OD值[14]。
2 结果与分析
2.1抗单增李斯特菌杂交瘤细胞株的建立
进行细胞融合,每次用6块96孔板,平均每孔有1~2株融合细胞生长,融合率为100 %。经过对阳性孔数次亚克隆,共获得4株稳定分泌抗单增李斯特菌的杂交瘤细胞株。分别命名为:1B10、3A12、4G11、5F6。
2.2抗体的制备及纯化
将得到的4株杂交瘤细胞分别注射到成年BALB/c小鼠腹腔内诱发腹水,每只获取3~9 mL腹水。经间接ELISA检测,4株腹水效价均在100 000以上。经蛋白质纯化,蛋白质质量浓度为18.8~35.4 mg/mL,凝胶成像分析纯度达88%~95%见表1。用Sigma公司的抗体亚型试剂盒鉴定,结果1B10为IgG2a,4G11为IgG2b,3A12和5F6为IgG1,见图1。

表1 LM mAb的效价及纯化后纯度和蛋白质质量浓度Table 1 Ascites titer and purity and purified protein content of anti-LM mAB
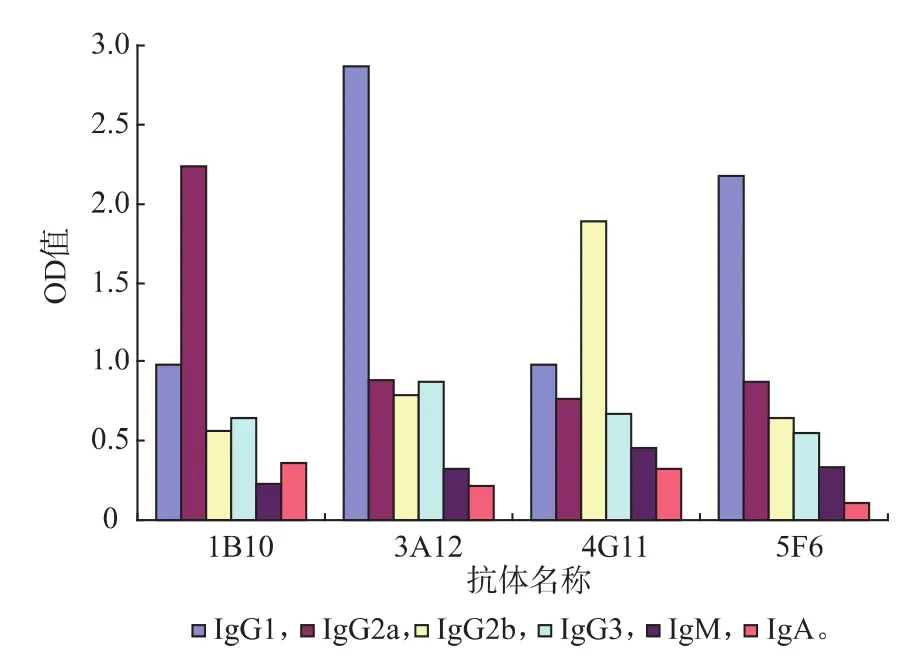
图1 单克隆抗体亚型鉴定Fig. 1 Assay of monoclonal antibody subtype
2.3单克隆抗体识别抗原表位特性分析
为了测定单抗识别抗原表位的特性,先以棋盘法测定酶标记山羊抗小鼠IgG的饱和度,并测定抗原与McAbs的饱和浓度。在本试验系统中,酶标记山羊抗小鼠IgG为1∶5 000倍稀释,各株单抗腹水根据所测饱和浓度分别作1∶500~1∶2 000倍稀释。结果以相加指数AI(addictivity index)大小来判定。
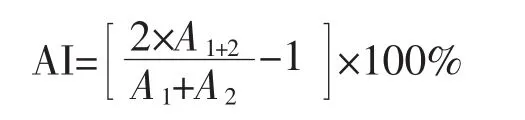
其中A1、A2分别是单独使用一株McAb所测定的OD值,A1+2为两株McAb所测定的OD值。若两株McAbs识别抗原的同一表位,A1+2应等于A1和A2的均值,AI应为零;若两株McAb识别不同的表位,A1+2应等于A1和A2的总和,AI则等于100%。在实际测定中,一般以AI值小于50%判定为识别相同的表位,以AI值大于50%判定为识别不同的表位。表2表明,只有1B10与4G11和3A12与5F6这两对McAb互交相加后,AI值均小于50%(最高AI值只有15.29%),则两对抗体所结合的表位是相同或距离很近,没有互补或相加的特性。而其余两对McAb互交相加后,计算得出的AI值大于50%(最高AI值为95.12%),具有相加性,它们识别抗原上不同的表位且表位的距离很远,即认为是识别抗原上不同构象表位的。
2.4最佳配对的选择及抗体灵敏度检测
据相加试验的结果,判定1B10与3A12,1B10 与5F6,4G11与3A12,4G11与5F5互为配对抗体。并将4株抗体分别标HRP酶为1B10-HRP,3A12-HRP,4G11-HRP和5F5-HRP。进行棋盘筛选试验,取每一株抗体分别包被酶标板,与不同浓度模拟污染LM肉样(107,106,105,104,103,100,50,10 CFU/ mg)反应后,加入各自其配对细胞株的标酶(HRP)抗体,其标酶抗体的初始质量浓度为2.5 μg/mL,按2n(n=0,1,2…)倍比稀释加入,运用双抗体夹心ELISA进行灵敏度检测。经试验证明1B10与3A12为最佳配对抗体,检测LM的灵敏度是最高的,当1B10作为包被抗体,3A12作为酶标抗体其质量浓度为0.625 μg/mL时检测LM的灵敏度可达100 CFU/mg,见图2。
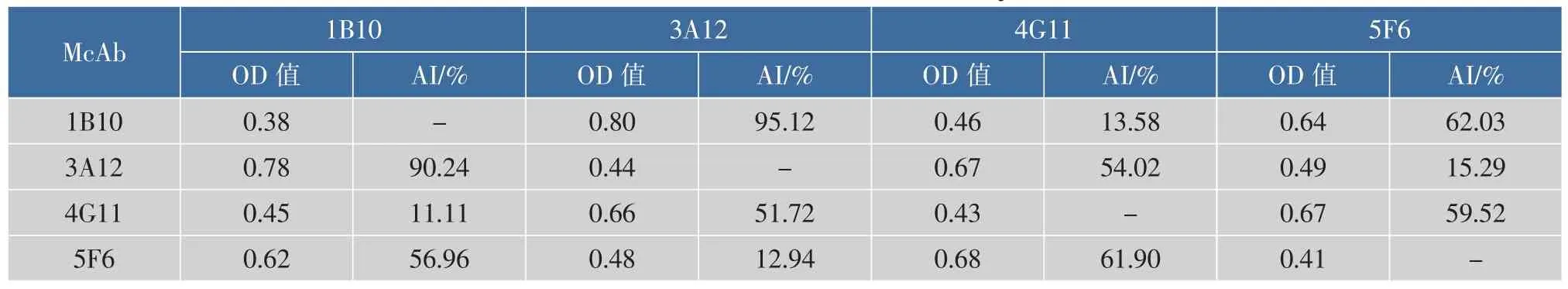
表2 4株McAb腹水相加试验的OD值及AI值Table 2 Titer of the combined test value and AI by indirect ELISA
抗原分子上的表位是由线性的氨基酸残基或者非连续序列折叠形成的紧密的三维结构,它们在抗原的表面是局部表面结构,1B10能与3A12-HRP配对检测到LM,表明该抗原分子表面这两个表位之间的距离较远。采用两株单抗夹心ELISA完成对LM的检测,这样既提高检测灵敏度又能增强特异性,这是因为单抗是由单个杂交瘤克隆分泌的抗体组成的,具有均质性和很高的亲和力,并且在抗原检测上具有高度一致的特性。

图2 1B10和3A12配对结果Fig. 2 Result of antibody pairs for ELISA
2.5双抗夹心ELISA检测特异性
以最佳配对的抗体以及最佳浓度来进行双抗体夹心ELISA检测特异性,其分别与两株单增李斯特菌和绵羊李斯特菌、英诺克李斯特菌、大肠杆菌、沙门氏菌、枯草杆菌、金黄色葡萄球菌及链球菌等菌株进行特异性检测,见图3。结果表明,两个单克隆抗体夹心检测的特异性很好,与两株单增李斯特菌有明显反应,但与绵羊李斯特菌、英诺克李斯特菌、大肠杆菌、沙门氏菌、枯草杆菌、金黄色葡萄球菌及链球菌和空白对照没有明显交叉反应。

图3 双抗体夹心ELISA特异性测定Fig. 3 Assay of specificity by sandwich ELISA
2.6亲和力测定
对4株单克隆抗体进行了亲和力测定,结果见图4。4株抗体的亲和力为1×107~1×1010L/mol,其中,1B10的亲和力是1×1010L/mol,3A12的亲和力是1×1010L/mol。


图4 亲和力测定Fig. 4 Association constant(Kaffi)curve of LM mAb
3 结语
作者制备和选定的1B10和3A12两株单克隆抗体效价高,抗单增李斯特菌特异性强,通过双抗体夹心ELISA法可以实现对单增李斯特菌的免疫学检测。这种检测方法具有过程简单、灵敏度高和分析速度快等优点,可作为对大量样品的快速初筛选分析,再将疑似阳性样品使用确证分析法进行确证,这样可以降低大批量样品的成本并提高分析效率。
参考文献:
[ 1 ]刘秀梅.中国食品工业与科技蓝皮书[M].北京:中国食品学报出版社,2003:44-48.
[ 2 ]李郁,魏建忠,王桂军.产单核李斯特菌的研究进展[J].中国卫生检验杂志,2005,15(8):1018-1020.LI Yu,WEI Jianzhong,WANG Guijun. Research progress in production of mononuclear Lester bacteria [J]. Chinese Journal of Health Laboratory Technology,2005,15(8):1018-1020.(in Chinese)
[ 3 ]沈晓盛,郑国兴,李庆,等.食品中单核细胞增生李斯特菌的危害及其检测[J].食品与发酵工业,2004,30(8):87-91. SHEN Xiaosheng,ZHENG Guoxing,LI Qing,et al. Hazard and detections of Listeria monocytogenes in food[J]. Food and Fermentation Industries,2004,30(8):87-91.(in Chinese)
[ 4 ]李干红,丁晓雯.李斯特菌及其快速检测[J].广州食品工业科技,2002,18(3):67-69.LI Ganhong,DING Xiaowen. Listaria and its rapid detections [J]. Guangzhou Food Science and Technology,2002,18(3):67-69.(in Chinese)
[ 5 ]梁锐萍,黄素珍,胡慧强.单核细胞增生性李斯特氏菌及其检验[J].动物科学与动物医学,2004,21(11):47-49. LIANG Ruiping,HUANG Suzhen,HU Huiqiang. Listeria monocytogenes and its detections [J]. Animal Science & Veterinary Medicine,2004,21(11):47-49.(in Chinese)
[ 6 ]徐怀德.食品杀菌新技术[M].上海:科学技术文献出版社,2005.
[ 7 ]裘法祖,武忠弼,吴在德,等.现代免疫学实验技术[M].武汉:湖北科学技术出版社,2002:23-25.
[ 8 ]金伯泉.细胞和分子免疫学实验技术[M].西安:第四军医大学出版社,2002:9-17.
[ 9 ]董志伟,王琰.抗体工程(第2版)[M].北京:北京医科大学出版社,2002:218-225,280-282.
[10] Mckinney M M,Parkinso A. A simple,nonchromatographic procedure to purity immunoglobulins from serum and ascites[J]. Immunol Methods,1987,96(2):271.
[11]奥斯伯F,等著.新编分子生物学实验指导[M].王海林,等译.北京:科学出版社,1998:333-338.
[12]刘苏燕,董邦全,李恩善.分析不同单克隆抗体识别的表位特异性的三种ELISA方法比较[J].上海免疫学杂志,1991,11 (2):108-109,112. LIU Suyan,DONG Bangquan,LI Enshan. Comparison of three ELISA methods for analysis of epitopes specificity using different monoclonal antibodies[J]. Shanghai Journal of Immunology,1991,11(2):108-109,112.(in Chinese)
[13] Chii Yuh Kuo,Kuang Wei Chen,Joseph Fu,et al. Generation of monoclonal antibodies to prostatic acid phosphatasc isoenzyme 2 and application in solid-phase enzyme immunoassay[J]. Biotechnology and Applied Biochemistry,1989,11:8995.
[14]哈洛E.苏思D.抗体技术实验指南[M].沈关心,龚非力,译.北京:科学出版社,2002:19.
Preparation and Characterization of Monoclonal Antibodies Against Listeria monocytogenes
QI Yingying1,WU Meng2,WANG Yiwen1,LIU Hui1,XIE Yuanhong1,ZHANG Hongxing*1
(1. Faculty of Food Science and Engineering,Beijing University of Agriculture,Beijing 102206,China;2. Biology Institute of Hebei Academy of Sciences,Shijiazhuang 050081,China)
Abstract:In order to explore the specific monoclonal antibodies against Listeria monocytogenes for the immunological detection,irradiation life-style and thermal extinguishing method were used to produce Listeria nonocytogenes antibodies as the antigen,four hybridomas stably secreting McAbs to Listeria monocytogenes were developed. The results showed that fourhybridomas were successfully established,and the indirect ELISA titers of the ascites were 1:104~1:4×104. Their immune globulin subtypes were IgG1,Ig2a,Ig2b.Therefore,Listeria monocytogenes could be detected by a two-antibody-sandwich enzyme-linked immunosorbent assay(das-ELISA)formed by McAbs. The affinity constants(Kaffi)were from 1×107L/mol to 1×1010L/mol,which had no cross-reaction between the other compounds. The sensitivity of LM McAbs in the detection of antigen was as low as 1×103CFU/mL. The high-titer,sensitive and specific anti-LM monoclonal antibodies were produced in thisstudy,whichmakesitpossibletodevelopimmunoassayfordetectionofLMresidues.
Keywords:Listeria monocytogenes,hybridomas,monoclonal antibody
*通信作者:张红星(1970—),男,黑龙江哈尔滨人,工学博士,教授,硕士研究生导师,主要从事食品安全检测方面的研究。E-mail:hxzhang511@163.com
基金项目:国家863科技计划项目(SS2012AA101606-5;2012BAD28B02-01);北京市长城学者培养计划项目(CIT&TCD20140315)。
收稿日期:2014-07-04
中图分类号:F 407.82
文献标志码:A
文章编号:1673—1689(2016)02—0151—05
