转基因马铃薯淀粉合成酶活性及淀粉质量分数的变化
2016-05-23陈国梁田瑞康马靖峰杨成成延安大学生命科学学院陕西延安716000陕西省红枣重点实验室陕西延安716000
陈国梁,田瑞康, 马靖峰, 杨成成,安 鹏(1.延安大学生命科学学院,陕西延安716000;2.陕西省红枣重点实验室,陕西延安716000)
转基因马铃薯淀粉合成酶活性及淀粉质量分数的变化
陈国梁1,2,田瑞康1,2,马靖峰1,2,杨成成1,2,安鹏1,2
(1.延安大学生命科学学院,陕西延安716000;2.陕西省红枣重点实验室,陕西延安716000)
摘要:以转基因马铃薯块茎为材料,采用双波长分光光度法、蒽酮比色法测定了其直链淀粉、支链淀粉和总淀粉的质量分数。对其GBSS、SSS的活性进行了测定,采用SPSS软件进行了独立样本t检验。结果表明:与对照组相比,转基因马铃薯(K5)总淀粉、支链淀粉的质量分数升高差异显著,GBSS、SSS的活性及直链淀粉质量分数降低差异显著。表明利用RNAi对马铃薯块茎淀粉合成酶基因的干扰取得了一定的效果。
关键词:转基因马铃薯;淀粉质量分数;直链淀粉;支链淀粉;淀粉合成酶
马铃薯(Solanum tuberosum L.)淀粉是重要的食品和工业原辅料,是一种廉价易得的可再生性资源,已成为许多生产领域的重要原料。在很多应用领域中,都要求淀粉具有较低的糊化温度和抗老化能力,高纯度的支链淀粉就具有这样的特性[1-3]。而糊化温度除受所处环境中的水分、温度、pH、盐类、糖类和极性高分子化合物的影响外,主要与直链淀粉与支链淀粉比例、淀粉链长以及淀粉的结构有关[4-7]。因此,人们为了进一步拓展马铃薯的生产及其淀粉的应用空间,期望培育出具有直链淀粉质量分数低,甚至无直链淀粉且支链淀粉链较短的糊化温度低和优良凝沉特性的马铃薯新品系。目前,国内外研究人员已开始采用基因工程等技术对淀粉合成过程中相关酶的活性调控,以便降低粉中直连淀粉的质量分数,提高支链淀粉的质量分数、分枝度和控制支链长度等一系列研究[8-13]。本课题组采用RNAi技术对马铃薯块茎内源gbss、ssⅢ和ssⅡ基因进行同时干扰,获得了相应的转基因试管苗K5[14],并对其块茎中直链淀粉、支链淀粉及总淀粉质量分数的测定,以检验干扰效果,为进一步培育优良的转基因马铃薯品种奠定基础。
1 材料与方法
1.1实验材料
转基因马铃薯(K5)试管苗与对照组试管苗:由作者所在课题组提供;直链淀粉和支链淀粉标准品:均为美国Sigma公司产品。
1.2实验方法
1.2.1转基因微型薯的获得将转基因马铃薯(K5)试管苗及对照接种在MS固体培养基中,置于25℃、1 500~2 000 Lx光照下培养约30 d左右,再转入暗培养箱中25℃培养50~60 d,收获微型薯。
1.2.2样品预处理挑取大小一致的转基因微型薯及其对照个体各15颗,分别将其切片后,液氮速冻研磨,取部分冻干粉用于酶活性测定,其余真空冷冻干燥至恒质量(36~48 h),过100目筛,采用常虹等的方法[15]依次脱脂、脱糖各3次,烘干,用于淀粉质量分数的测定。
1.2.3淀粉合成酶活性测定参照程方民等[16]的方法,取上述速冻研磨粉1.0 g,加4.0 mL提取液(pH 7.5,100 mmol/L Tricine -NaOH;8 mmol/L MgCl2,2 mmol/L EDTA,12.5%甘油;1% PVP-40,40 mmol/L 的2-巯基乙醇),冰浴研磨成浆,15 000 r/min、4℃离心20 min,收集上清液用于可溶性淀粉合成酶(GBSS)、颗粒结合淀粉合成酶(SSS)活性的测定,并以煮沸的酶液作对照,以每分钟利用l μmol ADPG作为1个酶活性单位(U),重复测定3次。
1.2.4总淀粉质量分数的测定参照郭东生等[17]报道的蒽酮比色测定淀粉的方法,以蒽酮-硫酸溶液作空白对照,以OD值为纵坐标,淀粉质量质量浓度为横坐标作图,制作淀粉含量标准曲线。称取0.300g上述待测粗样品于50mL离心管中,加入7 mL 52%高氯酸溶液,搅拌10 min,2 500 r/min离心10 min,将上清液转入20 mL带盖试管中,残留物再用7 mL 52%高氯酸溶液提取,合并提取液,定容,过滤,吸取2 mL滤液于50 mL容量瓶定容,再取2 mL溶液于50 mL容量瓶定容,然后取2 mL沸水浴显色后测定OD625 nm值,每个样品做5个重复,依据OD625 nm平均值,计算马铃薯总淀粉质量分数。
1.2.5直链淀粉和支链淀粉质量分数的测定
1)直链淀粉和支链淀粉检测波长的确定及回归方程的建立:参照黄惠芳等[18-20]的等吸收点作图法,取直链淀粉和支链淀粉标准液1 mL,放入50 mL容量瓶中,加蒸馏水25 mL,以0.1 mol/L溶液调至pH 3.5左右,加碘试剂0.5 mL,并用蒸馏水定容。静置20 min,以碘为对照,于400-800 nm波段扫描,得到光吸收谱图。采用绘图法确定直链淀粉测定波长λ1和参比波长λ2支链淀粉测定波长λ3和参比波长λ4。
分别移取0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL直链淀粉标准工作液于50 mL容量瓶中,加25 mL蒸馏水,以0.1 mol/L HCl调pH至3.5左右[15],加0.5 mL碘试剂(2% KI、0.2% I2),并用蒸馏水定容。静置20 min,用I2-KI作对照,在λ1和λ2处分别测定吸光值A,以ΔA为自变量,以相应直链淀粉质量分数为变量,建立直链淀粉的一元线性回归方程。分别移取1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5 mL支链淀粉标准工作液于50 mL容量瓶中,按照上述方法在λ3和λ4处分别测定吸光值A,建立支链淀粉的一元线性回归方程。
2)直链、支链淀粉质量分数的测定:准确称取25.0 mg待测样品,加入1.0 mol/L的NaOH溶液2.5 mL,在75~80℃水浴中分散溶解,用0.1 mol/L HCl溶液调节pH至3.5,并定容至50 mL,吸取3.0 mL 于50 mL容量瓶中定容,分别测得ΔA直和ΔA支,代入回归方程求出直链淀粉和支链淀粉的质量分数。
2 结果与讨论
2.1淀粉合成酶活性测定结果
经测定K5与对照组间淀粉合成酶的活性,结果表明见表1。对照组GBSS、SSS的活性依次为0.907、1.777,K5中的依次为0.573、0.957。采用SPSS软件独立样本t检验,K5与对照组间的GBSS活性t=14.586、df=4、p<0.05,SSS的活性t=30.513、 df=4、p<0.05。方差分析结果均为差异显著。说明K5与对照组间淀粉合成酶活性平均值差异显著。

表1 淀粉合成酶活性测定结果Table 1 Result of starch synthase activity
2.2样品中总淀粉质量分数测定结果
以蒽酮比色测定的淀粉OD625 nm值为纵坐标,淀粉溶液浓度为横坐标绘制总淀粉含量标准曲线,依据最小二乘法建立回归方程为:y=0.060 15x-0.000 73,相关系数为R2=0.999 3,见图1。将K5和对照组的OD625 nm带入方程中得淀粉的质量浓度,最后换算成每克微型薯干物质中淀粉的质量分数,结果见表2。从表2可知K5及对照组的干物质中淀粉的含量分别是77.25%和72.80%。其相对标准偏差RSD均小于1%,表明测定值具有较高的精度。

图1 淀粉吸收标准曲线Fig. 1 Standard curve of starch

表2 总淀粉重复性试验结果Table 2 Results of repeated determinations of potato starch
2.3直链淀粉和支链淀粉的检测波长及回归程
依据碘-直链淀粉、碘-支链淀粉复合物的扫描光谱图获得直链淀粉和支链淀粉的最大吸收波长分别是633 nm和559 nm,采用作图法选定直链淀粉测定波长λ1为633 nm,参比波长λ2为473 nm,支链淀粉测定波长λ3为559 nm,参比波长λ4为743 nm,见图2。

图2 直连、支链淀粉测定波长与参比波长的确定Fig. 2 UV -visible scanning spectra of amylose and amylopectin standards
依据最小二乘法建立一元化线性回归方程,直链淀粉:c直=6.751 66ΔA直-0.001 8(相关系数:R2= 0.999 4)。支链淀粉:c支=6.016 01ΔA支-0.001 1(相关系数:R2=0.999 7)。
2.4淀粉质量分数测定结果
通过回归方程求得直链,支链淀粉及总淀粉的质量分数见表3。从表3可知,K5中直链、支链淀粉、总淀粉的质量分数依次为5.00%、71.67%、76.67%,对照组直链、支链淀粉、总淀粉的质量分数依次为18.33%、51.67%、70.00%。其相对标准偏差RSD均小于1%,表明测定值具有较高的精度。由表4可得K5与对照组的直链与支链淀粉的比值依次为1/14、1/3。用SPSS软件进行独立样本t检验,K5与对照组间的直链淀粉质量分数t=23.880、df=4、p<0.05,支链淀粉质量分数t=11.798、df=4、p<0.05,总淀粉质量分数t=5.167、df=4、p<0.05,方差分析结果均为差异显著。说明K5与对照组间直链淀粉、支链淀粉及总淀粉质量分数平均值差异显著。
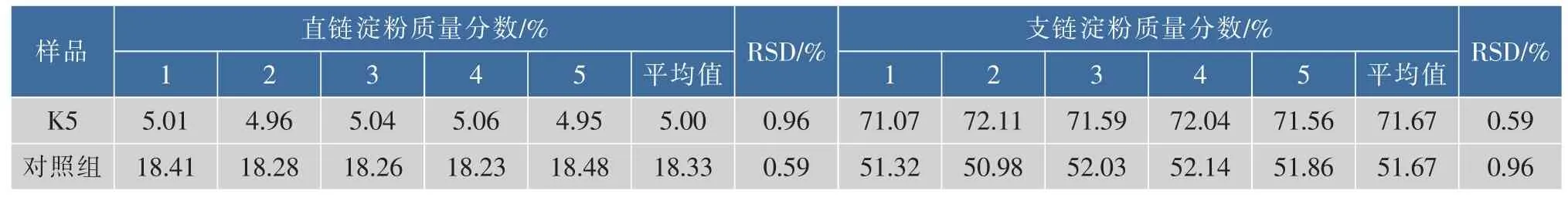
表3 直链淀粉、支链淀粉测定重复性试验Table 3 Results of repeated determinations of amylose and amylopectin in potato starch
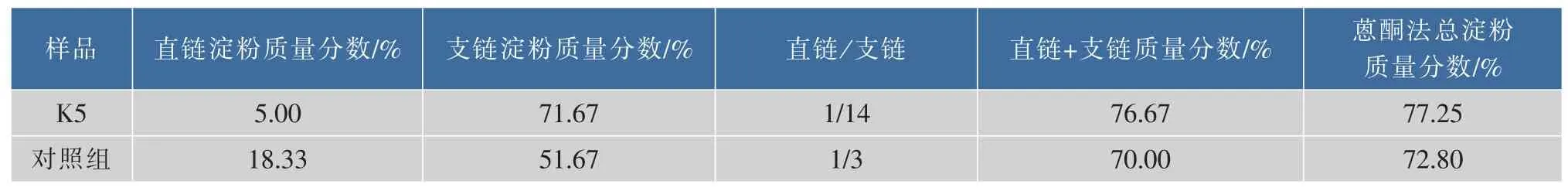
表4 微型薯直链、支链及总淀粉质量分数Table 4 Experiment results of amyloy,amylopectin and starch sample
3 结语
与对照组相比,K5中的GBSS、SSS活性均有所降低且差异显著。同时,对照组中直链淀粉、支链淀粉质量分数依次是K5的3.67倍、0.72倍。直链淀粉/支链淀粉比例在对照组、K5中依次为1/3和1/14,对照组总淀粉质量分数也低于K5且差异显著。可见,转基因微型薯K5与对照相比,在总淀粉质量分数上升的基础上,其直链淀粉/支链淀粉比例大幅度下降,即直链淀粉质量分数显著下降,支链淀粉质量分数明显提高。初步表明转基因马铃薯试管苗结出的微型薯具有直链淀粉质量分数低,且淀粉总量有所提高。同时也表明通过基因工程技术利用RNAi对马铃薯块茎内源gbss、ssⅢ和ssⅡ基因进行同时干扰所得结果与实验预期基本相符[14,21],但转基因微型薯块茎中淀粉的天然结构,支链淀粉链长、糊化温度和优良凝沉特性是否达到实验预期目标,还有待对其进一步研究。
鲜马铃薯淀粉质量分数一般在9%~20%,本实验测得微型薯总淀粉质量分数为11%左右,相对较低,可能是总淀粉质量分数与微型薯品种、栽培条件及微型薯本身成熟度等因素有关,也可能是微型薯在超低温保存时没能经杀青处理造成淀粉质量分数的下降,除此之外还可能与马铃薯块茎太小有关。
高氯酸水解-蒽酮比色法测得总淀粉质量分数高于双波长法,原因可能是高氯酸水解-蒽酮比色法无法排除样品中天然可溶性糖分对蒽酮法测定的干扰,此外高氯酸是强酸,使微型薯中的纤维素等碳水化合物产生葡萄糖类似物而引起[17]。
参考文献:
[ 1 ]于天峰,夏平.马铃薯淀粉特性及其利用研究[J].中国农学通报,2005,21(1):55-58. YU Tianfeng,XIA Ping. Characteristic and use of potato starch[J]. Chinese Agricultural Science Bulletin,2005,21(1):55-58. (in Chinese)
[ 2 ]高嘉安.淀粉及淀粉工艺学[M].北京:中国农业科技出版社,2001(9):22-55.
[ 3 ]胡爱军,郑捷,秦志平,等.变性淀粉特性及其在食品工业中应用[J].粮食与油脂,2010(6):1-4. HU Aijun,ZHENG Jie,QIN,Zhiping,et al. Properties of modified starches and their applications in food industry [J]. Journal of Cerecals & Oils,2010(6):1-4.(in Chinese)
[ 4 ]刘永强.基于RNAi技术获得高含量支链淀粉且抗低温糖化的转基因马铃薯品种[D].呼和浩特:内蒙古大学,2014.
[ 5 ]吕振磊,李国强,陈海华.马铃薯淀粉糊化及凝胶特性研究[J].食品与机械,2010,26(3):22-27. LV Zhenlei,LI Guoqiang,CHEN Haihua. Gelationization and gel properties of potato starch[J]. Food and Machinery,2010,26 (3):22-27.(in Chinese)
[ 6 ]孙健,岳瑞雪,钮福祥,等.淀粉型甘薯品种直链淀粉含量、糊化特性和乙醇发酵特性的关系[J].作物学报,2012,38(3):479-486. SUN Jian,YUE Ruixue,NIU Fuxiang,et al. Relationship among amylose content,starch pasting and ethanol fermentation in sweetpotato varieties for starch use[J]. Acta Agronomica Sinica,2012,38(3):479-486.(in Chinese)
[ 7 ]苏文丽,向珣朝,徐艳芳,等.水稻SSIIa基因型对成糊温度校准的影响及糊化温度与直链淀粉含量的关系分析[J].植物遗传资源学报,2014,15(2):348- 353. SU Wenli,XIANG Xunchao,XU Yanfang,et al. The influence of SSIIa genotype on the calibration of pasting temperature of rice and the relationship between gelatinization temperature and amylose content [J]. Journal of Plant Genetic Resources,2014,15 (2):348-353.(in Chinese)
[ 8 ] Heilersig H J B,Loonen A,Bergervoet M,et al. Post-transcriptional gene silencing of GBSSI in potato:effect of size and sequence of the inverted repeats[J]. Plant Mol Biol,2006,60:647-662.
[ 9 ]陈国梁,张向前,穆三浪,等.利用RNAi技术改良淀粉品质的研究进展[J].生物技术通报,2009(10):88-101. CHEN Guoliang,ZHANG Xiangqian,MU Sanlang,et al. Research advance of RNA interference technology in starch quality improvement[J]. Biotechnology Bulletin,2009(10):88-101.(in Chinese)
[10] Motoyasu O,Tatsuro H,Kenji K,et al. Inhibition of the gene expression for granule-bound starch synthase I by RNA interference in sweet potato plants[J]. Plant Cell Reorts,2007,26(10):1801-1807.
[11]李洲.以GBSS、SSⅢ、SSⅡ基因为靶标的RNAi载体对马铃薯的转化及鉴定[D].兰州:甘肃农业大学,2009.
[12]郭志鸿,王亚军,张金文,等.采用一种新型RNAi载体培育转基因高直链淀粉马铃薯[J].作物学报,2009,35(5):809-815. GUO Zhihong,WANG Yajun,ZHANG Jinwen,et al. Development of transgenic high-amylose potato using a novel RNAi vector [J]. Acta Agronomica Sinica,2009,35(5):809-815.(in Chinese)
[13] Shimada T,Otanim,Hamad T,et al. Increase of amylose content of sweetpotato by RNA interference of the starch branching enzymeⅡgene(IbSBE)[J]. Plant Biotechnol,2006,23:85-90.
[14]陈国梁.以gbss、ssⅢ和ssⅡ为靶标的RNAi载体构建及转基因马铃薯植株的获得[D].兰州:甘肃农业大学,2008.
[15]常虹,周家华.葛根淀粉提取及直链-支链淀粉的双波长测定[J].食品工业科技,2009,30(11):239-276. CHANG Hong,ZHOU Jiahua. Extraction of pueraria lobata starch and determination of amylose and amylopectin by dual-wavelength spectro photometry[J]. Science and Technology of Food Industry,2009,30(11):239-276.(in Chinese)
[16]程方民,蒋德安,吴平,等.早籼稻籽粒灌浆过程中淀粉合成酶的变化及温度效应特征[J].作物学报,2001,27(2):201-206. CHENG Fangmin,JIANG Dean,WU Ping,et al. The dynamic change of starch synthesis enzymes during the grain filling stage and effects of temperature upon it[J]. Acta Agronomica Sinica,200,27(2):201-206.(in Chinese)
[17]郭冬生,彭小兰.蒽酮比色法和酶水解法两种淀粉测定方法的比较研究[J].湖南文理学院学报:自然科学版,2007,19(3):34-36. GUO Dongsheng,PENG Xiaolan. Comparative study on antrone chromametry and enzymatic hydrolysis for assay starch method [J]. Journal of Hunan University of Arts and Science:Natural Science Edition,2007,19(3):34-36.(in Chinese)
[18]黄惠芳,罗燕春,侯学文,等.不同样品分散温度对双波长比色法测定木薯直、支链淀粉比率及总淀粉含量的影响[J].中国农学通报,2012,28(3):272-276. HUANG Huifang,LUO Yanchun,HOU Xuewen,et al. The effect of different sample dispersion temperatures on cassava amylose and amylopectin,total starch content determination by double wavelength spectrophotometric method [J]. Chinese Agricultural Science Bulletin,2012,28(3):272-276.(in Chinese)
[19]曾凡逵,赵鑫,周添红,等.双波长比色法测定马铃薯直链/支链淀粉含量[J].现代食品科技,2012,28(1):119-122. ZENG Fankui,ZHAO Xin,ZHOU Tianhong,et al. Dual-wavelength colorimetric method for measuring amylose and amylopectin contents of potato starch[J]. Modern Food Science and Technology,2012,28(1):119-12.(in Chinese)
[20]石海信,郝媛媛,方怀义,等.双波长法测定木薯淀粉中直链和支链淀粉的含量[J].食品科学,2011,32(21):123-127. SHI Haixin,HAO Yuanyuan,FANG Huaiyi,et al. Separation and purification of amylose and amylopectin from cassava starch and content determination by dual-wavelength spectrophotometry[J]. Food Science,2011,32(21):123-127.(in Chinese)
Study on Amylosynthease Activity and the Change of Starch Content in Transgenic Potato Tuber
CHEN Guoliang1,2,TIAN Ruikang1,2,MA Jingfeng1,2,YANG Chengcheng1,2,AN Peng1,2
(1. College of Life Science,Yan'an University,Yan'an 716000,China;2. Shaanxi Key Laboratory of Chinese Jujube,Yan'an 716000,China)
Abstract:The contents of amylose,amylopectin and total starch were determined via Dual-wavelength spectrophotometry and Anthrone colorimetry in transgenic potato tubers,respectively. Furthermore,activities of GBSS,SSS were measured. Independent samples t test were performed by using statistical SPSS software. The results showed that the contents of total starch and amylopectin in transgenic potato tubers(K5)were significantly higher than that in control group,while activities of GBSS,SSS and the amylose content of K5 decreased significantly. This indicated that synthase gene of transgenic potato was affected by RNA interference in some extent.
Keywords:transgenic potato,starch content,amylose,amylopectin,amylosynthease
作者简介:陈国梁(1974—),男,陕西定边人,理学硕士,副教授,硕士研究生导师,主要从事植物生物技术方面的研究。E-mail:glc9359@163.com
基金项目:延安市农业攻关项目(2011kn-09);延安大学高水平大学建设项目(2012SXTS06);延安大学校级科研项目(YD2014-01);地方高校国家级大学生创新训练计划项目(201410719041)。
收稿日期:2014-09-08
中图分类号:S 330.2
文献标志码:A
文章编号:1673—1689(2016)02—0219—05
