抗KDR单克隆抗体的制备*
2013-07-16李丽英谯时文李东
李丽英 谯时文 李东
(乐山职业技术学院人体解剖教研室,四川 乐山614000)
新生血管是指在已存在的血管基础上,通过发芽或分支方式所形成的新血管。肿瘤的生长和转移依赖于血管的生成[1]。在血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF)家族中,VEGF-A在肿瘤血管新生中发挥着重要作用,它能促使内皮细胞有丝分裂,诱导血管内皮细胞增殖和迁移,促进新生血管形成,还能增加血管通透性[2]。VEGF-A的这些生物学效应主要是通过其血管内皮细胞生长因子受体,又含激酶插入区的受体(Human kinase insert domain containing receptor,KDR)来实现的。KDR是1992年 Terman[3]等最早从人脐静脉内皮细胞cDNA文库中,应用与已知受体酪氨酸激酶的同源产物扩增获得。研究证明,靶向敲除KDR基因,将导致血岛形成损伤,并缺乏成熟的内皮细胞,从而使小鼠胚胎于第8.5~9.5d死亡[4]。在成年小鼠中,即使是通过药物短期阻断VEGF-A与KDR之间的相互作用,仍然会引起血管退化[5]。鉴于KDR在VEGF-A/KDR信号通路中的重要作用,我们采用杂交瘤技术制备能稳定分泌抗KDR单克隆抗体(Monoclonal Antibody,mAb)的杂交瘤细胞,以期获得能抑制VEGFA生物学效应的抗KDR mAb。
1 材料与方法
1.1 材料
8~10周龄、18~20g雌性清洁级BALB/c小鼠6只,购自四川大学实验动物中心,合格证号:SYXK(川)2009-045。小鼠骨髓瘤细胞SP2/0-Ag14、谷胱甘肽转硫酶蛋白(Glutathione S-transferases,GST)、GST-KDR融合蛋白,由四川大学免疫学教研室提供。次黄嘌呤H、氨基喋呤A、胸腺嘧啶T、聚乙二醇等购于美国Sigma公司。
1.2 方法
1.2.1 杂交瘤细胞株的建立
用纯化的GST-KDR蛋白作为免疫原,常规皮下免疫BALB/c小鼠2只,50μg·只-1,共4次;末次加强免疫后3d,取小鼠脾脏通过机械分离法制成脾细胞悬液,与小鼠骨髓瘤细胞SP2/0-Ag14在聚乙二醇介导下融合,采用杂交瘤技术建立分泌抗KDR mAb的杂交瘤细胞株。
1.2.2 最佳抗原包被浓度的确定及抗KDR mAb的检测
按照间接酶联免疫法(Enzyme-linked immunosorbent assay,ELISA)进行,以GST-KDR融合蛋白进行包板,该蛋白浓度为1.6mg·mL-1。先用碳酸盐缓冲液对GST-KDR融合蛋白进行10倍稀释,再2倍倍比稀释,即分别为1、1/2、1/4、1/8、1/16、1/32、1/64、1/128、1/256。再通过间接 ELISA 法检测杂交瘤细胞的培养上清液。
1.2.3 抗KDR mAb的大量制备及纯化
取雌性BALB/c小鼠4只,每只BALB/c小鼠腹腔内注射0.5mL液体石蜡,7d后将建株的杂交瘤细胞(5×106细胞·只-1)接种于小鼠腹腔。10~14d后收集腹水,按饱和硫酸铵法进行盐析,G-Sephrose 4B亲和层析纯化,用紫外分光光度计测定其蛋白浓度。
1.2.4 抗KDR mAb效价的测定
采用间接ELISA法测定纯化后抗KDR mAb的效价。以(测定孔A450值/阴性对照孔A450值)≥2.1为阳性,选择阳性孔中的最高稀释度即为抗KDR mAb的效价。
2 结果
2.1 杂交瘤细胞株的建立
融合细胞接种于4块96孔细胞培养板,融合后7~10d,观察到杂交瘤细胞生长孔352孔,细胞融合率为91.7%;初选特异性阳性克隆细胞33孔,阳性率为8.7%。4~5d后,取单克隆培养孔上清液,利用间接ELISA法进行检测,最终获得4株只针对 KDR的杂交瘤细胞株,分别是1E8、1F1、2B8、3E9。经有限稀释法,对阳性克隆孔2B8、3E9进行反复亚克隆,最终获得1株能稳定分泌抗KDR mAb的杂交瘤细胞株,命名为3E9 B2G11。
2.2 包被抗原最佳浓度的确定
通过间接ELISA法测得GST-KDR包被抗原浓度在2倍倍比浓度稀释下对应的A450值,以GST-KDR包被抗原浓度为横坐标,对应的吸光度A450值为纵坐标,通过Excel软件绘制出图1,曲线接近水平状态时的抗原最高稀释浓度为抗原的最佳包被浓度。由图1可看出GST-KDR抗原的最佳包被浓度是10μg· mL-1(见图1)。
2.3 抗KDR mAb的蛋白浓度测定
牛血清白蛋白(Bovine serum albumin,BSA)作为标准蛋白质,用双蒸水倍比稀释,752型紫外分光光度仪测定A280值,绘制吸光度值-标准蛋白BSA系列浓度梯度曲线(见图2)。将浓缩纯化腹水样品稀释10倍进行测定,其A280值为0.42,对应标准曲线,通过Excel软件FORECAST线性回归统计分析计算出抗KDR mAb的蛋白浓度为6.1mg·mL-1。
2.4 抗KDR mAb的效价测定
由间接ELISA法测定杂交瘤细胞株3E9B2G11所分泌的抗体效价为1∶16384。
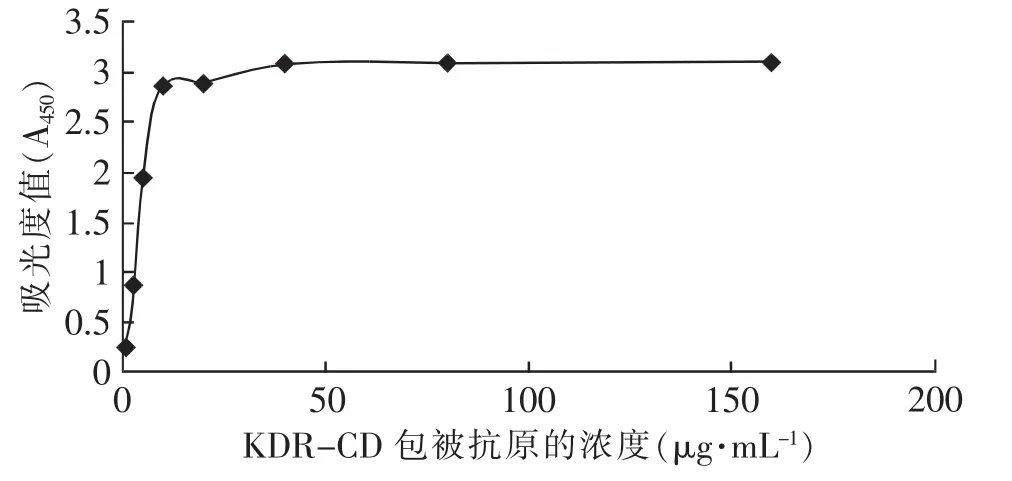
图1 吸光度- (GST-KDR)包被抗原浓度梯度曲线
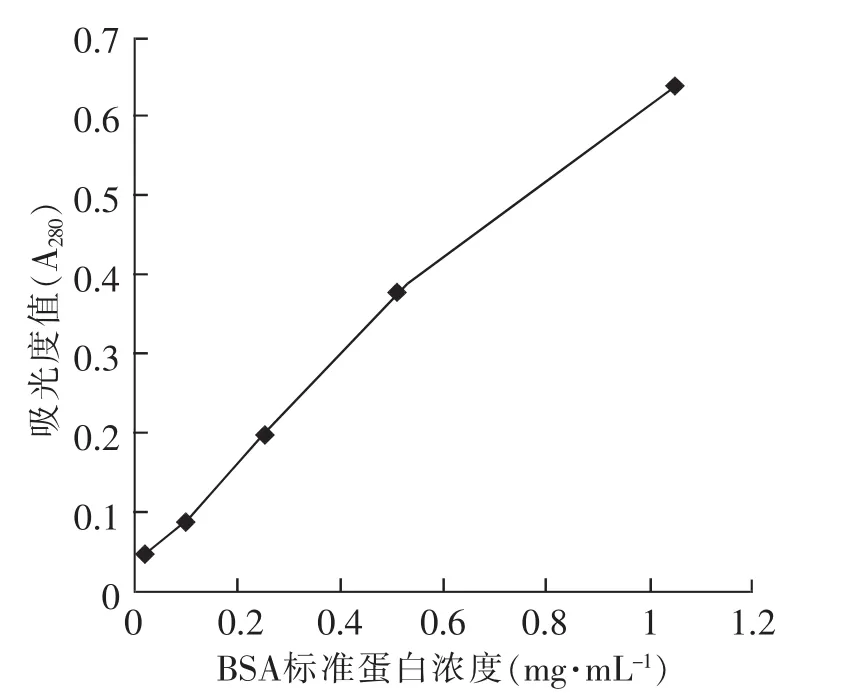
图2 吸光度值-标准蛋白BSA系列浓度梯度曲线
3 讨论
早在1971年,Folkman[6]就提出肿瘤的生长和转移离不开血管生成,无论何种抗肿瘤新生血管形成的技术都将是对现有肿瘤治疗学的强有力的补充。抗血管生成治疗肿瘤的策略是:通过阻断肿瘤组织中血管生长因子对血管内皮细胞的作用来阻止新生血管形成,从而抑制肿瘤的生长和转移。目前有许多观点趋向于采用KDR作为阻断肿瘤血管新生治疗的最佳靶点,理由如下[7]:1)KDR主要表达于活化的内皮细胞,如肿瘤位点;2)由于肿瘤内皮细胞与血液直接接触,使KDR受体抑制剂更容易达到靶细胞;3)VEGF家族中,除VEGF-A外,其它成员如VEGF-C、-D、-E也可作为KDR的配体;因此,采用KDR受体抑制剂可潜在阻断它们的刺激作用。Michael[8]等对49例妇科恶性肿瘤患者、61例妇科良性肿瘤患者及12例对照组的血清进行分析发现,在乳腺癌、子宫内膜癌及卵巢癌等恶性肿瘤中,VEGF-A及磷酸化KDR的表达水平都显著高于良性肿瘤及对照组。KDR高表达于被激活的血管内皮细胞上,若能抑制其活性,阻断VEGF-A/KDR信号转导通路,VEGF-A就不能发挥作用,从而达到抗肿瘤新生血管形成的目的。
为了能最大限度地封闭VEGF-A与内源性KDR受体结合,我们以GST-KDR蛋白免疫小鼠,通过杂交瘤技术制备能稳定分泌抗KDR mAb的杂交瘤细胞。本实验中,我们对GST抗原和GST-KDR抗原都进行包被,取单克隆细胞的上清液同时进行检测,观察上清液与GST抗原、GST-KDR抗原的结合情况。通过间接ELISA法对杂交瘤细胞进行筛选,每次只选择与GST-KDR蛋白反应呈阳性的克隆细胞进行亚克隆,分离出针对KDR单一抗原决定簇的B细胞克隆。经间接ELISA法检测出只分泌抗GST-KDR蛋白抗体的细胞克隆后,利用有限稀释法对杂交瘤细胞进行克隆化。经过3次反复间接ELISA法检测特异性抗体及反复亚克隆,得到了一株基因型稳定并能稳定分泌抗KDR mAb的杂交瘤细胞株,命名为3E9B2G11。实验结果证明,用GST-KDR蛋白免疫BALB/C小鼠,可获得特异、稳定分泌抗KDR mAb的杂交瘤细胞株。这为以后将该抗体改造成小分子酪氨酸激酶抑制剂,使其能进入细胞内与受体KDR特异性结合并阻断血管内皮细胞生长因子的强大生物学功能奠定了重要的基础。
1 Kumar R,Fidler IJ.Angiogenic molecules and cancer metastasis[J].In Vivo,1998,12(1):27-34.
2 Jin HC,Nitin KG,Elisa L,et al.Corneal Neovascularization:An Anti-VEGF Therapy[J].Surv Ophthalmol,2012,57(5):415-429.
3 Terman B,Khandke L,Dougher VM,et al.VEGF receptor subtypes KDR and Flt-1show different sensitivities to heparin and placenta growth factor[J].Gowth Factor,1994,11(3):187-195.
4 Shalaby F,Gertsenstein M,Rossant J,et al.Failure of blood-island formation and vasculogenesis in Fik-l deficient mice[J].Nature,1995,376(6):62-66.
5 Kamba T.VEGF-dependent plasticity of fenestrated capillaries in the normal adult microvasculature[J].Am J Physiol Heart Circ Physiol,2006,290(2):H560-H576.
6 Folkman J.Tumor angiogenesis:Theraputic implication[J].N Engl J Med,197l,285(21):1182-1186.
7 Miao H,Hu K,Jimenea X,et al.Potent neutralization of VEGF biological activities with a fully human antibosy Fab fragment directed against VEGF receptor 2[J].Biochem Biophys Res Commun,2006,345(1):438-445.
8 Michael I,Koukourakis,Vassilios L,et al.Serum VEGF levels and tissue activation of VEGFR2/KDR receptors in patients with breast and gynecologic cancer[J].Cytokine,2011,53(3):370-375.
