人白介素-29变异体在毕赤酵母中的表达及抗肿瘤活性
2016-05-23李利云彭荣刚邬敏辰江南大学药学院江苏无锡4江南大学无锡医学院江苏无锡4江南大学生物工程学院江苏无锡4
陆 源, 陈 伟, 李利云, 彭荣刚, 李 菲, 邬敏辰(.江南大学药学院,江苏无锡4;.江南大学无锡医学院,江苏无锡4;.江南大学生物工程学院,江苏无锡4)
人白介素-29变异体在毕赤酵母中的表达及抗肿瘤活性
陆源1,陈伟*2,李利云3,彭荣刚2,李菲2,邬敏辰2
(1.江南大学药学院,江苏无锡214122;2.江南大学无锡医学院,江苏无锡214122;3.江南大学生物工程学院,江苏无锡214122)
摘要:基于生物信息学分析的结果,采用基因突变和大引物PCR技术完成人白细胞介素-29 (hIL-29)成熟肽第33位氨基酸的定点突变,成功实现其在毕赤酵母(Pichiapastoris)GS115中的异源表达。重组人白细胞介素-29变异体蛋白(rhIL-29mut33)在不同质量浓度时,对肝癌细胞BEL7402、结肠癌细胞HCT8和胃癌细胞SGC7901的增殖均有抑制作用,而且抑制增殖效应强于野生型rhIL-29。与低质量浓度相比,高质量浓度下rhIL-29mut33对肿瘤细胞增殖抑制作用更强,对上述3种肿瘤细胞的增殖抑制率分别达到(31.76±2.87)%、(22.47±0.26)%和(34.41± 0.40)%。rhIL-29mut33良好的生物学活性表明该变异体具有较大的应用潜力。
关键词:人白细胞介素-29;定点突变;基因克隆;表达;抗肿瘤活性
人白细胞介素-29(Human interleukin-29,hIL-29)是近年发现的一种细胞因子,又称为干扰素λ1 (Interferon λ1,IFNλ1),其与hIL-28A和hIL-28B同属IFN λ家族(IFNλs)[1-2]。hIL-29通过结合特殊的异二聚体受体复合物起始信号的传导,其与Ⅰ型IFN共享相同的JAK-STAT信号传导途径,促进一组共同基因的表达。因此,hIL-29表现出一些与Ⅰ型IFN相同的性质,如抗病毒、抗增殖、体内抗肿瘤以及免疫调节等生物学活性[3]。hIL-29的特异受体复合物由特有的结合亚基IL-28R1和辅助亚基IL-10R2组成。IL-28R1表达的细胞谱系较少,因此,hIL-29作用的靶细胞有限,主要包括肝细胞、胃肠细胞和上皮细胞[4-8]。由此提示hIL-29作为药物的副作用可能比Ⅰ型IFN更小,可望研制开发临床疗效高且副作用小的新一代干扰素药物。研究发现,hIL-29肽链中有一个由胞内向胞外的跨膜结构域,其空间构象由6个α螺旋(A-F)和无规则卷曲组成[9]。hIL-29空间构象的A、B和F螺旋可能是hIL-29与特异性受体结合而发挥生物学效应的活性部位。对hIL-29的生物信息学分析表明,A和F螺旋中有4个氨基酸残基可能是影响其生物学活性的关键氨基酸残基[10]。
作者所在课题组前期已从健康人外周血单个核细胞经RT-PCR得到hIL-29成熟肽的编码基因,并获得酵母表达的重组hIL-29成熟肽[11-12]。在此基础上,作者以生物信息学分析结果为依据[10],采用定点突变和大引物PCR技术将hIL-29成熟肽的Lys33定点改造为Arg33,将变异体hIL-29mut33通过毕赤酵母GS115重组表达,初步分析了重组hIL-29变异体(rhIL-29mut33)的抗肿瘤活性,结果显示该变异体具有较好的抗肿瘤效应。
1 材料与方法
1.1质粒、菌株和细胞株
大肠杆菌E. coli JM109,真核表达质粒pPIC9KM:购自Invitrogen公司并经作者所在实验室改造;整合了hIL-29成熟肽基因的重组质粒pPIC9KM-hIL-29:由作者所在实验室构建;克隆质粒pUCm-T:上海Sangon公司;毕赤酵母GS115:Invitrogen公司;人肝癌细胞BEL7402、人结肠癌细胞HCT8及人胃癌细胞SGC7901:由江南大学药学院金坚教授惠赠。
1.2主要试剂和培养基
各种限制性内切酶、T4DNA连接酶、rTaq DNA聚合酶、DNA Ladder Marker、低相对分子质量蛋白质Marker和EZ-10柱式DNA回收试剂盒:大连TaKaRa公司;胰蛋白胨、酵母提取物、DAB、SDS、G418、硝酸纤维素膜(NC膜)和RPMI-1640培养基等:上海Sangon公司;羊抗人IL-29多克隆抗体:美国R&D公司;HRP标记兔抗羊IgG:上海明睿公司;新生小牛血清:浙江天杭生物科技有限公司;胰酶细胞消化液、青霉素-链霉素溶液(100×)和Cell Counting Kit-8试剂:碧云天生物技术研究所;重组人干扰素α2b注射液:北京凯因科技股份有限公司;其余试剂均为国产分析纯。LB、YPD、MD、BMGY 和BMMY培养基的配制按Multi -Copy Pichia Expression Kit(Invitrogen公司)操作手册。
1.3引物设计与合成
参照NCBI公布的hIL-29的编码序列(登录号:AY336716.1),结合生物信息学分析结果,设计扩增编码hIL-29成熟肽cDNA的特异性上、下游引物及突变引物(第98位碱基T突变为C):
上游引物(hIL-29-F):5’- CTCGAGAAAAGAG GCCCTGTCCCCACTTCC -3’,含XhoⅠ位点;
下游引物(hIL-29-R):5’- GCGGCCGCTCAGG TGGACTCAGGGTGG -3’,含NotⅠ位点;
突变引物(hIL-29-A):5’- CCCTGGCCCTCTT GAAGCTCGCTA -3’,含突变位点。
1.4 hIL-29mut33编码基因的克隆
采用大引物PCR方法,对hIL-29成熟肽基因实行定点突变。第一轮PCR扩增以pPIC9KM-hIL-29质粒为模板,hIL-29-F和hIL-29-A为引物,反应条件如下:94℃预变性2 min;94℃变性30 s,57℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。第二轮大引物PCR扩增以pPIC9KM-hIL-29质粒为模板,以第一轮PCR产物和hIL-29-R为引物,反应条件与第一轮相同。PCR产物经1 g/dL琼脂糖凝胶电泳后,用EZ-10 Spin Column DNA Extraction Kit回收目的基因,操作按说明书。将回收的目的基因与pUCm-T连接,转化JM109感受态细胞,蓝白斑筛选阳性转化子,送上海Sangon公司测序,测序正确的重组质粒pUCm-T-hIL-29mut33经XhoⅠ和NotⅠ双酶切,回收目的基因hIL-29mut,与同样双酶切的pPIC9KM质粒连接,转化JM109感受态细胞,经PCR筛选鉴定获重组表达质粒pPIC9KM-hIL-29mut33后,送上海Sangon公司测序鉴定。
1.5 hIL-29mut33在毕赤酵母GS115中的表达
pPIC9KM和经测序鉴定的pPIC9KM-hIL-29mut33经SalⅠ线性化后,用电转化法分别转化毕赤酵母GS115;转化的毕赤酵母GS115涂布MD平板,挑选在MD平板上生长良好的菌落用牙签点种至含不同质量浓度G418的YPD平板,筛选出抗高质量浓度(2.0 mg/mL)的重组毕赤酵母,分别命名为GS115/9KM和GS115/hIL-29mut33。按《分子克隆实验指南》的方法提取重组GS115基因组DNA,以通用引物5’-AOX和3’-AOX进行PCR,鉴定目的基因是否整合入GS115基因组内。GS115/9KM和GS115/ hIL -29mut33的诱导表达按Multi -Copy Pichia Expression Kit(Invitrogen公司)操作手册。
1.6 rhIL-29mut33的分离纯化
诱导表达的发酵液经8 000 r/min离心10 min,收集上清液。向上清液中加入硫酸铵至30%饱和度,4℃静置过夜后离心去除部分杂蛋白质和色素。在上清液中继续加入硫酸铵至65%饱和度,4℃静置过夜,离心收集沉淀。将沉淀溶于柠檬酸-柠檬酸钠缓冲液(10 mmol/L,pH 6.0),经透析、超滤浓缩(截留相对分子质量为10 000,Millipore公司)后,加至预先用上述缓冲液平衡的SP-Sepharose Fast Flow阳离子交换柱(Φ 16 mm×200 mm),以同样缓冲液洗柱,然后以含NaCl的柠檬酸-柠檬酸钠缓冲液(10 mmol/L,0.2、0.4、0.6、0.8、1.0 mol/L NaCl,pH 6.0)进行梯度洗脱,流速1.0 mL/min,收集洗脱液。将含有rhIL-29mut33的洗脱液超滤浓缩至3 mL,加至预先用柠檬酸-柠檬酸钠缓冲液平衡的Sephadex G-75凝胶层析柱(Φ 1.6 cm×100 cm),然后同一缓冲液洗脱,流速0.4 mL/min,收集含rhIL-29mut33的组分,冷冻干燥。
1.7 rhIL-29mut33的鉴定
取少量纯化后的重组蛋白冻干粉,用适量的无菌超纯水溶解,采用SDS-PAGE对重组蛋白质进行分析及表观相对分子质量测定。以Western Blot鉴定rhIL-29mut33是否表达,经SDS-PAGE后将蛋白质电转移至NC膜上,用含10%健康兔血清的TBST缓冲液(10 mmol/L Tris-HCl,15 mmol/L NaCl,土温-20 0.05%,pH 7.2)于4℃封闭过夜,TBST清洗后用羊抗人IL-29抗体(1∶1 000)于37℃孵育2 h, TBST清洗后用HRP标记的兔抗羊IgG(1∶2 500)于37℃孵育1 h,TBST清洗后用DAB试剂显色。
1.8 rhIL-29mut33的HPLC纯度鉴定
采用美国安捷伦公司的Agilent 1100液相色谱系统,选择色谱柱:Agilent C18,300 Å,5 μL反相柱。将纯化蛋白质的冻干粉用10 mmol/L,pH 7.0的PBS溶解,调节质量浓度为2 mg/mL以上,上样量为20 μL。检测波长为260 nm,对各个吸收峰进行积分,按面积归一法计算hIL-29mut33的纯度。
1.9 rhIL-29mut33的抗肿瘤活性分析
将rhIL-29mut33、野生型rhIL-29、阳性对照IFN-α2b分别设置50、500、1 000 ng/mL 3个剂量组,同时设置空白和阴性对照组,每组设5个平行孔。取对数期生长的BEL7402、HCT8和SGC7901细胞,经体积分数0.25%胰蛋白酶消化后,用含10%小牛血清的RPMI-1640完全培养液调整细胞浓度至1×105个/mL,接种96孔细胞培养板,每孔100 μL(空白孔不接种),置37℃、体积分数5% CO2的培养箱培养24 h后,吸去上清液;取上述样品用RPMI-1640完全培养液稀释,分别按剂量组每孔加入100 μL,空白和阴性对照组加入等体积的完全培养液,置37℃、体积分数5% CO2的培养箱培养24 h后,每孔加入10 μL CCK-8试剂继续培养1 h,酶标仪测定A450,计算rhIL -29mut33对BEL7402、HCT8以及SGC7901细胞的增殖抑制率,并运用SPSS软件22.0进行统计分析,采用单因素方差分析结果,检验水准α=0.05。
IR(增殖抑制率)=1-样品组A450值/阴性对照组A450值
2 结果与讨论
2.1 hIL-29mut33基因的克隆
按照1.4中的方法进行PCR反应,经1 g/dL琼脂糖凝胶电泳检测第一轮PCR产物,在约130 bp处有一明显的条带,见图1泳道1。将目的产物回收纯化。以第一轮PCR产物为大引物,进行第二轮PCR扩增,结果显示,PCR产物在约560 bp处有一条特异性的条带,见图1泳道2。PCR产物大小与预期相符,回收产物与pUCm-T连接的重组质粒pUCm-T-hIL-29mut33,经测序鉴定的结果显示,基因大小为563 bp,编码181个氨基酸,将其序列与hIL-29的编码基因(登录号:AY336716.1)比对显示第98位碱基T突变为C。将hIL-29mut33与pPIC9KM连接得到的重组表达质粒pPIC9KM-hIL-29mut33经测序鉴定,结果表明目的基因没有发生突变,且读码框完全正确。
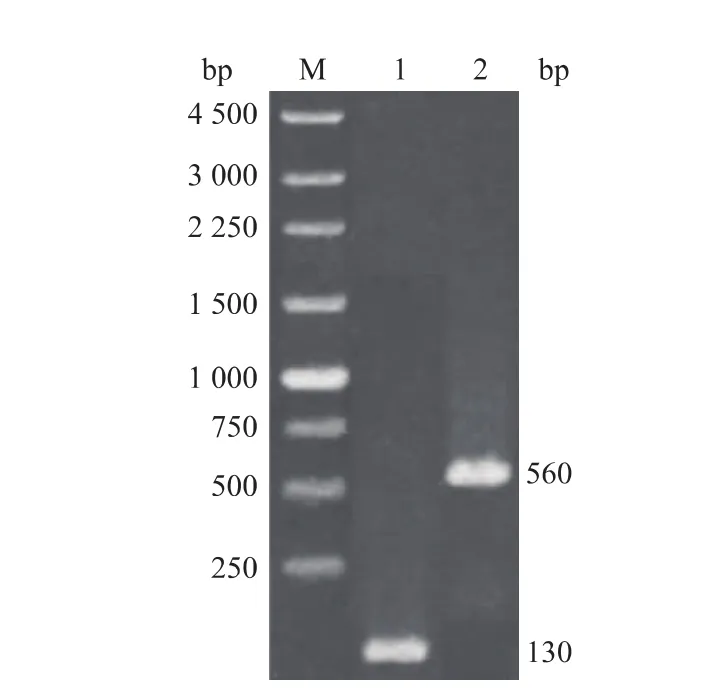
图1 hIL-29mut33的PCR扩增Fig. 1 PCR amplifications for hIL-29mut33
2.2 hIL-29mut33基因在毕赤酵母中的表达
按照1.5中的方法,将线性化的pPIC9KM-hIL-29mut33质粒电转化酵母GS115感受态细胞后,经G418筛选获得高拷贝的hIL-29mut33/GS115。将挑选的高拷贝hIL-29mut33/GS115重组子为模板,用引物5’-AOX和3’-AOX进行菌液PCR检测。结果显示,PCR反应扩增出长度约为2 100 bp和1 100 bp的产物,2 100 bp的产物为GS115本身的AOX1基因,1 100 bp的产物包括约为600 bp的目的基因(563 bp)和500 bp pPIC9KM质粒上的5’-AOX和3’-AOX引物序列之间的片段,见图2,表明hIL-29mut33基因已成功整合入酵母GS115基因组中。
2.3 rhIL-29mut33的表达和鉴定
挑取hIL-29mut33/GS115菌落常规诱导表达72 h,将发酵上清液按1.6中的方法经盐析、透析、超滤、SP-Sepharose Fast Flow阳离子交换层析和Sephadex G-75凝胶层析纯化的产物,经SDSPAGE分析表明,在约22 600处可见明显的单一目的蛋白质条带,见图3泳道3,而GS115/9KM的发酵液在该处并无相同条带,见图3泳道1。SDS-PAGE结果显示,rhIL-29mut33的表观相对分子质量高于理论计算相对分子质量(20018.0),这可能由于rhIL-29mut33在酵母GS115表达过程中发生了糖基化修饰[9]。用在线软件NetNGlyc 1.0(http://www.cbs.dtu. dk/services/NetNGlyc/)和NetOGlyc 4.0(http://www. cbs.dtu.dk/services/NetOGlyc/)分别对N和O糖基化位点进行预测,结果表明hIL-29mut33氨基酸序列中含有1个N-糖基化位点和8个O-糖基化位点。
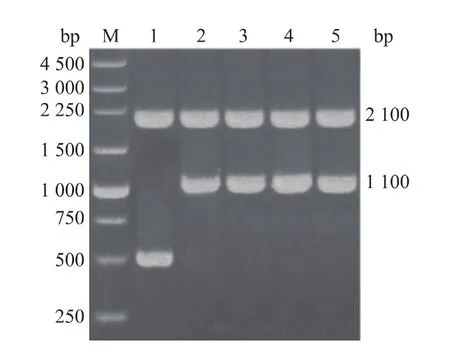
图2 重组毕赤酵母hIL-29mut33/GS115的PCR检测Fig. 2 PCR detections of recombinant P.pastoris hIL -29mut33/GS115
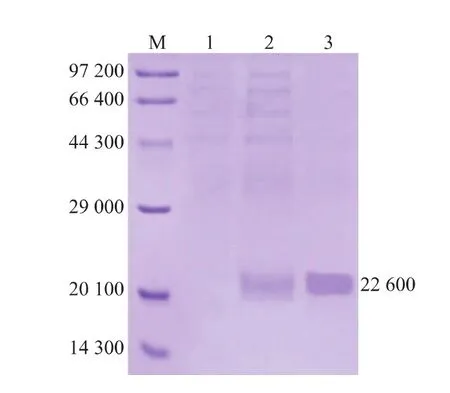
图3 表达产物的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of expressed products
hIL-29mut33/GS115的发酵上清液经Western Blot分析,结果显示,重组表达的rhIL-29mut33与羊抗人IL-29抗体反应后在NC膜上呈现特异性反应条带,其大小约为22 600,见图4,与SDS-PAGE中的条带大小相符,但反应条带略有弥散,这可能是Western Blot的放大效应所致。

图4 rhIL-29mut33的Western Blot鉴定Fig. 4 Western Blotof rhIL-29mut33
2.4 rhIL-29mut33的HPLC纯度鉴定
采用C18反相柱,在HPLC系统上检测纯化后rhIL-29mut33的纯度。流动相为:10%乙腈和0.5%三氟乙酸;洗脱条件为:0~10 min,10%~30%的乙腈和0.5%三氟乙酸;10~20 min,30%~70%的乙腈和0.5%的三氟乙酸。经过面积归一法计算,rhIL-29mut33的纯度为95.13%,可以用于体外细胞活性的检测。
2.5 rhIL-29mut33的抗肿瘤活性分析
按照1.9中的方法,rhIL-29mut33对BEL7402、HCT8和SGC7901三株肿瘤细胞的增殖抑制分析结果表明,各剂量组均显示增殖抑制效应,随着rhIL-29mut33浓度的增加,细胞增殖抑制率均随之增加,呈现浓度-效应依赖关系,见表1。统计分析均采用SPSS软件22.0,符合方差齐性和正态分布的数据,进一步做单因素方差分析;p<0.05记作*,表示显著性差异;p<0.01记作**,表示极显著差异。
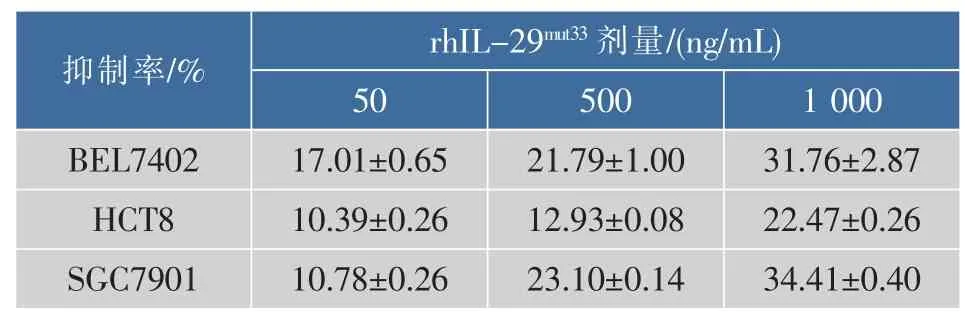
表1 rhIL-29mut33对不同肿瘤细胞株的抑制作用Table 1 Inhibition effects of rhIL -29mut33on different tumor cell lines
统计分析结果显示,rhIL-29mut33、野生型rhIL-29及商品化的IFN-α2b对3株肿瘤细胞增殖的抑制效应略有差异,rhIL-29mut33在低、中、高剂量组对BEL7402细胞抑制作用均强于野生型rhIL-29及IFN-α2b,其高剂量组的抑制率达到(31.76± 2.87)%,见图5,极显著地抑制了BEL7402细胞的增殖。
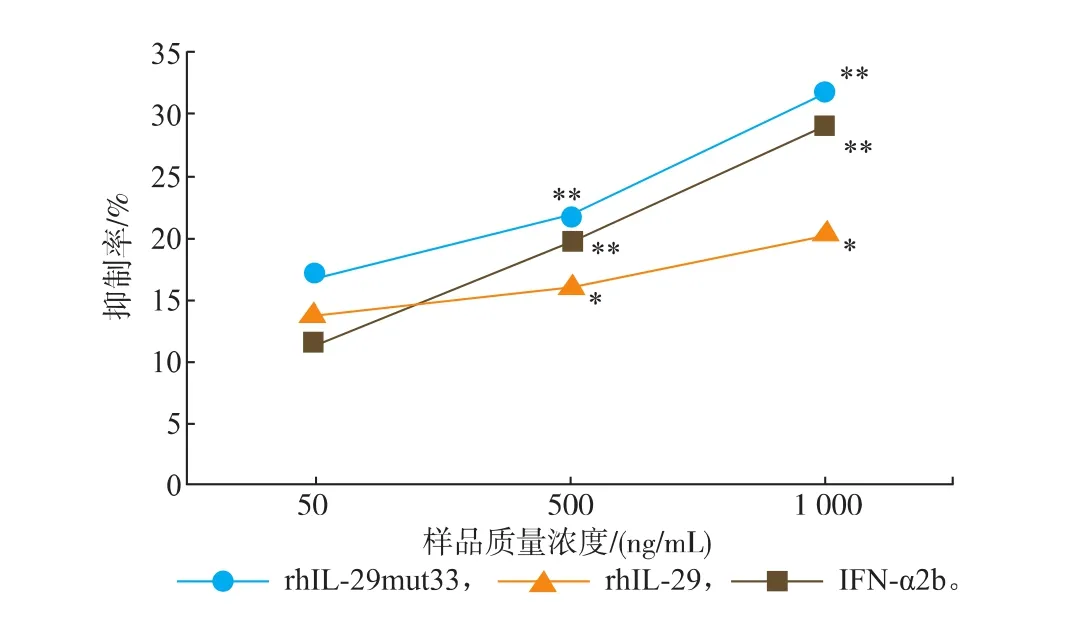
图5 rhIL-29mut33对BEL7402细胞的抗增殖活性分析Fig. 5 Antiproliterative activities analysis of rhIL-29mut33in BEL7402 cells
高剂量组的rhIL-29mut33、rhIL-29及IFN-α2b 对HCT8细胞的增殖抑制率分别为(22.47±0.26)%、(20.38±1.23)%和(27.16±1.22)%,表明rhIL-29mut33、rhIL-29对HCT8细胞的抑制效应低于IFN-α2b,而rhIL-29mut33和rhIL-29对HCT8细胞增殖的抑制效应差异不大,见图6。
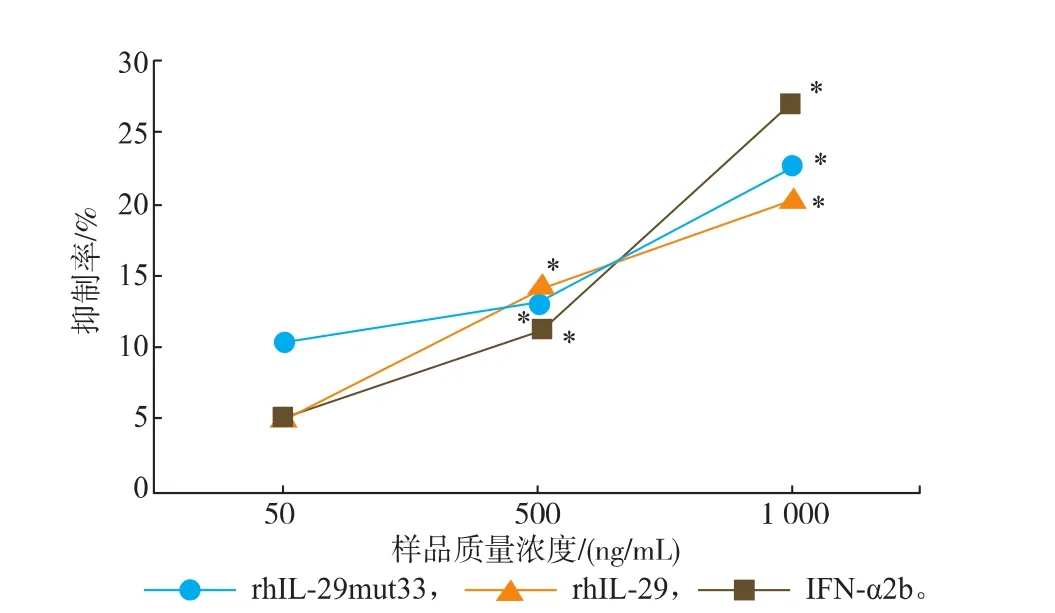
图6 rhIL-29mut33对HCT8细胞的抗增殖活性分析Fig. 6 Antiproliterative activities analysis of rhIL-29mut33in HCT8 cells
对SGC7901细胞的增殖抑制分析结果显示,rhIL-29mut33表现出良好的细胞增殖抑制能力,rhIL-29mut33、rhIL-29及IFN-α2b的高剂量组对该细胞的增殖抑制率分别为(34.41±0.40)%、(29.09±1.76)%和(27.74±1.25)%,见图7。三者均表现出显著的增殖抑制效应,但rhIL-29mut33的抑制作用更强,极显著地抑制了SGC7901细胞的增殖。
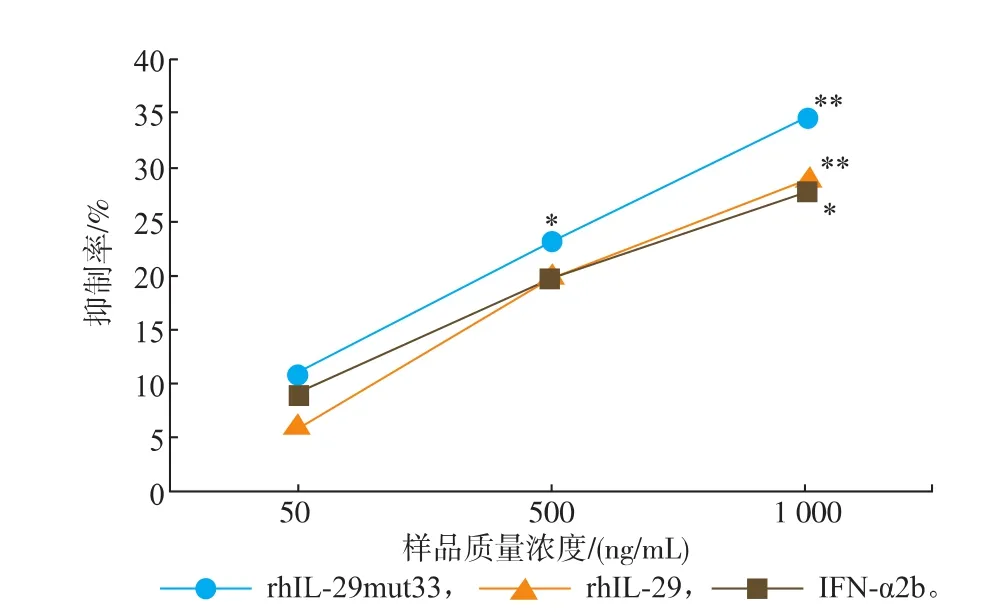
图7 rhIL-29mut33对SGC7901细胞的抗增殖活性分析Fig. 7 Antiproliterative activities analysis of rhIL-29mut33in SGC7901 cells
分析结果表明,不同剂量组的变异体rhIL-29mut33对这3种肿瘤细胞的增殖均有抑制作用,且随着药物质量浓度的增加,增殖抑制率也随之增加。对于HCT8细胞,rhIL-29mut33的抑制作用强于野生型rhIL-29,但弱于商品化的IFN-α2b;而对于BEL7402和SGC7901细胞,rhIL-29mut33的抑制作用强于野生型rhIL-29和商品化IFN-α2b,表现出极显著的抗肿瘤细胞增殖效应。
3 结语
近年来,随着对hIL-29生物学活性的研究日益广泛和深入,hIL-29由于具有与IFN-α相似的抗病毒和抗肿瘤活性以及细胞靶向性而引起越来越多研究者的关注。已有研究表明,hIL-29的突变可以影响它的抗病毒和抗肿瘤活性,而且很多突变被假设且与受体联系起来[13]。作者在前期研究的基础上,结合生物信息学分析,采用定点突变方法对hIL-29 的A、F螺旋中4个关键氨基酸位点之一的Lys33进行分子改造,以改变hIL-29与受体结合的亲和性,从而提高其生物学活性。
作者采用定点突变和大引物PCR技术成功克隆出hIL-29mut33的编码基因并在毕赤酵母GS115中实现了异源表达,获得的rhIL-29mut33表现出良好的抗增殖活性。对于BEL7402、HCT8和SGC7901这3种肿瘤细胞,不同剂量的rhIL-29mut33均具有抗肿瘤细胞增殖效应,而且对肿瘤细胞增殖抑制作用均强于野生型rhIL-29。同时随着药物质量浓度的增加,细胞增殖抑制率均随之增加。高剂量的rhIL-29mut33对细胞增殖抑制作用最强,对上述3种细胞的细胞抑制率分别达到(31.76±2.87)%、(22.47±0.26)%和(34.41±0.40)%。本研究成果为hIL-29分子改造的深入研究奠定了理论和实验基础,也为后续研制高效的干扰素抗肿瘤药物提供参考。
参考文献:
[ 1 ] Sheppard P,Kindsvogel W,Xu W,et al. IL-28,IL-29 and their classⅡcytokine receptor IL-28R [J]. Nature Immunology,2003,4(1):63-68.
[ 2 ] Kotenko SV,Gallagber G,Baurin W,et al. IFN-λs mediate antiviral protection through a distinct classⅡcytokine receptor complex[J]. Nature Immunology,2003,4(1):69-77.
[ 3 ] Zhou Z,Hamming OJ,Ank N,et al. Type III interferon(IFN)induces a type I IFN-like response in a restricted subset of cells through signaling pathways involving both the Jak-STAT pathway and the mitogen-activated protein kinases [J]. Virology,2007,81(14):7749-7758.
[ 4 ] Witte K,Gruetz G,Volk HD,et al. Despite IFN-lambda receptor expression,blood immune cells,but not keratinocytes or melanocytes,have an impaired response to type III interferons:implica- tions for therapeutic applications of these cytokines[J]. Genesandimmunity,2009,10(8):702-714.
[ 5 ] Meager A,Visvalingam K,Dilger P,et al. Biological activity of interleukins-28 and -29:comparison with type I interferons[J]. Cytokine,2005,31(2):109-118.
[ 6 ] Zitzmann K,Brand S,Baehs S,et al. Novel interferon-lambdas induce antiproliferative effects in neuroendocrine tumor cells[J]. Biochemical and Biophysical Research Communications,2006,344(4):1334-1341.
[ 7 ] Doyle SE,Schreckhise H,Khuu-Duong K,et al. Interleukin-29 uses a type 1 interferon-like program to promote antiviral responses in human hepatocytes[J]. Hepatology,2006,44(4):896-906.
[ 8 ] Li Q,Kawamura K,Ma G,et al. Interferon- lambda induces G1 phase arrest or apoptosis in oesophageal carcinoma cells and produces anti-tumour effects in combination with anti-cancer agents[J]. European Journal of Cancer,2010,46(1):180-190.
[ 9 ] Zachary JM,Eugenia M,Wei L,et al. Crystal structure of human interferon-λ1 incomplex with its high-affinity receptor interferon-λR1[J]. Journal of Molecular Biology,2010,404(4):650-664.
[10]郑海军,朱荣,葛春蕾,等.人白细胞介素-29的生物信息学分析[J].中国生物制品学杂志,2013,26(2):209-212. ZHENG Haijun,ZHU Rong,GE Chunlei,et al. Bioinformatics of human interleukin-29 [J]. Chinese Journal of Biologicals,2013,26(2):209-212.(in Chinese)
[11]陈伟,于明磊,郑海军,等.人白细胞介素-29基因的克隆和真核表达[J].中国生物制品学杂志,2012,25(4):446-448. CHEN Wei,YU Minglei,ZHENG Haijun,et al. Cloning and eukaryotic expression of human interleukin-29 gene [J]. Chinese Journal of Biologicals,2012,25(4):446-448.(in Chinese)
[12]郑海军,陆源,陈伟,等.天然N-末端人白细胞介素-29成熟肽在毕赤酵母中表达条件的优化[J].中国生物制品学杂志,2013,26(3):402-405. ZHENG Haijun,LU Yuan,CHEN Wei,et al. Optimization of condition for expression of native N-terminus of human interleukin-29 mature peptide in Pichia pastoris[J]. Chinese Journal of Biologicals,2013,26(3):402-405.(in Chinese)
[13] Gad H H,Dellgren C,Hamming O J,Vends S,et al. Interferon- {lambda} is functionally an interferon but structurally related to the interleukin-10 family[J]. Biological Chemistry,2009,284(31):20869-20875.
Expression of Recombinant Human Interleukin-29 Mutant in Pichia pastoris and Antitumor Analysis
LU Yuan1,CHEN Wei*2,LI Liyun3,PENG Ronggang2,LI Fei2,WU Minchen2
(1. School of Medicine Science,Jiangnan University,Wuxi 214122,China;2. Wuxi Medical School,Jiangnan University,Wuxi 214122,China;3. School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Abstract:Based on results of the bioinformatics analysis,a mutant of recombinant human interleukin 29(rhIL-29mut33)was constructed by site-directed mutagenesis and megaprimer PCR. Then,it was successfully expressed in Pichiapastoris GS115. The rhIL-29mut33showed strong anti-proliferation effects on liver cancer cell BEL7402,colon cancer cell HCT8,and gastric cancer cell SGC7901 at different concentrations,and all of them showed stronger than that of wild type rhIL-29. At a high concentration of the rhIL-29mut33,the inhibition ratios of the three tumor cells were (31.76±2.87)%,(22.47±0.26)%,and(34.41±0.40)%,respectively. The superior biological activities of rhIL-29mut33,especially the antitumor activity,make it have great potential applications in the drug industry.
Keywords:human interleukin-29,site-directed mutation,gene cloning,expression,antineoplastic activity
*通信作者:陈伟(1956—),男,江西宜丰人,医学博士,副教授,硕士研究生导师,主要从事免疫学和生物制药方面的研究。E-mail:chenwei@jiangnan.edu.cn
基金项目:国家大学生创新训练计划项目(201210295024)。
收稿日期:2014-07-07
中图分类号:Q 78
文献标志码:A
文章编号:1673—1689(2016)02—0185—07
