HPLC- Q- TOF- MS分析植物凉茶中的化学成分
2016-05-18游飞祥韩彦琪龚苏晓张铁军陈常青天津中医药大学天津30093天津药物研究院天津30093
游飞祥,韩彦琪,龚苏晓,张铁军,*,陈常青,*(.天津中医药大学,天津30093;.天津药物研究院,天津30093)
HPLC- Q- TOF- MS分析植物凉茶中的化学成分
游飞祥1,韩彦琪2,龚苏晓2,张铁军2,*,陈常青2,*
(1.天津中医药大学,天津300193;2.天津药物研究院,天津300193)
摘要:运用高效液相色谱-四极杆-飞行时间质谱联用技术(HPLC-Q-TOF-MS),对植物凉茶中的化学成分进行分析鉴定。样品经甲醇超声提取,采用Diamonsil C18色谱柱分离,以乙腈-0.1 %甲酸/水为流动相进行梯度洗脱,采用电喷雾离子源,正负离子模式进行高分辨四极杆飞行时间质谱定性分析,色谱峰获得了良好的分离与检测。通过二级质谱分析结合对照品数据及相关文献,共鉴定出43个化合物,主要包括有机酸类和黄酮苷类等成分,并对其来源进行了归属。结果表明,HPLC-Q-TOF-MS技术能够比较全面地检测植物凉茶中的化学组成,所建立的方法简单、快速、可靠,为其质量控制与功能因子研究奠定了基础。
关键词:植物凉茶;化学成分;鉴别;HPLC-Q-TOF-MS
凉茶是以中医养生为指导,药食同源植物为原料,研制的具有清热解毒、生津止渴等功效的植物饮料[1]。近年来,随着人民生活水平的提高,越来越多的人开始关注保健和养生,我国凉茶迅速崛起成为现代化茶饮,凉茶的概念范围已经扩大,已成为一种大众饮料。本植物凉茶是自主研制的一款健康保健饮品,由金银花、蒲公英、决明子、菊花、香薷5种药食同源的天然植物原料组成,具有清热解毒、消炎抑菌、润喉止咳等作用,由于该凉茶是采用多种植物原料配制而成,成分复杂,涵盖了不同极性、多个种类的化合物,分析和鉴定其中的化学成分成为阐明其功能因子的关键。本文采用HPLC-Q-TOF-MS技术对植物凉茶进行化学成分分析和色谱峰来源归属研究,明确了其化学物质基础,为植物凉茶质量控制和功能因子研究提供了有力参考。
1 材料与仪器
植物凉茶:天津药物研究院中药现代研究部自制;金银花、蒲公英、决明子、菊花、香薷饮片:均购于天津市南开区协和药店;绿原酸、木犀草苷、金丝桃苷、芦丁、迷迭香酸标准品:均购于中国药品生物制品检定所,纯度均大于98.0 %;甲醇、乙腈(色谱纯):美国Merck公司;甲酸(色谱纯):美国Fisher公司;纯净水:杭州娃哈哈集团有限公司;其他试剂均为分析纯。
Dionex Summit高效液相色谱仪:美国戴安公司;micrOTOF飞行时间质谱仪:德国Bruker公司;Diamonsil C18(250 mm×4.6 μm,5 μm)色谱柱:美国Welch公司;AB204-N电子天平:德国METELER公司;超声波清洗仪:宁波新芝生物科技;R501B星海旋转蒸发仪:无锡市星海王生化设备有限公司;PTHW恒温加热套:巩义市予华仪器有限公司。
2 方法
2.1色谱条件
色谱柱为Diamonsil C18(250 mm×4.6 μm,5 μm);流动相A为乙腈,流动相B为0.1 %甲酸溶液,梯度洗脱程序:0~15 min(2 %~10 % A),15 min~75 min(10 %~40 % A);流速1.0 mL/min;柱温30℃;检测波长290 nm;进样量20 μL。
2.2质谱条件
Bruker高性能电喷雾-四级杆-飞行时间串联质谱仪(micrOTOF-Q II);电喷雾离子源(ESI);采用正、负两种离子化模式检测;干燥气的体积流量6 L/min,干燥气温度180℃,雾化气压0.8 Bar。正离子模式下,毛细管电压4 500 V,负离子模式下的毛细管电压2 600 V,碎裂电压200 V,扫描范围m/z 50~1 500。
2.3对照品溶液的制备
精密称取绿原酸、木犀草苷、金丝桃苷、芦丁、迷迭香酸标准品各5 mg,用适量甲醇溶解后,移至10 mL量瓶中,加甲醇至刻度,摇匀,即得混标溶液,于4℃冰箱中储存,进样前过0.22 μm微孔滤膜。
2.4供试品溶液的制备
凉茶供试品溶液的制备:取本品饮料75 mL,蒸干,加适量甲醇溶解,置于10 mL量瓶中,超声20 min,冷却至室温,加甲醇至刻度,摇匀,用0.22 μm的微孔滤膜过滤,取续滤液即得凉茶供试品溶液。
原料供试品溶液的制备:取配方中各原料适量,加水回流提取1 h,滤过,取各植物提取液适量,按凉茶供试品制备方法制得金银花、蒲公英、决明子、菊花、香薷供试品溶液。
3 结果与分析
本研究采用HPLC-Q-TOF-MS在2.1和2.2条件下对凉茶及原料供试品溶液进行分析,结果如图1、图2所示。
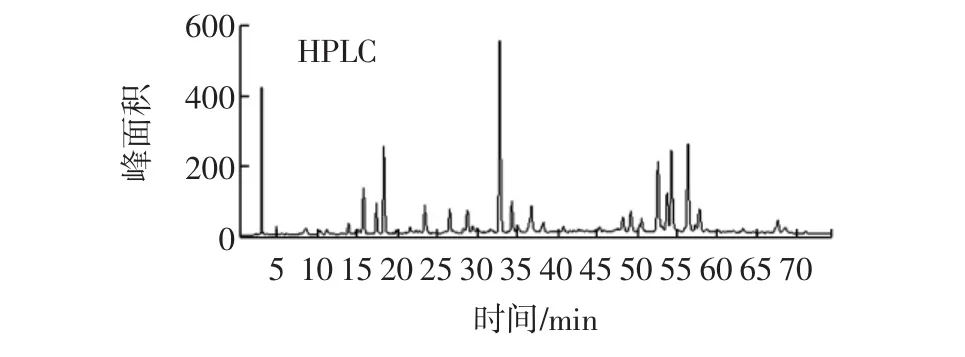
图1 植物凉茶HPLC色谱图Fig.1 HPLC of herbal tea

图2 植物凉茶HPLC-Q-TOF -MS正离子(A)、负离子(B)模式基峰离子色谱图(BPI)Fig.2 HPLC-Q-TOF-MS Base peak ion chromatograms(BPI)in positive ion(A)and negative ion(B)mode of herbal tea
色谱峰获得了良好的分离与检测。通过分析正、负模式下的一级高分辨率质谱图,确定了全方各色谱峰的分子离子峰,得到化合物精确分子量,并由此推断化合物的可能分子式,然后,通过进一步分析二级质谱数据,同时结合色谱保留时间、对照品信息和相关文献[2-21]完成化合物的鉴定。利用该方法共鉴定和归属了凉茶中的43个化学成分,主要包括14个机酸类、13个黄酮苷类成分,以及环烯醚萜类、蒽醌类等成分12个。
3.1色谱峰的归属分析
首先,通过保留时间比对初步识别色谱峰的来源,再通过比较各原料和凉茶在该时间点的质谱图进一步确认该色谱峰的归属。结果显示,43个色谱峰中,有23个峰来源于金银花(峰1~峰4、峰7~峰11、峰14~峰22、峰25~峰29、峰31)、14个峰来源于蒲公英(峰4、峰5、峰7~峰9、峰18、峰19、峰21、峰22、峰26、峰29~峰31、峰42)、8个峰来源于决明子(峰4、峰7、峰22、峰34、峰37、峰38、峰40、峰41)、22个峰来源于菊花(峰4、峰7~峰9、峰12、峰13、峰18~峰22、峰25~峰32、峰35~峰37、峰42、峰43)、11个峰来源于香薷(峰2、峰3、峰6、峰11~峰13、峰18、峰21~峰24、峰33、峰39、峰42)。由上述统计发现,尽管植物凉茶组方中各原料量相差不多,但对于凉茶的化学贡献却明显不同,其中贡献最大的是金银花和菊花,其次依次为蒲公英、香薷、决明子,且金银花、菊花和蒲公英存在共有峰,说明本饮料中有些化学成分是金银花、菊花和蒲公英的共有成分。
3.2色谱峰的鉴定与结构解析
3.2.1咖啡酰奎宁酸类化合物的鉴别
咖啡酰奎宁酸类化合物是一类由奎宁酸和不同数目的咖啡酸通过酯化反应缩合而成的酚酸类化合物,分子中羧基及酚羟基易形成稳定的氧负离子,故在负离子检测模式下质谱信息量大。色谱峰4,7,8,9的分子离子峰[M-H]-均为m/z 353,在二级质谱中多存在m/z 191 [M-H-caffeoyl]-,179 [caffeic acid-H]-,173 [M-H-caffeoyl-H2O]-和161 [caffeic acid-H-H2O]-特征离子,符合单咖啡酰基奎宁酸的裂解规律[2],其中8号峰通过标准品比对确定为绿原酸(3-O-咖啡酰奎宁酸),另外的4、7、9号峰中,只有峰9的MS2基峰为m/z 173,结合文献[3],4-O-咖啡酰奎宁酸的MS2基峰为m/z 173,而5-O-咖啡酰奎宁酸、3-O-咖啡酰奎宁酸的MS2基峰为m/z 191,初步判断9号峰为4-O-咖啡酰奎宁酸;又根据文献[4]报道,5-O-咖啡酰奎宁酸一般只能检出m/z 191碎片离子,m/z 179、135等碎片离子极少,推测7号峰为5-O-咖啡酰奎宁酸,同时结合文献[5-6]报道的出峰顺序:1-CQA﹥5-CQA﹥3-CQA> 4-CQA,确定4、7、8、9号峰分别为1-O-咖啡酰奎宁酸,5-O-咖啡酰奎宁酸,3-O-咖啡酰奎宁酸,4-O-咖啡酰奎宁酸。
色谱峰25、26、27、28、29、31的分子离子峰[M-H]-均为m/z 515,,二级质谱碎片主要为m/z 353,以及单咖啡酰基奎宁酸的特征离子m/z 191、179、173、161、135等,故推测为二咖啡酰基奎宁酸,其中只有26和31号峰存在m/z 173碎片离子,结合文献[7],3,4-二咖啡酰奎宁酸和4,5-二咖啡酰奎宁酸存在m/z 173的二级碎片,同时根据Lin等[8]对6种二咖啡酰基奎宁酸类化合物的研究发现:不含1位取代的二咖啡酰基奎宁酸其出峰顺序为3,4-二咖啡酰基奎宁酸(3,4-DCQA)>3,5-DCQA﹥4,5-DCQA,可以确定色谱峰26为3,4-二咖啡酰奎宁酸,色谱峰31为4,5-二咖啡酰奎宁酸。但是峰25,27,28,29具有相似的碎片信息,不易区分,参考文献[9-10],初步判断色谱峰25,27,28,29分别为1,3-二咖啡酰基奎宁酸,1,4-二咖啡酰基奎宁酸,1,5-二咖啡酰基奎宁酸,3,5-二咖啡酰基奎宁酸,这一推测有待结合核磁数据或标准品比对进一步确定。
3.2.2黄酮苷类化合物的鉴别
黄酮苷类化合物极性相对较大,负离子模式下峰响应优于正离子模式,其裂解特征以苷键的断裂、糖-糖键的断裂和糖环的交叉环切除为主,糖链顺次丢失糖配基最终生成苷元离子[11]。本文通过分析化合物丢失碎片离子的质量数,推测凉茶供试品中的黄酮苷类化合物主要是单糖苷和双糖苷,其中双糖苷糖基有:六碳糖基-六碳糖苷(162u+162u)如峰19,六碳糖基-甲基五碳糖苷(162u+146u)如芸香糖,峰12和35;单糖苷有:六碳糖醛酸苷(176u)如峰24和39,六碳糖苷(162u)如峰20,21,22,23,30,32,37。分析发现双糖苷在较低的裂解电压下,二级质谱中基峰多为[M-H-162]-或[M+H-162]+,并有脱鼠李糖峰[M-H-146]-或[M+ H-146]+;在较高的裂解电压下,再脱去一分子葡萄糖,二级质谱中基峰多为[M-H-162-162]-或[M-H-162-146]-,并且在脱糖前及脱糖后均出现一系列连续脱水的小峰,苷元碎片的质荷比多为m/z 317、301、333、315。
对黄酮苷元离子进行分析,发现凉茶中主要有4种黄酮糖苷配基,木犀草素,其特征碎片离子为m/z 287,如峰12和22;芹菜素,其特征碎片离子为m/z 271,如峰13、19、30和42;香叶木素,其特征碎片离子为m/z 301,如峰32、39和43;金合欢素,其特征碎片离子为m/z 283,如峰35和37。
以峰20和32为例,色谱峰20的分子离子峰为449[M-H]-,以其作为母离子进行二级质谱分析,所得谱图中有明显的287[M-H-162]-碎片离子信息,这一裂解途径符合黄酮苷的裂解规律,碎片离子与文献[12]报道的圣草酚-7-O-葡萄糖苷一致,因此推断20号峰为圣草酚-7-O-葡萄糖苷;色谱峰32的分子离子峰463[M+H]+,以其作为母离子进行二级质谱分析,所得谱图中有明显的301,286[M+H-176]+,258[M+H-176-28]+碎片离子信息,这与文献[2]报道的香叶木素-7-O-葡糖苷酸的裂解碎片相同,因此推断32号峰为香叶木素-7-O-葡糖苷酸。
3.2.3环烯醚萜苷类化合物的鉴别
文献[13-14]总结了环烯醚萜苷类化合物的质谱裂解规律:该类化合物在正离子模式下的质谱图中,[M+Na]+峰丰度较大,糖苷键易断裂生成[M+Na-Glc]+或[M+HGlc]+碎片离子,苷元易再次通过RDA裂解产生碎片[M+Na-Glc-70]+或[M+H-Glc-70]+。以峰14和16为例,色谱峰14中m/z 427为[M+Na]+峰,m/z 265为[M+Na-Glc]+峰,m/z 195为[M+Na-Glc-70]+峰,其它碎片离子有223、179、165、121,这一裂解途径与环烯醚苷类的质谱裂解规律一致,结合文献[15]判断色谱峰14为secoxyloganin。同样,色谱峰16质谱图中碎片离子m/z 781[M+ Na]+,m/z 587 [M+Na-Glc-CH3OH]+,m/z 549 [M+Na-Glc-70]+,m/z 387[M+Na-Glc-70-Glc]+也符合上述质谱裂解规律,根据文献[5],确定色谱峰16为centauroside。
3.2.4蒽醌类化合物的鉴别
蒽醌类化合物分子的共轭体系结构决定了其分子较稳定,二级质谱碎片较少,碎片易归属,文献[16]表明,失去母核基团中的CH3或CO但留存共轭体系是主要裂解方式。以峰34和41为例,色谱峰34分子离子峰为491 [M-H]-,主要碎片离子有m/z 476 [M-HCH3]-和m/z 461M-H-2CH3]-,与文献[17]报道一致,故推断色谱峰34为橙黄决明醌苷;色谱峰41分子离子峰为331[M+H]+,主要碎片离子有m/z 315[M+H-CH3]+和m/z 297[M+H-CH3-H2O]+,这与文献[18]报道一致,故推断色谱峰41为橙黄决明素。
植物凉茶中化学成分的HPLC-Q-TOF-MS鉴别分析结果,见表1。

表1 植物凉茶中化学成分的HPLC-Q-TOF-MS鉴别分析结果Table 1 Qualitative analysis results of chemical components in herbal tea by HPLC-Q-TOF-MS
4 结论
高效液相色谱-四极杆-飞行时间质谱联用技术(HPLC-Q-TOF-MS)具有高分离度、高速度、高灵敏度等特点,是一种快速区分和鉴定凉茶多组分、复杂成分的有效方法,通过HPLC可将其分离,在一级质谱中可确定其分子量,再通过二级质谱得到各化合物的不同碎片信息,结合在HPLC中其保留时间信息并与文献或标准品对照从而确定化合物的结构。本文通过HPLC-Q-TOF-MS技术,对植物凉茶中的成分进行了全面分析,通过色谱分离、质谱鉴定共鉴别了5种药食同源植物配方中的43个化学成分,明确了其化学物质基础,主要为有机酸及黄酮苷类成分,并对其药材来源进行了归属,为植物凉茶质量控制和功能因子研究提供了一定的理论参考。
参考文献:
[1]王萍,肖更生,张友胜,等.广式凉茶研究进展[J].食品科技,2010(2): 77-80
[2]张维冰,王智聪,张凌怡.超高效液相色谱-二极管阵列检测-串联质谱法测定菊花中的10种咖啡酰基奎宁酸和22种黄酮类化合物[J].分析化学,2013,41(12):1851-1861
[3]张倩,张加余,隋丞琳,等. HPLC-DAD-ESI-MS/MS研究金银花水提工艺中绿原酸类成分的变化规律[J].中国中药杂志,2012,37 (23): 3564-3568
[4] Clifford M N, Johnston K L, Knight S, et al.Hierarchical scheme for LC-MSn identification of chlorogenic acids[J].Journal of Agricultural and Food Chemistry,2003,51(10): 2900-2911
[5]白雪,黄惠锋,吴修红,等.HPLC-DAD-MS/MS法分析金银花中化学成分[J].食品与药品,2015,17(1): 5-8
[6] Qi L, Chen C, Li P. Structural characterization and identification of iridoid glycosides, saponins, phenolic acids and flavonoids in Flos Lonicerae Japonicae by a fast liquid chromatography method with diode -array detection and time -of -flight mass spectrometry [J]. Rapid Commun Mass Spectrom, 2009,23(19):3227-3242
[7] Lin L Z, Harnly J M. Identification of the phenolic components of chrysanthemum flower (Chrysanthemum morifolium Ramat)[J].Food Chemistry,2010,120(1): 319-326
[8] Lin L Z, Harnly J M. Identification of hydroxycinnamoylquinic acids of arnica flowers and burdock roots using a standardized LC-DADESI/MS profiling method[J]. Journal of agricultural and food chemistry,2008,56(21): 10105-10114
[9] Gouveia S C,Castilho P C.Validation of a HPLC-DAD–ESI/MSn method for caffeoylquinic acids separation, quantification and identification in medicinal Helichrysum species from Macaronesia [J]. Food Research International, 2012, 45(1):362-368
[10] Wang S. Study on the effects of sulfur fumigation on chemical constituents and antioxidant activity of Chrysanthemum morifolium cv. Hang-ju.[J].Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2014, 21(5):773-779
[11]阿布拉江·克依木.黄酮苷类天然产物的质谱分析方法研究[D].北京:中国协和医科大学,2006
[12] Wang S,Hao L J,Zhu J J,et al. Comparative Evaluation of Chrysanthemum Flos from Different Origins by HPLC-DAD-MSn and Relative Response Factors[J].Food Analytical Methods,2015, 8(1):40-51
[13]张丽媛,李遇伯,李利新,等. RRLC-Q-TOF/MS分析金银花的化学成分[J].中南药学, 2012, 10(3): 204-208
[14] Suryawanshi S, Mehrotra N, Asthana R K, et al. Liquid chromatography/tandem mass spectrometric study and analysis of xanthone and secoiridoid glycoside composition of Swertia chirata, a potent antidiabetic[J]. Rapid communications in mass spectrometry, 2006, 20(24): 3761-3768
[15] Li X Q, Sun X H, Cai S, et al. Investigation on the chemical constituents and variation of the flower buds of Lonicera species by UPLC-ESI-MS/MS and principle component analysis[J]. Acta Pharm Sin, 2009, 44: 895
[16]马小红,沈少林,韩凤梅,等.大黄蒽醌类化合物电喷雾质谱研究[J].湖北大学学报:自然科学版, 2006, 28(4):403-406
[17] Zhang W, Wang Y, Wang Q, et al. Quality evaluation of Semen Cassiae (Cassia obtusifolia L.) by using ultra-high performance liquid chromatography coupled with mass spectrometry[J]. Journal of Separation Science, 2012, 35(16):2054-2062
[18]郝晓霞,靳元鹏,轧霁,等. HPLC-DAD-MS/MS用于养血清脑颗粒蒽醌类成分分析[J].中成药, 2012, 34(1):66-70
[19]黄彬弟.细皱香薷化学成分的研究[D].甘肃:西北师范大学, 2004
[20]张尊建,余静,杨春华,等.忍冬,山银花HPLC/UV/MS指纹图谱研究[J].中成药, 2004, 25(11): 863-865
[21] Schütz K, Kammerer D R, Carle R, et al. Characterization of phenolic acids and flavonoids in dandelion (Taraxacum officinale WEB. ex WIGG.) root and herb by high-performance liquid chromatography/ electrospray ionization mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2005, 19(2): 179-186
Analysis of Chemical Constituents in Herbal Tea Based on HPLC-Q-TOF-MS
YOU Fei-xiang1,HAN Yan-qi2,GONG Su-xiao2,ZHANG Tie-jun2,*,CHEN Chang-qing2,*
(1.Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2. Tianjin Institute of Pharmaceutical Research,Tianjin 300193,China)
Abstract:To analyze and identify the chemical constituents in herbal tea by HPLC-Q-TOF-MS. The samples were extracted with methanol,separated by the Diamonsil C18 column with a gradient elution of acetonitrilewater containing 0.1 % formic acid. Positive and negative ion mode electrospray ionization and high-resolution quadrupole time of flight mass spectrometry was employed for qualitative analysis. Based on the MS/MS analysis,comparing references and relevant literature dates,forty-three compounds of herbal tea were identified,mainly including organic acids and flavonoids. Furthermore,all of the constituents were surveyed and classified according to their medicinal materials derivation. The results showed that HPLC-Q-TOF-MS could elucidate the main components in herbal tea in a more comprehensive way and the method established was simple,fast and reliable,which laid the foundation for quality control and functional components studies.
Key words:herbal tea;chemical constituents;identification;HPLC-Q-TOF-MS
收稿日期:2015-12-23
*通信作者
作者简介:游飞祥(1991—),男(汉),硕士研究生,主要从事中药质量和复方制剂研究。
DOI:10.3969/j.issn.1005-6521.2016.08.039
