酪蛋白酶解产物的结构特征研究
2016-05-18柳甜甜王金水高芸芳李晓伟周晓配贾峰河南工业大学生物工程学院河南郑州45000河南工业大学粮油食品学院河南郑州45000
柳甜甜,王金水,*,高芸芳,李晓伟,周晓配,贾峰(.河南工业大学生物工程学院,河南郑州45000;.河南工业大学粮油食品学院,河南郑州45000)
酪蛋白酶解产物的结构特征研究
柳甜甜1,王金水1,*,高芸芳1,李晓伟2,周晓配1,贾峰1
(1.河南工业大学生物工程学院,河南郑州450001;2.河南工业大学粮油食品学院,河南郑州450001)
摘要:用超声波对酪蛋白进行预处理之后,利用胰蛋白酶对其进行酶解,检测酶解后产物的表面特征、粒度分布及二级结构等指标,探讨酪蛋白酶解产物的结构特征变化特征。结果表明:用超声波辅助处理后,酪蛋白酶解液的酶解产物与未采用超声波辅助处理的结果相比,产物的粒度更小且分布均匀,酪蛋白表面的孔洞化和层片化更快,随着酶解时间的延长,酪蛋白酶解产物颗粒的粒度变小,分子量分布更加均匀;酪蛋白酶解产物中β-转角和无规则卷曲减少,而β-转角的含量增加。结果表明超声波辅助处理对酶解酪蛋白有很好的促进的作用。
关键词:酪蛋白;酶解产物;二级结构;超声波;傅里叶红外光谱(FTIR)
酪蛋白(casein,CN)是牛乳中的主要蛋白质,分子质量大约为20 kDa~25 kDa,呈酸性,由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白等四类组分组成[1],是一类含磷的蛋白质[2],能够协助参与核酸、三磷酸腺苷(ATP)等重要的代谢活动。但是由于这4种单体通过α-螺旋、β-折叠和β-转角等蛋白质二级结构形成了紧密的酪蛋白空间结构,使其在人体内消化困难,且易过敏,这些因素限制了酪蛋白在食品领域的应用。然而,近年来在酪蛋白水解物中发现很多具有重要生理功能的多肽,如:阿片肽[3]、降血压肽[4]、抗血栓肽、免疫促进肽[5]、促进矿物离子吸收肽等,而这些多肽大约在1 000 Da左右,容易被肠道吸收[3]。这使得酪蛋白的水解成为研究的热点[6]。
目前,蛋白质的酶解改性是改善蛋白质功能特性及其应用范围的一种有效方法[8]。胰蛋白酶用来水解酪蛋白的研究相对较多[5,9-10],但主要集中在水解条件的优化[11]、水解度、水解率及酶解产物中可溶性氮、氨基氮及肽氮含量[8]等较表观方面的研究,而对酪蛋白水解过程中蛋白质的空间构象的变化研究的相对较少。
本研究采用超声波技术对酪蛋白进行预处理,然后对其进行酶解。以期研究结果能够为酪蛋白酶解机制提供线索,为制备生物活性肽,呈味肽等新产品提供技术支撑,拓宽酪蛋白在食品和非食品领域的应用。
1 材料与方法
1.1材料
酪蛋白(蛋白含量82.84 %、水分11.96 %、灰分2.48 %):河南省东方惠化工有限公司;胰蛋白酶(酶活1.13×105U/g):美国Amresco公司;其它试剂均为分析纯。
JY92-Ⅱ型超声波细胞粉碎机:宁波新芝生物科技股份有限公司;LC1260高效液相色谱仪:美国Agilent公司;Quanta200扫描电子显微镜:美国FEI公司;BT-9300H激光粒度分布仪:丹东市百特仪器有限公司;WQF-510傅里叶红外光谱仪:北京瑞利分析仪器公司。
1.2方法
1.2.1酪蛋白酶解的辅助条件及酶解条件
在室温条件下,配置底物浓度为5 %酪蛋白悬浮液,调节至pH 8使其溶解,先将酪蛋白悬浮液置于超声波细胞粉碎(25 kHz)机中,调整超声波的输出功率分别为160 W和400 W,设置超声波处理时间为1 h,未经超声波处理酪蛋白悬浮液为对照。
酪蛋白酶解的条件为:酪蛋白底物浓度5 %,酶解温度40°C,胰蛋白酶酶用量2 500 U/g酪蛋白。酶解一定时间后,迅速沸水浴10 min灭酶,冷却至室温,4 000 r/min离心20 min得上清液。
酶解之后的悬浮液一部分直接测定粒度的分布;另一部分冷冻干燥,所得固体样品分别用于分子量分布、表面结构测定和二级结构测定。
1.2.2酶解产物的粒度分布测定
粒度分布采用激光粒度分布仪进行测定,酶解液按1∶1000(质量比)用去离子水稀释,具体方法参见苏银杰等的方法[12]。每个样品平行采集3次,取平均图谱。
1.2.3酶解产物的分子量分布测定
采用高效体积排阻色谱(HPSEC)检测超声波处理酪蛋白的分子量分布情况。具体方法与步骤参考王金水等方法[13]。
1.2.4酶解产物表面结构测定
采用扫描电子显微镜观测酪蛋白及超声波处理的酪蛋白样品的表面结构。取适量的酪蛋白及处理样品,按扫描电子显微镜的要求制样,进行样品的外观扫描。
1.2.5酶解产物的二级结构测定
采用傅里叶红外光谱(FTIR)测定超声波辅助处理酪蛋白及酶解产物的二级结构。具体步骤如下:称取固体样品2 mg,加入200 mg溴化钾充分研磨干燥,压片,使用傅里变换叶红外光谱仪进行400 cm-1~4 000 cm-1波数扫描。选取波数为1 600 cm-1~1 700 cm-1波谱图做傅里叶去卷积和二阶导数图谱,采用Gausse函数进行多次拟合至残差最小。
1.2.6数据分析
试验指标的检测个进行3组平行试验,结果用平均值±标准偏差表示。结果通过SPSS统计分析软件进行95 %和99 %水平方差分析检验。
2 结果与讨论
2.1酪蛋白酶解产物悬液粒度分布特征
酪蛋白酶解液粒度分布及粒度分布累积含量见图1。
图1 A和B是未经超声波辅助处理酪蛋白酶解的粒径分布图,从图可以看出,未经酶解的酪蛋白粒径分布范围较宽,约为0.1 μm~70.0 μm。随着酶解时间的延长,酪蛋白产物的粒度分布的峰值向左移动,表明随着酶解时间的延长,酪蛋白酶解产物的粒径逐渐变小;酶解10 min时,粒度分布曲线呈现双峰模式,随着酶解时间的延长,曲线逐渐变为单峰模式,表示粒径分布逐渐均匀。图1 C和D是160 W超声波辅助处理酪蛋白酶解的粒径分布图,从图可以看出,酪蛋白酶解粒径分布范围相对较窄,约为0.2 μm~30.0 μm,随着酶解时间的延长,酪蛋白酶解产物的粒度分布的峰值向左移动,累积含量曲线左移,且曲线由平缓逐渐变为陡立,表明随着酶解反应的进行,酪蛋白酶解产物粒径减小且分布集中。图1 E和F是400 W超声波辅助处理的酪蛋白粒径分布图,从图可以看出,酪蛋白及酶解产物粒径分布范围相对较窄,约为0.1 μm~30.0 μm;与160 W辅助处理的酪蛋白酶解产物的粒度分布值相比,可以看出,400 W处理在酶解40 min时的粒度分布峰值更小,表明在同样的酶解时间内,经过大功率预测处理的酪蛋白更加容易酶解。
利用超声波辅助处理后酪蛋白酶解液粒度分布情况进行积分得表1。

图1 酪蛋白酶解液粒度分布及粒度分布累积含量图Fig.1 The chart of particle size distribution and the cumulative content of particle size distribution in the casein enzymolysis liquid

表1 超声波辅助处理对酪蛋白酶解液粒度分布的影响Table 1 The influence of ultrasonic pretreatment on particle size distribution of casein enzymolysis products
续表1超声波辅助处理对酪蛋白酶解液粒度分布的影响
Continue table 1 The influence of ultrasonic pretreatment on particle size distribution of casein enzymolysis products

注:D表示颗粒直径,D(x)指一个样品的累积粒度分布达到x %时所对应的粒径;其中,D(50)表示中位径;D(4,3)表示体积平均径及D (3,2)表示表面积平均径,两数值越接近,表示颗粒形状越规则,越接近于球形。
由表1可知,对于对照试验,随着酶解反应的进行,D(50)、D(90)、D(4,3)总体呈现下降趋势,但各相邻点之间变化不明显。而经过超声波(160 W和400 W)处理后的酪蛋白酶解产物分析表明,D(90)呈显著下降趋势(P < 0.05),表明在酶解过程中,经超声波处理后的酪蛋白大颗粒物质更易被分解为小颗粒;与对照试验结果相比,经超声波(160 W和400 W)处理后,酪蛋白酶解产物D(50)、D(90)、D(100)、D(4,3)均有所下降。经超声波处理后的酪蛋白经过为20、30 min的酶解,其酶解产物D(90)、D(100)明显小于对照试验(P < 0.01),且400 W处理明显强于160 W处理(P < 0.01)。但当酶解时间到40 min~80 min时,超声波处理不能够显著影响酶解产物粒径的累积分布。D(4,3)、D (3,2)随酶解时间的延长,呈下降趋势,且比值越来越小,表明随着酶解时间的延长,酶解产物在水中越来越接近于球形。
2.2酪蛋白酶解产物分子量分布特征
酪蛋白酶解产物分子量分布的积分换算见表2。

表2 超声波处理对酪蛋白酶解产物分子量分布的影响Table 2 The inflDaence of ultrasonic pretreatment on molecular weight distribution of casein enzymolysis products
由表2可以看出,分子量>20 000 Da的多肽含量,随着酶解时间延长而减少,而<1 000 Da的多肽含量逐渐增多,中间分子量的多肽,表现出动态变化,说明是中间过渡形态。对160和400 W超声波辅助处理1 h后酪蛋白的酶解结果,经400 W超声波辅助处理后酶解的小片段更多,则酶解效果更明显。
2.3酪蛋白酶解产物表面结构特征
未超声波辅助处理酪蛋白不同酶解时间后表面的结构、160 W超声波辅助处理酪蛋白酶解不同时间后表面的结构和400 W超声波辅助处理酪蛋白酶解不同时间后表面的结构结果分别见图2~图4。

图2 未超声波辅助处理酪蛋白不同酶解时间后表面的结构图Fig.2 The surface structure of the same casein(without ultrasonic pretreated)at the different time of enzymolysis

图3 160 W超声波辅助处理酪蛋白酶解不同时间后表面的结构图Fig.3 The surface structure of the same casein(ultrasonic pretreated by 160 W)at the different time of enzymolysis

图4 400 W超声波辅助处理酪蛋白酶解不同时间后表面的结构图Fig.4 The surface structure of the same casein(ultrasonic pretreated by 400 W)at the different time of enzymolysis
未经超声波辅助处理酪蛋白酶解过程中(10 min~80 min)蛋白的表面结构变化如图2A-F,可以看出,酪蛋白酶解10 min时其表面就出现酶解的小孔,随着酶解时间的延长,酶解的孔洞逐渐增大,到40 min时,酪蛋白的表面出现层叠状,进而酶解之后,层片逐渐减小。表明酪蛋白的胶团表面逐步破碎。经160 W超声波辅助处理酪蛋白酶解过程(10 min~80 min)产物的表面结构变化如图3 A~F所示,可以看出,与对照试验相比,经160 W超声波处理1 h后,酶解10 min~20 min时其表面酶解的小孔更加均匀,呈现“蜂窝状”,到30 min时,酪蛋白的表面出现层叠状,比未处理的提前出现层片结构,逐渐减小。表明酪蛋白经超声波处理后,其酶解反应能更加深层次地进行。经400 W超声波辅助处理酪蛋白酶解过程(10 min~80 min)产物的表面结构变化如图4A~F所示,与对照和160 W的试验相比,经400 W超声波辅助处理1 h后,酪蛋白酶解10 min时其表面就呈现“蜂窝状”,到20 min时,酪蛋白中的酶解小孔变大,到30 min时,酪蛋白的表面出现层叠状,到40 min时,酪蛋白酶解的胶团表面结构疏松,有利于酶解的立体化进行。
2.4酪蛋白酶解产物二级结构特征
酪蛋白及经超声波后酶解产物的傅里叶变换红外光谱检测结果如图5所示。

图5 酪蛋白酶解产物傅里叶红外光谱图Fig.5 The Fourier infrared spectrum of casein enzymolysis products
经超声波160W辅助处后与对照相比,在2000cm-1~2 400 cm-1处有明显的变化。但是,对蛋白质二级结构分析和应用最为广泛的是对酰胺Ⅰ带(波数1 700 cm-1~1 600 cm-1)进行去卷积、二阶导数拟合处理,且认为1 610cm-1~1640cm-1为β-折叠,1 640 cm-1~1 650 cm-1为无规则卷曲,1 650 cm-1~1 658 cm-1为α-螺旋,1 660cm-1~1700cm-1为β-转角。
对未经超声波和超声波处理后的酪蛋白及其酶解产物的红外光谱酰胺I带(1 600 cm-1~1 700 cm-1)进行去卷积、二阶导数拟合处理,并统计酪蛋白酶解产物二级结构含量,见表3。
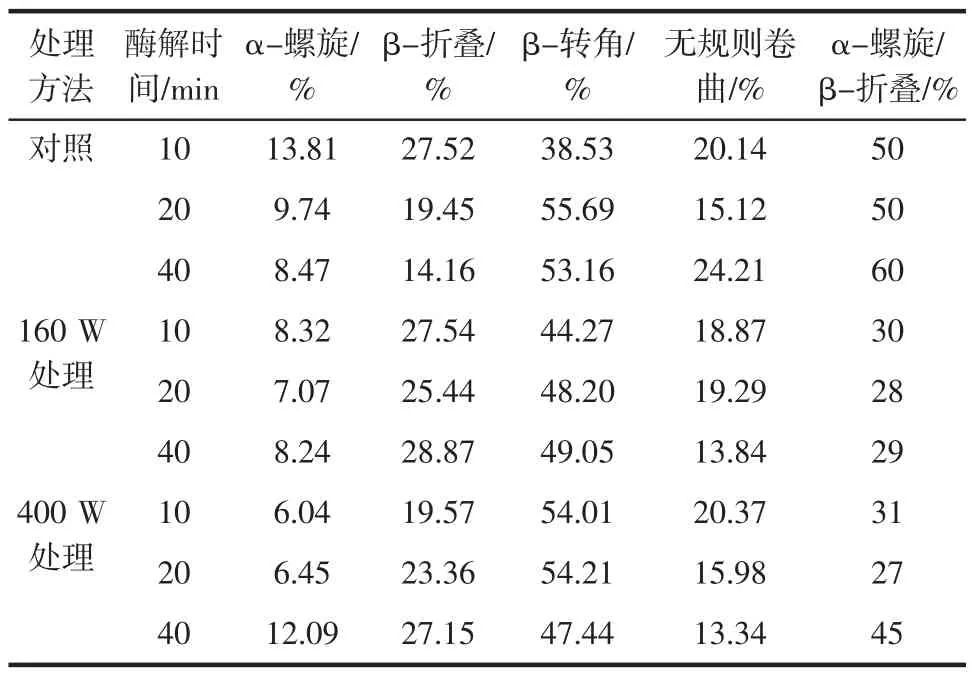
表3 酪蛋白酶解产物二级结构含量统计表Table 3 The secondary structure of casein enzymolysis products
由表3可知,酪蛋白经胰蛋白酶酶解之后,α-螺旋含量均下降,α-螺旋/β-折叠也不同程度减小,酶解10 min时变化已经很明显;与对照试验相比,经160、400 W超声波处理1 h后的酪蛋白,在经过同等酶解时间处理,其酶解产物中的α-螺旋/β-折叠有所下降,表明经超声波辅助处理的酪蛋白,其酶解产物柔韧性增大。经160和400 W超声预处理1 h后,在酶解20 min时,其产物中的α-螺旋/β-折叠分别为0.28、0.27,二者之间结果差异不显著;但酶解40 min后,则其二者之间产物中的α-螺旋/β-折叠结果有显著差异(0.29、0.45)。
3 结论
本试验用超声波对酪蛋白进行预处理之后,利用胰蛋白酶对其进行酶解,检测酶解后产物的表面特征、粒度分布及二级结构等指标,结果表明,用超声波辅助处理后,酪蛋白酶解液的酶解产物与未采用超声波辅助处理的结果相比,产物的粒度更小且分布均匀,酪蛋白表面的孔洞化和层片化更快,随着酶解时间的延长,酪蛋白酶解产物颗粒的粒度变小,分子量分布更加均匀;酪蛋白酶解产物中β-转角和无规则卷曲减少,而β-转角的含量增加。说明超声波辅助处理对酶解酪蛋白有很好的促进的作用。
参考文献:
[1] Bonizzi I, Buffoni J N, Feligini M. Quantification of bovine casein fractions by direct chromatographic analysis of milk. Approaching the application to a real production context[J]. Journal of Chromatography A, 2009, 1216(1): 165-168
[2] Horne D S. Casein structure, self-assembly and gelation[J]. Current Opinion in Colloid and Interface Science, 2002, 7(5): 456-461
[3] Su R, He Z, Qi W. Pancreatic hydrolysis of bovine casein: Changes in the aggregate size and molecular weight distribution [J]. Food chemistry, 2008, 107(1): 151-157
[4] Sostaric J z, Riesz P. Adsorption of surfactants at the gas/solution interface of cavitation bubbles: an ultrasound intensity-independent frequency effect in sonochemistry[J]. The journal of physical chemistry. b, 2002, 106(48): 12537-12548
[5]朱少娟,施用晖,乐国伟.超声波对胰蛋白酶水解酪蛋白的影响[J].食品与生物技术学报, 2005, 24(2): 50-54
[6] Wang C, Jiang L, Wei D. Effect of secondary structure determined by FTIR spectra on surface hydrophobicity of soybean protein isolate[J]. Procedia Engineering, 2011, 15(1): 4819-4827
[7]石燕,葛辉,涂宗财,等.超声波对酪蛋白结构与功能性质的影响[J].食品与发酵工业, 2014, 40(2): 16-21
[8]高芸芳,王金水,苏银杰.超声波处理对酪蛋白-胰蛋白酶体系酶解特性的影响[J].河南工业大学学报:自然科学版, 2012, 33(5): 11-14
[9] Arzeni C, Martínez K, Zema P. Comparative study of high intensity ultrasound effects on food proteins functionality[J]. Journal of Food Engineering, 2012, 108(3): 463-472
[10]王政,杨国宇,潘玉善,等.酪蛋白的胰蛋白酶酶解条件的优化[J].华中农业大学学报:自然科学版, 2005(6): 618-621
[11]毛学英,南庆贤.不同酶解条件下酪蛋白酶解产物特性的阶段性研究[J].中国乳品工业, 2002, 30(5): 12-14
[12]苏银杰,王金水,高芸芳.酪蛋白三种组分的酶解特性研究[J].食品工业科技, 2013, 34(19): 61-65
[13]王金水,蔺丹华,苏银杰,等.磷酸化处理对酪蛋白酶解特性的影响[J].现代食品科技, 2013, 29(12): 2816-2820
Study on the Structural Characteristics of Casein Hydrolysis Products
LIU Tian-tian1,WANG Jin-shui1,*,GAO Yun-fang1,LI Xiao-wei2,ZHOU Xiao-pei1,JIA Feng1
(1. College of Biological Engineering,Henan University of Technology,Zhengzhou 450001,Henan,China;2. School of Food Science and Technology,Henan University of Technology,Zhengzhou 450001,Henan,China)
Abstract:The characteristics of the product in the process of digestion with trypsin after the enzymolysis of the ultrasonic pretreated casein were studied. The particle size distribution of caseian were measured with laser particle size distribution analyzer,and the surface characteristics of casein were detected by the electronic scanning electron microscopy(SEM),and the secondary structure changes in casein were measured with Fourier infrared spectrum. The results showed that it was easy to make holes or layers in the dense surface structure of ultrasonic pretreated casein than the untreated casein. The larger casein particles changed into smaller one and molecular weight distribution became more uniform. These changes made the originally dense surface structure of casein to become relatively incompact and increase the specific surface area. These changes were conducivebook=15,ebook=22to the subsequent enzymolysis. The beta angle and random curl reduced as well as the contents of beta angle increased in casein after enzymolysis. The results showed that it had a good effect on the enzymatic hydrolysis of casein with ultrasonic assisted treatment.
Key words:casein;enzymatic hydrolysates;secondary structure;ultrasonic;Fourier transform infrared spectroscopy(FTIR)
收稿日期:2015-02-04
*通信作者:王金水(1964—),男(汉),教授,博士,研究方向:粮食生物技术。
作者简介:柳甜甜(1987—),女(汉),硕士研究生,研究方向:粮食生物技术。
基金项目:河南工业大学博士基金项目(2012BS013);河南省教育厅科学技术研究重点项目(13A550166);郑州市普通科技攻关计划项目(N2013G0077);河南工业大学校基础研究重点培育基金(2013JCYJ05)
DOI:10.3969/j.issn.1005-6521.2016.08.004
