低温低压法提取桑黄菌丝体活性多糖
2016-05-18李乐马瑶李亭亭慕雪盼王苗刘陶马小魁富平中学陕西渭南7700药用资源与天然药物化学教育部重点实验室西北濒危药材资源开发国家工程实验室陕西师范大学生命科学学院陕西西安7000
李乐,马瑶,李亭亭,慕雪盼,王苗,刘陶,马小魁,*(.富平中学,陕西渭南7700;.药用资源与天然药物化学教育部重点实验室/西北濒危药材资源开发国家工程实验室,陕西师范大学生命科学学院,陕西西安7000)
低温低压法提取桑黄菌丝体活性多糖
李乐1,马瑶2,李亭亭2,慕雪盼2,王苗2,刘陶2,马小魁2,*
(1.富平中学,陕西渭南711700;2.药用资源与天然药物化学教育部重点实验室/西北濒危药材资源开发国家工程实验室,陕西师范大学生命科学学院,陕西西安710100)
摘要:首次通过旋转蒸发仪在低温低压条件下提取桑黄菌丝体活性多糖,并利用响应面法对提取条件进行了优化。在单因素试验结果的基础上,分别以多糖得率和其总抗氧化活性为响应值,使用Minitab 16软件对提取时间、压力、液料比进行了优化,并通过响应面优化器对同时获得高活性高产率桑黄多糖的条件进行了优化。结果显示,在提取时间、压力和液料比分别为1.8 h、0.059 MPa和52.5∶1(mL/g)的最优提取条件下,从桑黄菌丝体中获得多糖的得率和抗氧化活性(TEAC)分别可达到4.41%和6.33mM。证实低温低压法提取真菌活性多糖的方法是可行的。
关键词:旋转蒸发仪;低温低压法;响应面优化;多糖得率;抗氧化活性
桑黄又名鲍氏层孔菌(Phellinus igniarius),属担子菌亚门(Basidiomycota)、层菌纲(Hymenomycetes)、非褶菌目(Aphyllophorales)、锈革孔菌科(Hymenochaetaceae)、针层孔菌属(Phellinus)[1],具有抗肿瘤[2-3]、抗氧化[4-7]、降血糖[8-9]、消炎[10-12]和增强免疫活性[13-15]等药理作用。桑黄是在生物抗癌领域中国际公认的效果最佳的药用菌,也是国际医药界与保健品行业抗癌产品生产的原料[16],市场潜力巨大。但桑黄在自然界中很难形成子实体,并且人工栽培技术还不成熟,市场供应严重不足。多糖作为桑黄菌的一种非常重要的活性物质,具有非常好的药效作用[17]。桑黄菌丝体多糖提取方法主要有热水浸提法、超声破碎法等。郭霞[18]等对利用热水提取法、复合酶法、超声波提取法等提取桑黄菌丝体多糖的提取条件进行了研究。但是,这些方法存在提取温度高,物理破碎剧烈的缺点,从而导致获得的多糖活性差,产率低。
响应面设计法(RSM)是采用多元二次回归拟合方程以及多种统计方法分析多因素系统中最佳条件的数学统计方法[19],是建立一个包括各因素的一次项、平方项和任何两个因素之间的一级交互作用项的数学模型,也是目前国外较广泛使用的优化方法,近年来在国内也日益受到重视[20-23]。在我们成功建立高效液体培养桑黄菌的基础上[24-25],本试验通过旋转蒸发仪建立了一种低温低压法提取桑黄菌丝体高活性多糖的方法,并通过RSM对其提取条件进行了优化。该试验结果为大规模利用这一珍稀药用资源提供了理论和技术基础。
1 材料与方法
1.1材料与仪器
菌种:桑黄(Phellinus sp.P0988),保藏于中国典型培养物保藏中心,编号为CCTCC NO:M 2012080。
RE-6000旋转蒸发仪:上海亚荣生化仪器厂;JA2603B精密电子天平:上海精科仪器;Epoch超微量微孔板分光光度计:美国BioTek。
1.2方法
1.2.1工艺流程
桑黄菌种活化、发酵→发酵液→9 000 r/min离心15 min弃上清,取菌丝体→清水冲洗→过滤除去水分→低温低压法提取→收集提取液→浓缩、醇沉→冷冻干燥得到粗多糖
1.2.2桑黄菌丝体多糖提取得率和多糖抗氧化活性(TEAC)测定
多糖含量的测定:苯酚-硫酸法[26],以葡萄糖为标准品,测得470 nm处标准曲线的线性回归方程为:y = 0.001 9x + 0.006 4,R2= 0.990 4。
桑黄多糖得率计算:桑黄多糖得率/ %=桑黄多糖含量/提取菌丝量×100。
多糖抗氧化活性测定:使用总抗氧化能力检测试剂盒,以Trolox为标准品,测得734 nm处标准曲线的线性回归方程为:y = 0.140 3x + 0.028 9,R2= 0.996 4。
1.2.3单因素及响应面试验设计
以旋转蒸发仪为提取仪器,分别以提取时间、压力和液料比3个因素进行单因素试验设计。提取时间分别设定为1、2、3、4、5 h;提取压力分别设定为0.01、0.03、0.05、0.07、0.09 MPa;液料比分别设定为:30∶1、40∶1、50∶1、60∶1、70∶1(mL/g)。测定桑黄菌丝多糖得率及TEAC,每个试验均设3个重复,结果取平均值。
根据单因素试验结果,使用Minitab 16软件,采用中心组合试验设计(CCD)的方法分析压力、液料比、和时间对响应值的影响,对试验数据进行分析,拟合多元二次回归方程模型,确定提取桑黄菌丝多糖的最佳工艺参数。多元二次回归方程模型拟合的性质由R2表达,其统计学上的显著性由P值检验。并以Minitab 16软件的响应面优化器对同时获得高产率和活性的多糖提取条件进行优化。
2 结果与分析
2.1单因素试验结果
2.1.1提取时间对桑黄多糖得率和抗氧化活性的影响
以旋转蒸发仪为提取仪器,分别设定压力值为0.05 MPa、液料比为40∶1(mL/g)、提取温度为60℃,研究提取时间分别为1、2、3、4、5 h时对多糖得率及抗氧化活性的影响,结果如图1(A)所示。结果表明,当提取时间为2 h时,多糖得率和抗氧化活性均达到最大。随着时间的增加,多糖得率降低,这是由于多糖处于一定温度的时间越长,多糖受到的破坏越大。随着时间的增加,抗氧化活性也降低,而这则是由于多糖得率降低造成的。
2.1.2提取压力对桑黄多糖得率和抗氧化活性的影响
以旋转蒸发仪为提取仪器,分别设定时间值为2h、液料比为40∶1(mL/g)、提取温度为60℃,研究提取压力分别为0.01、0.03、0.05、0.07、0.09 MPa时对多糖得率及抗氧化活性的影响,结果如图1(B)所示。结果显示,随着压力的增加,多糖得率和抗氧化活性均明显增加,当压力为0.05 MPa时,多糖得率和抗氧化活性均达到最大。随着压力的进一步增大,均有所降低,这是由于压力过大会使多糖的结构遭到破坏,从而影响多糖得率,造成抗氧化活性也随之降低,但抗氧化活性变化并不大,这是由于提取温度相对较低,使得已获得的多糖仍具有完整的结构。
2.1.3提取液料比对桑黄多糖得率和抗氧化活性的影响
以旋转蒸发仪为提取仪器,分别设定时间值为2h、压力为0.05 MPa、提取温度为60℃,研究提取液料比分别为30∶1、40∶1、50∶1、60∶1、70∶1(mL/g)时对多糖得率及抗氧化活性的影响,结果如图1(C)所示。结果显示,随着液料比的增加多糖得率明显增加,抗氧化活性随着多糖得率的变化而变化,当液料比为50∶1(mL/g)时,多糖得率和抗氧化活性均达到最大。随着液料比的进一步增大,多糖得率明显下降,这是由于液料比过大不利于多糖物质的溶出,但抗氧化活性变化不大,这是由于已溶出的多糖仍具有完整的结构。
单因素试验结果表明,分别在提取时间为2 h,提取压力为0.05 MPa,提取液料比为50∶1(mL/g)时,桑黄菌丝体多糖提取的产率和抗氧化活性最高。但各个单因素最优条件的简单组合并不一定能获得最高的试验效果[10-12],这还需要通过响应面设计方法进一步确定最优的提取条件。
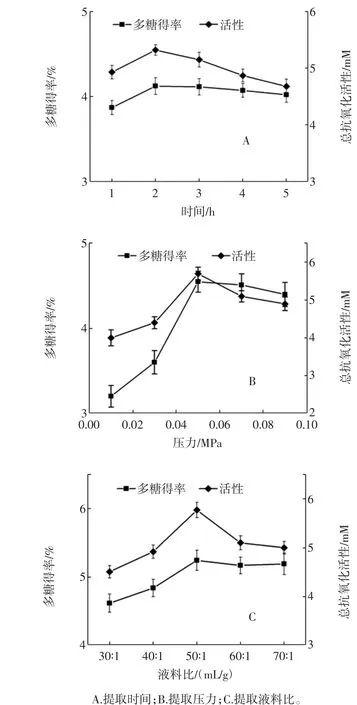
图1 提取时间、压力、液料比对多糖得率和抗氧化活性(TEAC)的影响Fig.1 The effect of individual extraction time,extraction pressure,solvent-solid ratio on polysaccharide yield and TEAC
2.2响应面设计及结果
2.2.1响应面试验设计
根据2.1的单因素试验结果,以提取时间(X1)、提取压力(X2)、提取液料比(X3)为主要因素,选取X1为1、2、3 h,X2为0.03、0.05、0.07 MPa,X3为40∶1、50∶1、60∶1(mL/g)为因素的水平范围,分别以多糖得率(Y1)和多糖抗氧化活性(Y2)为响应值,根据中心复合试验(CCD)设计原理,设计三因素三水平试验。各因素的低、中、高水平以-1、0、1为编码设计试验,试验因素和水平的编码如表1所示。CCD试验设计及结果如表2所示。
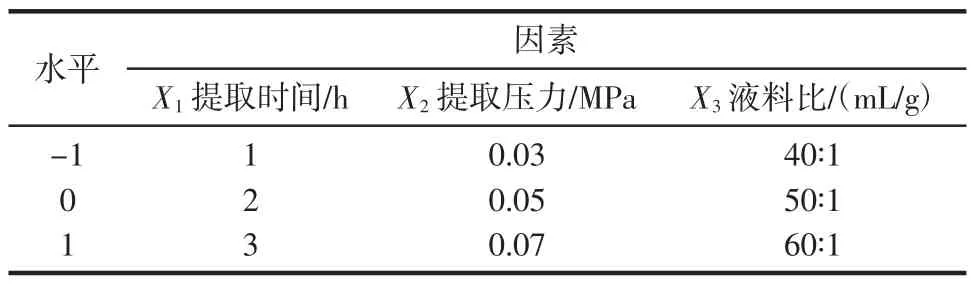
表1 三因素三水平中心复合试验因素水平编码表Table 1 The central composite experiment factor level table of three factors and three levels
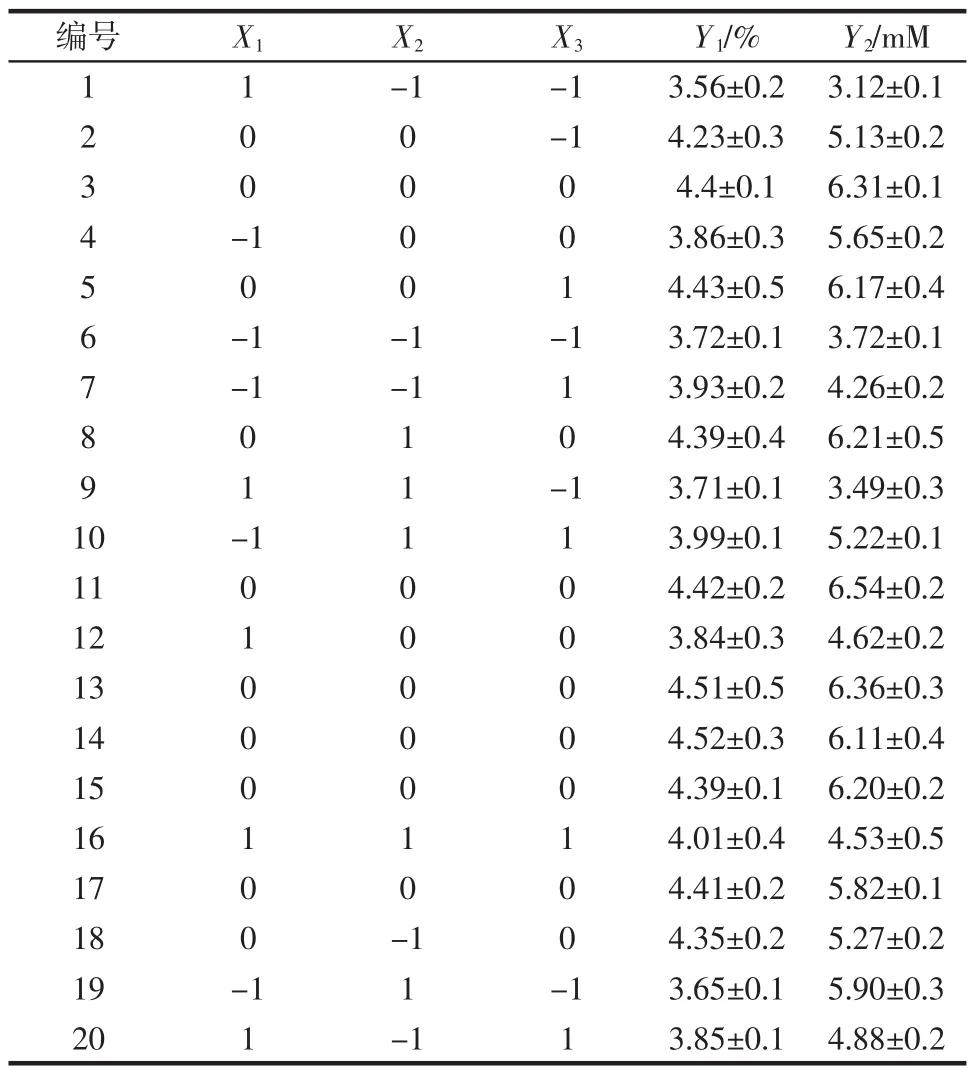
表2 CCD试验设计及结果Table 2 Experimental design and results of CCD test
2.2.2以多糖得率为响应值的拟合回归方程的方差分析
使用Minitab 16分析软件对表2中Y1的试验数据进行回归系数的显著性检验和ANOVA分析,分析结果见表3。
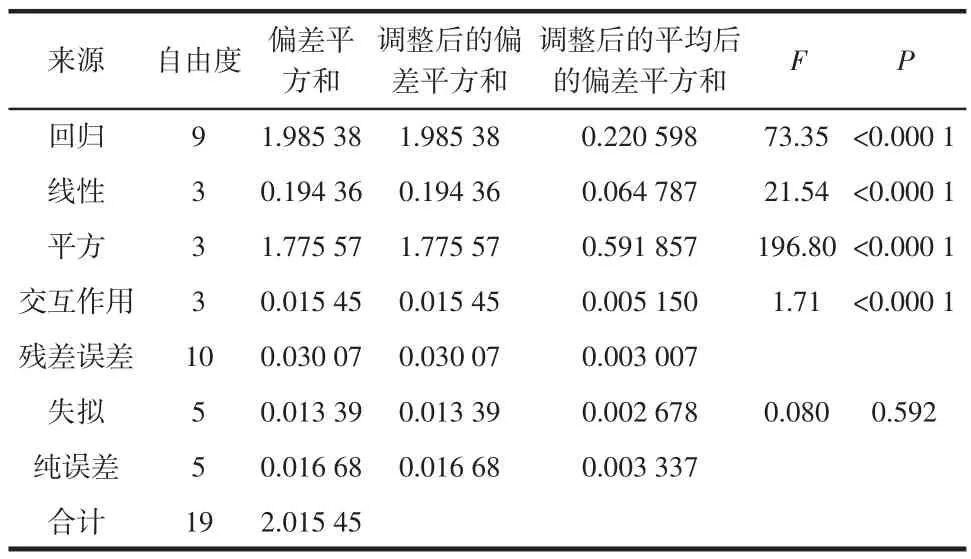
表3 以响应值为多糖得率拟合回归方程的方差分析Table 3 ANOVA analysis for regression equation using polysaccharide yield as response values
拟合多糖得率Y1与各自变量关系的多元二项式回归方程模型如下:
Y1= 4.42 - 0.018X1+ 0.034X2+ 0.134X3- 0.542X12-0.022 3X22-0.062 3X32+0.04X1X2+0.005X1X3+0.017 5X2X3
式中:Y1为胞外多糖得率;X1、X2、X3分别为提取时间、提取压力、提取液料比的编码值。
以响应值为多糖得率拟合回归方程的方差分析见表3。由方差分析得到模型的回归系数为R2=0.985 1,说明方程模型与试验数据的拟合度为98.51 %,误差为1.49 %,调整后的R2adj=0.971 6,说明模型和实际拟合程度较好。P值用于检验各系数的显著性,P值越小,相关系数的显著性越大。由表3可知,各系数的P< 0.000 1,则此模型具有显著性和统计学意义,而失拟检测项(0.592>0.05)不显著,则不显著,说明回归方程的拟合非常理想。各因素的交互作用P<0.000 1,说明各因素交互作用对多糖得率的影响显著。
根据拟合方程,获得最佳提取多糖产量的工艺参数为:提取时间2.03 h、压力0.04 MPa、料液比60.2∶1 (mL/g)。此工艺参数预测多糖得率为4.47 %,对预测的工艺参数和结果以旋转蒸发仪为提取仪器进行3次试验验证,取平均值,测得多糖得率为4.32 %,SD值为0.27,说明以多糖得率为响应值的拟合方程预测准确。
2.2.3以多糖抗氧化活性(TEAC)为响应值的拟合回归方程的方差分析
使用Minitab 16分析软件对表2中多糖抗氧化活性的试验数据进行回归系数的显著性检验和ANOVA分析,分析结果见表4。
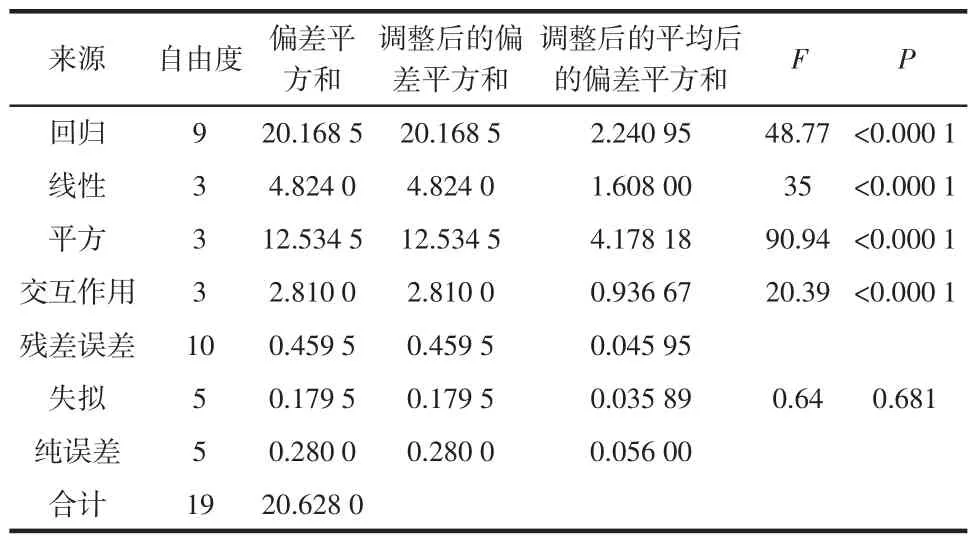
表4 以响应值为多糖抗氧化活性(TEAC)的拟合回归方程的方差分析Table 4 ANOVA analysis for regression equation using TEAC as response value
拟合得到多糖抗氧化活性Y2与各自变量关系的多元二项式回归方程模型如下:
Y2= 6.15-0.42X1+0.42X2+0.36X3-0.97X12-0.37X22-0.47X32+0.4X1X2+0.375X1X3+0.225X2X3
式中:Y2为多糖抗氧化活性;X1、X2、X3分别为提取时间、提取压力、提取液料比的编码值。
以响应值为多糖抗氧化活性(TEAC)的拟合回归方程的方差分析见表4。由方差分析得到模型的回归系数R2=0.977 7,说明方程模型与试验数据的拟合度为97.77 %,误差为2.23 %,调整后的R2adj=0.957 7,说明模型和实际拟合程度较好。P值检验各系数的显著性,由表4可知,各系数的P<0.000 1,则此模型具有显著性和统计学意义,失拟检测项(0.681>0.05)不显著,说明回归方程的拟合非常理想。由方差分析得到各因素的交互作用P<0.000 1,说明各因素交互作用对多糖抗氧化活性影响显著。
根据拟合方程,获得较高的多糖抗氧化活性的提取工艺参数为:提取时间1.8 h、压力0.063 MPa、料液比51.5∶1(mL/g)。此工艺参数预测得到的多糖抗氧化活性为6.37 mM,对预测的工艺参数和结果以旋转蒸发仪为提取仪器进行3次试验验证,取平均值,测得多糖抗氧化活性为6.21 mM,SD值为±0.35,说明以多糖抗氧化活性为响应值的拟合方程预测准确。
2.3双响应值优化
采用Minitab 16分析软件优化器对同时获得高产率和高活性的多糖提取条件进行进一步优化。优化结果如图2所示。
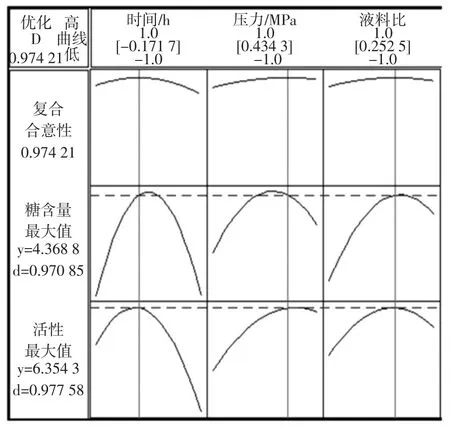
图2 响应优化器优化图Fig.2 The optimization plot of response optimizer
当响应优化的合意性达到0.974 21时,说明优化结果合理。优化的最佳工艺参数为:提取时间1.8 h、压力0.059 MPa、料液比52.5∶1(mL/g),预测多糖得率可达到4.37 %,抗氧化活性可达到6.35 mM。对预测的工艺参数和结果以旋转蒸发仪为提取仪器进行3次试验验证,取平均值,测得多糖得率为4.41 %,SD值为±0.31,多糖抗氧化活性为6.33 mM,SD值为±0.26。说明对多糖得率和抗氧化活性的双响应值优化的预测准确。
3 讨论
本试验建立了一种从液体培养获得的桑黄菌丝体中提取桑黄活性多糖的新型提取工艺,即低温低压法。在本试验操作中,首次采用旋转蒸发仪作为提取仪器,集提取和浓缩为一体,并可以大量提取桑黄菌丝体多糖,为获得大量及高活性的多糖成分提供了试验方法。该方法与传统提取方法相比,降低了提取温度,并能在低压环境下提取真菌菌丝体多糖。而且本方法在获得高产量多糖的同时,可以最大限度的保护多糖结构,进而使获得的多糖抗氧化活性达到较高水平,确保所得多糖为高活性多糖。
提取因素及水平对桑黄菌丝体的多糖得率和抗氧化活性都分别具有一定的影响。为了获得高产量的活性多糖,本试验在单因素试验的基础上采用Minitab 16分析软件进行CCD试验设计,对试验结果先分别以多糖得率和多糖抗氧化能力作为响应值拟合多元二次回归方程,并对其进行方差分析,结果显示拟合方程非常理想。然后又同时以多糖得率和多糖抗氧化活性作为双响应值进行优化,得到了同时获得高产率和活性的最佳优化条件的工艺参数,即提取时间、压力和液料比分别为1.8 h、0.059 MPa和52.5∶1(mL/g)。在此提取条件下,经过试验验证,提取的多糖得率和总抗氧化活性分别可达到4.41 %和6.33 mM。本研究对桑黄多糖的活性功能的进一步研究具有重要的现实意义。
参考文献:
[1]戴玉成.药用担子菌-鲍氏孔菌(桑黄)的新认识[J].中草药, 2003, 34(1):94-95
[2]车会莲,盂繁岳,杜杰,等.桑黄提取物对肿瘤生长和细胞免疫功能的影响[J].中国公共卫生,2005,21(1):79-81
[3] Song Y S, Kim S H, Sa J H, et al. Anti-angiogenic, antioxidant and xanthine oxidase inhibition activities of the mushroom Phellinus linteus[J]. Journal of ethnopharmacology, 2003, 88(1): 113-116
[4] In-Hye Park, Shin-Kyo Chung et al. An Antioxidant Hispidin from the Mycelial Cultures of Phellinus linteus[J]. Archives of pharmacal research,2004, 27(6):615-618
[5]郑立军,沈业寿,季俊虬,等.桑黄胞内多糖的抗突变和抗氧化作用[J].癌变.畸变.突变, 2007, 18(6): 465-468
[6]张万国,胡晋红,蔡漆,等.桑黄抗大鼠肝纤维化与抗脂质过氧化[J].中成药.2002,24(4):281-283
[7] Chang Z Q, Hwang M H, Rhee M H, et al. The in vitro anti-platelet, antioxidant and cellular immunity activity of Phellinus gilvus fractional extracts[J]. World Journal of Microbiology and Biotechnology, 2008, 24(2): 181-187
[8] Kim D H, Yang B K, Jeong S C, et al. Production of a hypoglycemic, extracellular polysaccharide from the submerged culture of the mushroom, Phellinus linteus[J]. Biotechnology letters, 2001, 23(7): 513-517
[9] Hwang H J, Kim S W, Lim J M, et al. Hypoglycemic effect of crude exopolysaccharides produced by a medicinal mushroom Phellinus baumii in streptozotocin-induced diabetic rats[J].Lifesciences,2005, 76(26): 3069-3080
[10] Kim S H, Song Y S, Kim S K, et al. Anti-inflammatory and related pharmacological activities of the η-BuOH subfraction of mushroom Phellinus linteus[J]. Journal of ethnopharmacology,2004,93(1): 141-146
[11] Ajith T A,Jose N,Janardhanan K K. Amelioration of cisplatin induced nephrotoxicity in mice by ethyl acetateextract of a polypore fungus, Phellinus rimosus[J]. J Exp Clin Cancer Res, 2002, 21(2): 213-217
[12] Kim G Y, Kim S H, Hwang S Y, et al. Oral administration of proteoglycan isolated from Phellinus linteus in the prevention and treatment of collagen-induced arthritis in mice[J]. Biological and Pharmaceutical Bulletin, 2003, 26(6): 823-831
[13] Yuan C, Huang X, Cheng L, et al. Evaluation of antioxidant and immune activity of Phellinus ribis glucan in mice[J]. Food chemistry, 2009, 115(2): 581-584
[14]薛芹.桑黄抗肿瘤活性物质的提取及活性检测[D].南京:南京农业大学, 2009
[15]宋柳徵,张佩.桑黄多糖对免疫细胞调节作用研究进展[J].中国现代医生, 2010, 48(12):23-24
[16]刘红锦,蒋宁,张苏珍,等.桑黄人工培育研究进展[J].江西农业学报, 2011, 23(9): 1661-1670
[17] Leung P H, Zhang Q X, Wu J Y. Mycelium cultivation, chemical composition and antitumour activity of a Tolypocladium sp. fungus isolated from wild Cordyceps sinensis[J]. Journal of applied microbiology, 2006, 101(2): 275-283
[18]郭霞,邹祥,孙敏.桑黄菌丝体多糖提取方法比较及优化研究[J].食用菌,2009(3):62-64
[19]马小魁,江华,李峻志,等.梨形马勃产胞外多糖发酵条件的响应面设计法优化[J].浙江大学学报(农业与生命科学版), 2013, 39(5): 481-488
[20]刘丽丽,张建新,王娜,等.响应面分析法优化光皮木瓜总酚醇提工艺的研究[J].中国酿造, 2009, 28(2): 76-79
[21]凌庆枝,高莉莉,袁怀波,等.用响应面分析法优化桑叶水溶性多糖得提取工艺[J].蚕业科学, 2009, 35(3): 666-670
[22]刘云,胡芳,王志成,等.响应面分析法优化油菜籽类胡萝卜素的提取工艺[J].食品科技, 2009, 34(12): 108-112
[23]刘军海,黄宝旭,蒋德超.响应面分析法优化艾叶多糖提取工艺研究[J].食品科学, 2009, 30(2): 114-118
[24] Ma X K, Zhang H, Fam H. Influence of rutin, FeSO4, Tween 80, aspartate and complex vitamins on synthesis of fungal exopolysaccharide[J]. Carbohydrate polymers, 2013, 92(2): 1188-1196
[25] Ma X, Zhang H, Peterson E C, et al. Enhancing exopolysaccharide antioxidant formation and yield from Phellinus species through medium optimization studies[J]. Carbohydrate polymers, 2014, 107 (8): 214-220
[26] Ma X, Ruan Q, Zhang H, et al. Developing a high-throughput microassay for large samples of fungal polysaccharides[J]. Analytical Methods, 2013, 5(17): 4310-4316
Extraction of Active Polysaccharide from Phellinus species by A Low Temperature and Pressure Method
LI Le1,MA Yao2,LI Ting-ting2,MU Xue-pan2,WANG Miao2,LIU Tao2,MA Xiao-kui2,*
(1. Fu Ping High School,Weinan,711700,Shaanxi,China;2. Key Laboratory of Medicinal Resources and Natural Pharmaceutical Chemistry,Ministry of Education/National Engineering Laboratory for Resource Developing of Endangered Chinese Crude Drugs in Northwest of China,College of Life Science,Shaanxi Normal University,Xi'an 710100,Shaanxi,China)
Abstract:The crude polysaccharide with antioxidant activity was firstly extracted from mycelia of Phellinus sp. using a rotary evaporation apparatus under low temperature and low pressure conditions. The extraction conditions including extraction time,pressure and solvent -solid ratio were optimized through response surface method(RSM),in which the individual yield and total antioxidant activity of polysaccharide were chosen as response values. Based on the results of RSM experiments,the response optimizer was further used to simultaneously get high yield and high activity of polysaccharide during extraction. Results showed that the optimum extraction conditions were extraction time 1.8 h,pressure 0.059 MPa,solvent-solid ratio 52.5∶1(mL/g),respectively. The polysaccharide yield and Trolox-Equivalent Antioxidant Capacity(TEAC)reached 4.41 % and 6.33 mM,respectively,under optimum extraction conditions. A new feasible extracting method for crude polysaccharide from mycelia of Phellinus sp. with high yield and high total antioxidant activity has been developed just using a rotary evaporation apparatus.
Key words:the rotary evaporation apparatus;low temperature and pressure method;response surface method;polysaccharide yield,total antioxidant activity
收稿日期:2015-03-03
*通信作者
作者简介:李乐(1988—),女(汉),硕士,研究方向:微生物技术制药。
基金项目:陕西省特种资源的开发利用(693102)
DOI:10.3969/j.issn.1005-6521.2016.08.012
