耐多药结核分枝杆菌耐药相关基因突变特征分析
2016-05-12孟庆琳王玉峰逄宇赵雁林
孟庆琳 王玉峰 逄宇 赵雁林
·论著·
耐多药结核分枝杆菌耐药相关基因突变特征分析
孟庆琳 王玉峰 逄宇 赵雁林
目的 分析耐多药结核分枝杆菌不同基因型构成以及耐药相关基因突变特征。方法 2007年全国耐药基线调查共收集结核分枝杆菌临床分离株4017株,经比例法药物敏感性试验鉴定获得376株耐多药菌株纳入本研究。采用RD105缺失基因检测法鉴定北京基因型菌株和非北京基因型菌株。对所有耐多药菌株利福平耐药相关基因(rpoB) 和异烟肼耐药相关基因(katG,inhA和oxyR-ahpC)进行测序,分析耐药相关基因突变的特征。结果 在376株耐多药菌株中,有261株 (69.4%, 261/376)属于北京基因型,其余115株(30.6%, 115/376)属于非北京基因型。北京基因型菌株中氧氟沙星耐药率(31.8%,83/261)和前广泛耐药率(30.7%,80/261)明显高于非北京基因型菌株的氧氟沙星耐药率(17.4%,20/115)和前广泛耐药率(15.7%,18/115),差异均有统计学意义(χ2值分别为8.33和9.32,P值均<0.05)。比较北京基因型菌株和非北京基因型菌株不同位点的突变频率,发现北京基因型菌株rpoB基因第531位点 (67.4%, 176/261)和katG基因(66.3%, 173/261)的突变频率明显高于非北京基因型 (rpoB:54.1%, 62/115,χ2=6.28,P=0.010;katG:50.4%, 58/115,χ2=8.46,P=0.000),而非北京基因型菌株未发生rpoB基因突变的菌株比例(14.8%, 17/115)明显高于北京基因型菌株(1.1%, 3/261),差异有统计学意义(χ2=29.46,P=0.000)。 结论 北京基因型耐多药菌株与氧氟沙星耐药高度相关,与非北京基因型耐多药菌株相比,rpoB基因的第531位点和katG基因突变更多发生于北京基因型菌株中。
结核分枝杆菌; 抗药性,多种,细菌; 基因型
中国是耐多药结核病负担最严重的国家之一,全球约1/4的耐多药结核病患者来自中国[1-2]。2007年开展的一项耐药基线调查显示,结核病初治患者和复治患者中耐多药发生率分别为5.7%和25.6%[3]。因此,如何有效控制耐多药结核病的传播是中国面临的重大公共卫生问题。
耐多药结核病的诊断通常依据传统表型药物敏感性试验,由于结核分枝杆菌生长缓慢,传统药敏试验通常需要3个月时间,因此延误了患者的早期诊断和治疗,同时,可能导致耐多药结核分枝杆菌在人群中的传播[4]。随着全基因组测序技术的发展,一系列耐多药结核病的分子生物学检测技术不断问世[4],但是这些技术的应用依赖于对耐多药结核分枝杆菌耐药相关基因突变特征的了解。然而,目前我国尚缺乏具有代表性的耐多药结核分枝杆菌耐药相关基因突变特征分析的研究。本研究选取我国耐药基线调查鉴定的耐多药结核分枝杆菌菌株,采用RD105缺失基因检测法鉴定结核分枝杆菌“北京家族”菌株,同时,对利福平和异烟肼耐药相关基因进行测序分析。
材料和方法
一、 菌株来源
本实验选取376株耐多药结核分枝杆菌菌株,菌株由中国疾病预防控制中心国家结核病参比实验室提供,来自于2007年全国结核病耐药性基线调查[5]。按照流行病学抽样原则,在全国31个省、市、自治区(直辖市)进行结核病耐药基线调查,选点数量根据2005年全年新发涂阳肺结核患者例数为基础计算获得,总计收集到4017株临床分离结核分枝杆菌菌株,上述菌株经过传统比例法药物敏感性试验以及对硝苯甲酸(PNB)和噻吩二羧酸肼(TCH)菌种鉴定,共鉴定获得376株耐多药结核分枝杆菌菌株。标准菌株H37Rv为国家结核病参比实验室保藏菌株。
二、定义
相关定义如下:(1)耐多药结核分枝杆菌:至少对异烟肼和利福平同时耐药的菌株;(2)前广泛耐药(pre-XDR):对氧氟沙星或卡那霉素一种耐药但不同时耐药的耐多药结核分枝杆菌;(3)广泛耐药(XDR):同时对氧氟沙星和卡那霉素耐药的耐多药结核分枝杆菌[1];(4)初治患者:既往未经抗结核治疗,或抗结核治疗时间少于1个月;(5)复治患者:既往抗结核治疗时间大于1个月。
三、 试剂来源
本试验所用改良罗氏培养基购自杭州嘉伟生物制品有限公司;2×Taq预混液购自北京康为世纪生物科技有限公司;所有引物均由北京天一辉远生物技术有限公司合成。
四、基因组DNA提取
采用简单法提取结核分枝杆菌基因组DNA[5]。采用无菌生理盐水清洗罗氏培养基斜面生长的菌落, 吸取菌悬液1 ml于无菌离心管中, 80 ℃ 30 min 灭活, 12 000×g离心5 min,去上清。菌体沉淀用500 μl Tris-EDTA(TE)缓冲液(pH 8. 0) 充分悬浮, 95 ℃水浴30 min, 12 000 ×g离心5 min,取上清即为PCR扩增模板。
五、北京基因型菌株的鉴定
采用RD105缺失基因检测法鉴定北京基因型菌株[6],引物及探针序列:上游引物:5′-AACGAACTGCGCACTGAACTC-3′;下游引物:5′-TCCCGCACCGGTTGAG-3′;荧光探针:5′-FAM-AGAGTGGACAGTTTCG-BHQ1-3′。 扩增体系:2×Taq预混液25 μl,两条引物和探针各0.2 μmol,5 μl基因组DNA。反应条件: 预变性94 ℃ 5 min; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s,40个循环; 72 ℃ 延伸10 min。其中,有RD105区域扩增曲线的定义为非北京基因型菌株,无RD105区域扩增曲线的定义为北京基因型菌株。
六、基因扩增和测序
如表1所示合成引物,分别扩增利福平耐药相关基因rpoB,以及异烟肼耐药相关基因inhA、katG、oxyR-ahpC[7]。扩增体系:2×Taq预混液25 μl,两条引物各0.2 μmol,5 μl基因组DNA。反应条件: 预变性94 ℃ 5 min; 94 ℃ 1 min, 60 ℃ 1 min, 72 ℃ 1 min 35个循环; 72 ℃ 延伸10 min。PCR产物送北京擎科生物技术有限公司测序。测序结果采用在线软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)与标准敏感株H37Rv基因序列进行比对。

表1 本研究所使用的测序引物序列及产物大小
六、 统计学分析
采用SPSS 16.0统计软件进行统计处理,对北京基因型菌株和非北京基因型菌株耐药率、不同人群特征分布情况、不同基因型突变情况进行χ2检验,P<0.05为差异有统计学意义。
结 果
一、不同基因型菌株耐药情况及特征分布
在376株耐多药菌株中,有261株 (69.4%)属于北京基因型,其余115株(30.6%)属于非北京基因型。进一步比较不同基因型菌株的耐药率以及特征,结果表明,北京基因型菌株中氧氟沙星耐药率(31.8%,83/261)和前广泛耐药率(30.7%,80/261)明显高于非北京基因型菌株的氧氟沙星耐药率(17.4%,20/115)和前广泛耐药率(15.7%,18/115),(χ2值分别为8.33和9.32,P值均<0.05)。此外,北京基因型和非北京基因型菌株在人群特征方面分布情况见表2,对抗结核药物耐药情况见表3。
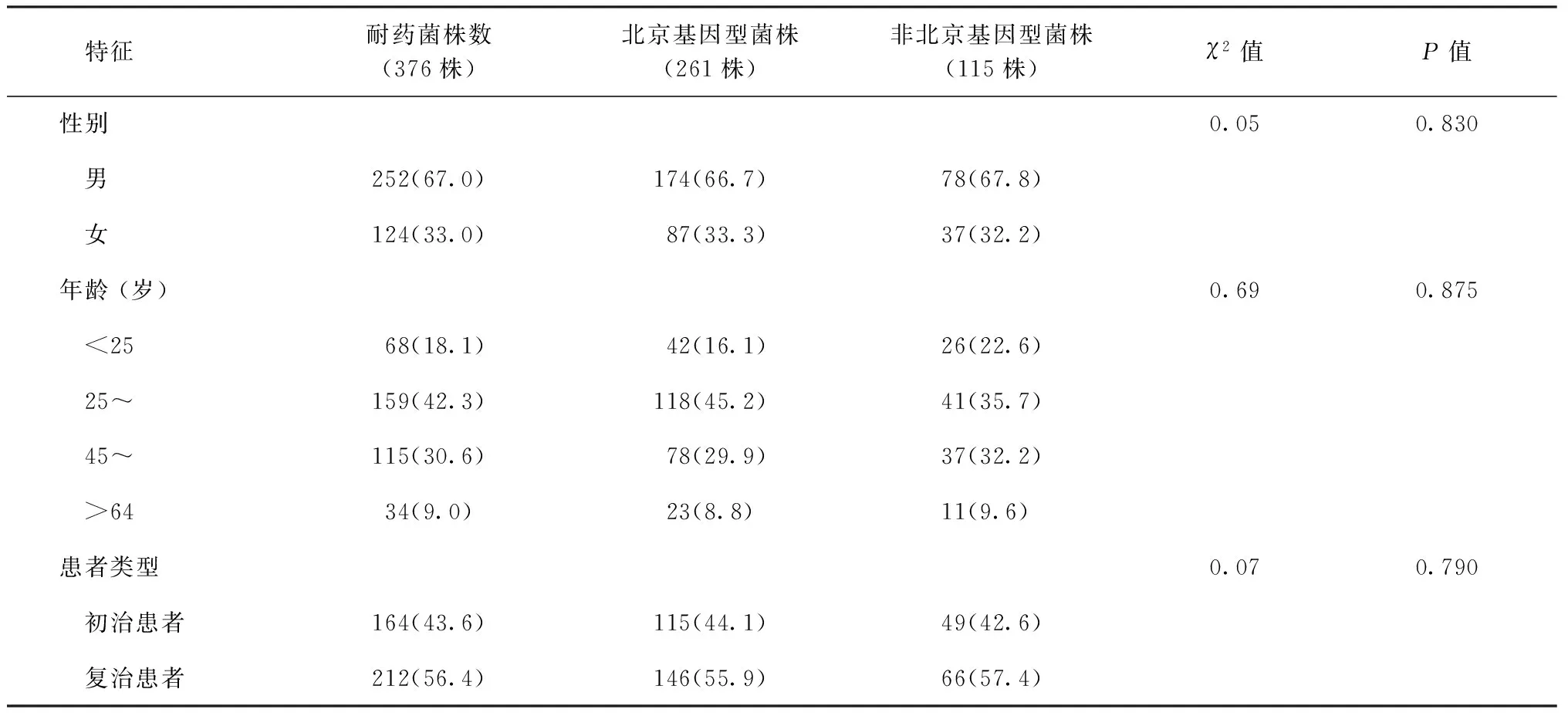
表2 北京基因型菌株和非北京基因型菌株在不同人群特征间的分布情况
注 括号外数值为“耐药菌株数(株)”,括号内数值为“耐药率(%)”
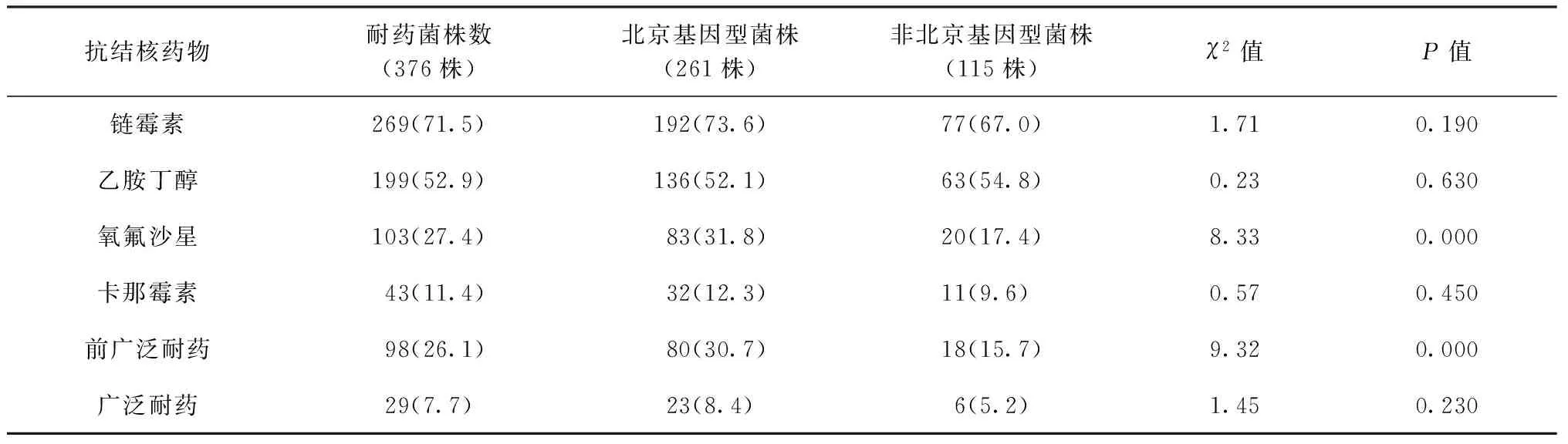
表3 抗结核药物在北京基因型和非北京基因型菌株中的耐药情况
注 括号外数值为“耐药菌株数(株)”,括号内数值为“耐药率(%)”;前广泛耐药定义为对氧氟沙星或卡那霉素中的一种耐药,但不同时耐药的耐多药结核分枝杆菌;广泛耐药定义为同时对氧氟沙星和卡那霉素耐药的耐多药结核分枝杆菌
二、 利福平耐药相关基因突变特征分布
在376株耐多药菌株中,总计有356株(94.7%,356/376)检测到在利福平耐药相关基因rpoB发生基因突变。其中,最常见的突变发生在第531位点,包括238株(63.3%,238/376),上述突变导致丝氨酸突变为亮氨酸的有227株(60.4%,227/376),突变为色氨酸的有10株(2.7%, 10/376),突变为酪氨酸的有1株(0.3%,1/376)。除了第531位点突变,排在第2位的突变发生在第526位氨基酸, 有69株,约占全部菌株的18.4%(69/376)。此外,还有25株突变发生在第516位点,8株在第511位点,3株在第513位点, 9株在第515位点, 2株在第522位点,2株在第533位点。比较北京基因型菌株和非北京基因型菌株中不同位点的突变频率,发现北京基因型菌株第531位点突变频率(67.4%,176/261)明显高于非北京基因型菌株(54.1%, 62/115),差异有统计学意义(χ2=6.28,P=0.010)。与之相反,非北京基因型菌株中未发生rpoB基因突变的菌株(14.8%, 17/115)明显高于北京基因型菌株(1.1%, 3/261),差异有统计学意义(χ2=29.46,P=0.000),见表4。
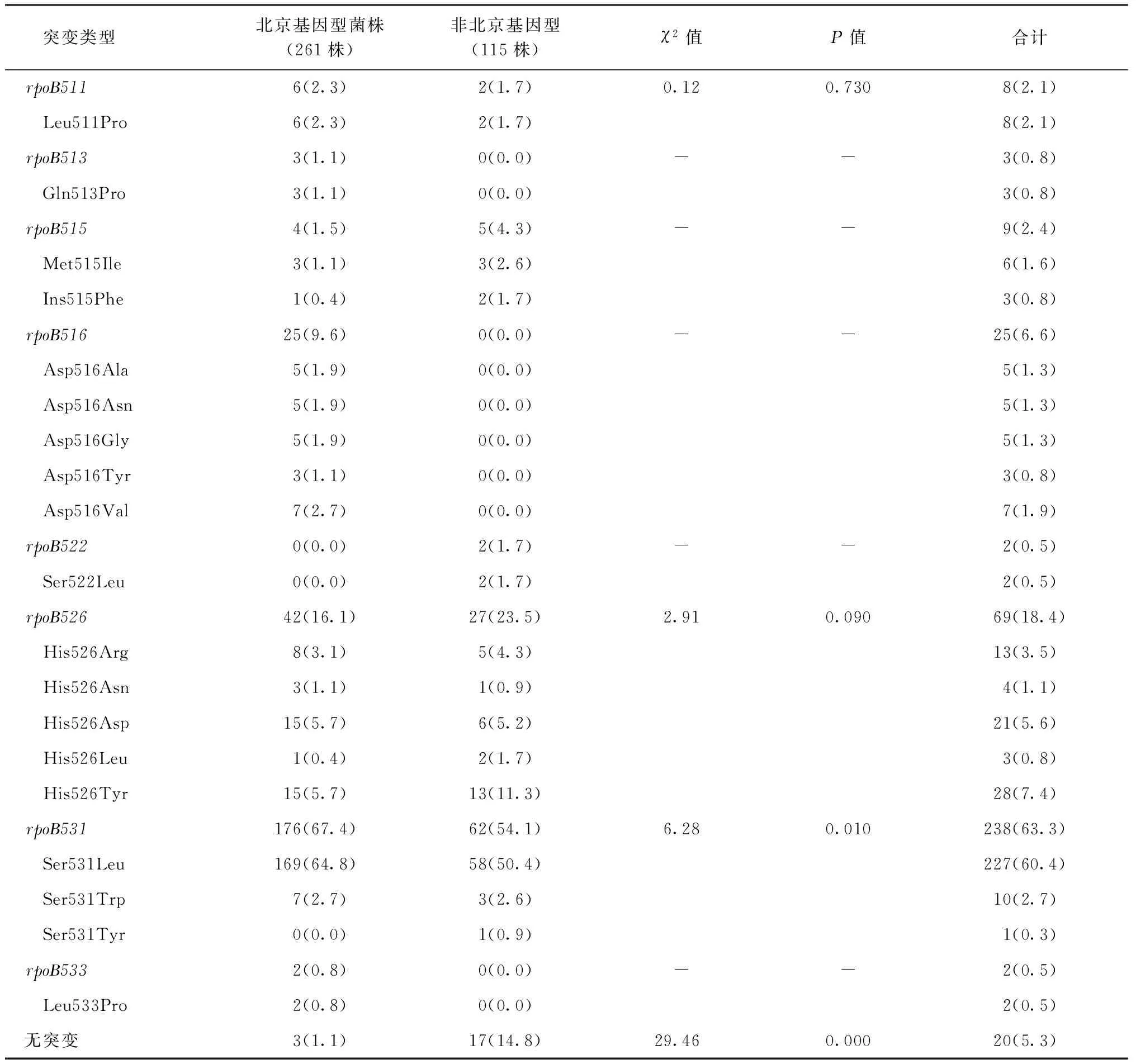
表4 rpoB基因在北京基因型和非北京基因型耐多药菌株中的突变情况
注 表格中括号外数值为“突变菌株数(株)”,括号内数值为“突变率(%)”;“—”:由于样本数量中有一个实际频数为0,因此未进行统计学分析; Leu:亮氨酸;Pro:脯氨酸;Gln:谷氨酰胺; Met:蛋氨酸; Ile:异亮氨酸;Phe:苯丙氨酸;Asp:天冬氨酸;Ala:丙氨酸;Asn:天冬酰胺;Gly:甘氨酸;Tyr:酪氨酸;Val:缬氨酸;Ser:丝氨酸;His:组氨酸;Arg:精氨酸;Trp:色氨酸
三、 异烟肼耐药相关基因突变特征分布
376株耐多药结核分枝杆菌菌株中分别有231株(61.4%, 231/376)携带katG基因突变,67株(17.8%,67/376)携带inhA基因突变,48株(12.8%, 48/376)携带oxyR-ahpC基因突变。其中,最常见的突变发生在katG基因的第315位丝氨酸突变为苏氨酸,总计208株(55.3%)。此外,在第315位点,有16株菌株突变为天冬酰胺,4株突变为异亮氨酸。在对inhA启动子区域及oxyR-ahpC间隔区的序列分析中,发现67株(17.8%)带有inhA突变,其中48株(12.8%)为第-15位点突变;此外,还有48株(12.8%)耐多药菌株oxyR-ahpC区域发生突变,上述区域中最常见核酸突变为-12C/T 和-10C/T,分别有13株(3.5%) 和9株 (2.4%)。北京基因型耐多药菌株(66.3%)带有katG基因突变的频率明显高于非北京基因型菌株(50.4%),差异有统计学意义(χ2=8.46,P=0.000)。而北京基因型和非北京基因型菌株inhA启动子区域突变的频率分别为17.2%和19.1%;oxyR-ahpC间隔区域突变的频率分别为12.3% 和13.9%,两种基因型分布差异均无统计学意义,见表5。
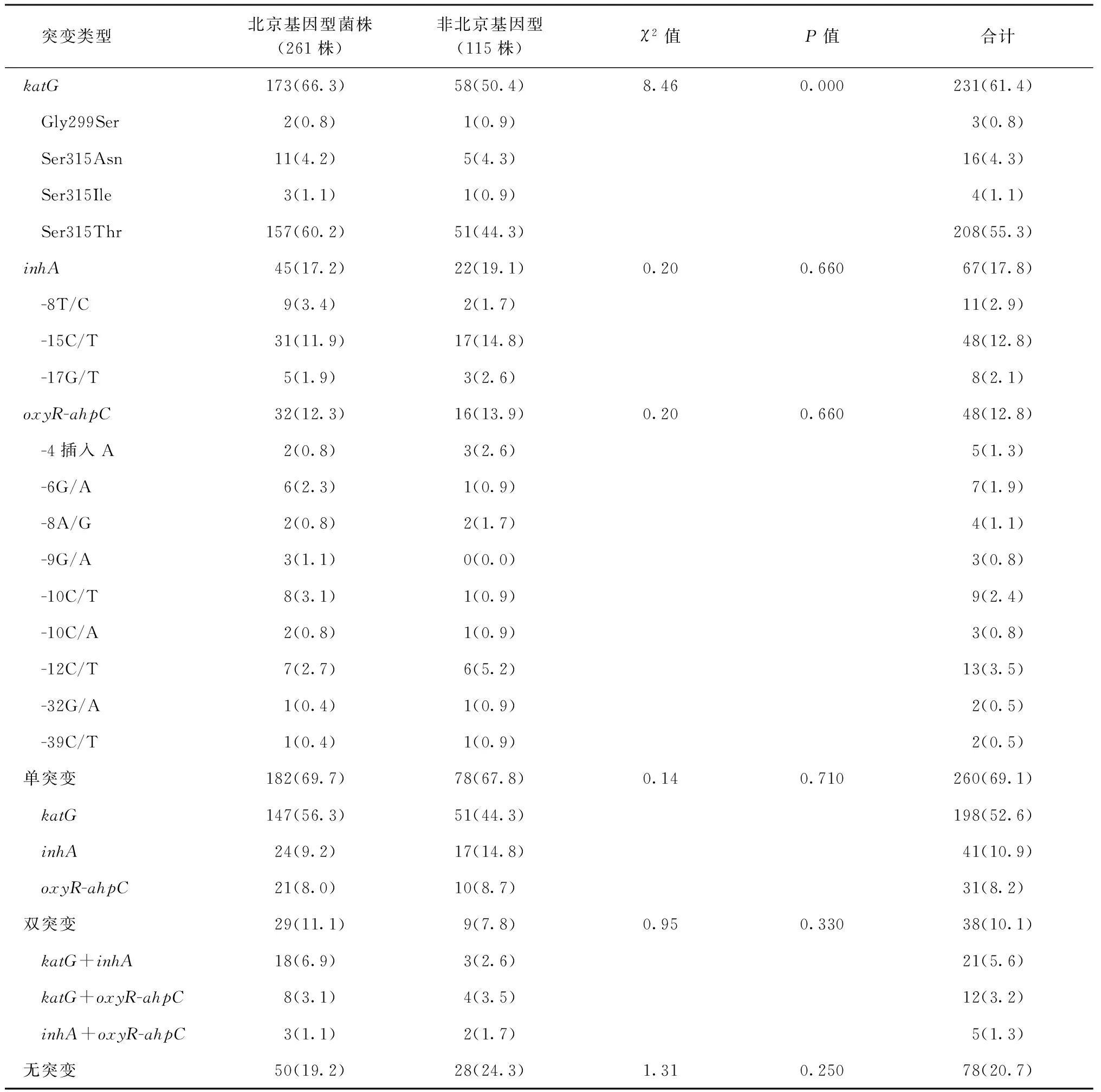
表5 inhA,katG和oxyR-ahpC基因在北京基因型和非北京基因型菌株中的突变情况
注 表格中括号外数值为“突变菌株数(株)”,括号内数值为“突变率(%)”;Gly:甘氨酸;Ser:丝氨酸;Asn:天冬酰胺;Ile:异亮氨酸;Thr:苏氨酸
讨 论
北京基因型菌株是全世界范围内传播范围最广的结核分枝杆菌家族,特别是在东亚、南非以及欧亚大陆北部地区[5]。多篇在中国不同地区进行的研究表明,北京基因型仍是我国耐多药结核分枝杆菌主要基因型,然而不同地区耐多药菌株中北京基因型的比例为73.3%~93.3%[7-9]。许多研究表明,北京基因型与耐药相关,这种特性增加了北京基因型菌株在选择压力下的适应性[10]。与之相反,也有流行病学研究结果表明,北京基因型菌株与非北京基因型菌株在耐药方面无差异[11]。本研究结果显示,北京基因型耐多药菌株氧氟沙星耐药率和前广泛耐药率明显高于非北京基因型菌株。
临床结核分枝杆菌菌株对利福平的耐药性主要归因于rpoB基因的耐药决定区发生突变[12]。本研究发现,94.7%的耐多药菌株带有rpoB基因突变。其中,最常见的突变发生于第531位点(63.3%),与印度(59.0%), 尼泊尔(58.7%)和中国不同地区 (58.3%~61.2%)研究类似[13-14]。此外,来自于德国和俄罗斯的研究表明,北京基因型菌株第531位点突变的频率明显高于非北京基因型菌株,本研究也取得类似发现。同时,我们也发现非北京基因型菌株未发生rpoB基因突变的比例明显高于北京基因型菌株[15-16]。
Pang 等[17]研究表明,异烟肼耐药突变主要发生在katG基因和inhA的启动子区域。本研究中最常见的异烟肼突变发生在katG基因的第315位点(61.4%),其突变频率与江西省(65.8%)和上海市(72.7%)的研究结果类似,而低于俄罗斯(93.6%)和福建省(82.7%)[7-8,16]。此外,oxyR-ahpC间隔区的突变也与异烟肼耐药相关。然而,通常认为该突变在异烟肼耐药菌株中发生频率较低或者伴随katG315位点同时出现[7]。但是本研究结果表明,8.2%的耐多药菌株仅在oxyR-ahpC区域发生了点突变。近年来,多个耐多药结核分枝杆菌检测试剂盒均通过对katG基因和inhA的启动子区域的检测判断异烟肼耐药性[17],基于本研究发现,上述产品可能仅能从我国耐多药结核分枝杆菌患者中发现约75%的异烟肼耐药患者。本研究结果提示,应当将oxyR-ahpC间隔区纳入我国异烟肼耐药快速检测产品中,以提高其敏感度。
[1] 姜世闻, 胡屹, 张慧, 等. 耐药结核病的流行简况. 中国防痨杂志, 2010, 32(6): 351-353.
[2] World Health Organization. Global tuberculosis report 2014. Geneva: World Health Organization, 2014.
[3] 王胜芬, 赵冰, 宋媛媛, 等. 我国耐药结核病的危险因素—2007年全国结核病耐药基线调查资料分析. 中国防痨杂志, 2013, 35(4): 221-226.
[4] 申晓娜, 赵雁林, 肖和平. 结核分枝杆菌药物敏感性表型检测的研究进展. 中国防痨杂志, 2013, 35(6): 463-467.
[5] 逄宇, 夏辉, 姜广路, 等. 中国结核分枝杆菌寡核苷酸基因分型及其耐药性分析. 中华检验医学杂志, 2011, 34(11): 1023-1028.
[6] Liang QF, Pang Y, Chen QY, et al. Genetic profile of tuberculosis among the migrant population in Fujian Province, China. Int J Tuberc Lung Dis, 2013, 17(5): 655-661.
[7] Chen Q, Pang Y, Liang Q, et al. Molecular characteristics of MDRMycobacteriumtuberculosisstrains isolated in Fujian, China. Tuberculosis (Edinb), 2014, 94(2): 159-161.
[8] Zhao M, Li X, Xu P, et al. Transmission of MDR and XDR Tuberculosis in Shanghai, China.PLoS One, 2009, 4(2): e4370.
[9] Yuan X, Zhang T, Kawakami K, et al. Genotyping and clinical characteristics of multidrug and extensively drug-resistant tuberculosis in a tertiary care tuberculosis hospital in China. BMC Infect Dis, 2013, 13: 315.
[10] Almeida D, Rodrigues C, Ashavaid TF, et al. High incidence of the Beijing genotype among multidrug-resistant isolates ofMycobacteriumtuberculosisin a tertiary care center in Mumbai, India.Clin Infect Dis, 2005, 40(6): 881-886.
[11] Zhang Z, Lu J, Wang Y, et al. Prevalence and molecular charac-terization of fluoroquinolone-resistantMycobacteriumtuberculosisisolates in China. Antimicrob Agents Chemother, 2014, 58(1): 364-369.
[12] 逄宇, 李桂莲, 王玉峰, 等. 单耐利福平结核分枝杆菌耐药分子机制研究. 中国防痨杂志, 2012, 34(5): 275-279.
[13] Poudel A, Nakajima C, Fukushima Y, et al. Molecular charac-terization of multidrug-resistantMycobacteriumtuberculosisisolated in Nepal. Antimicrob Agents Chemother, 2012, 56(6): 2831-2836.
[14] Suresh N, Singh UB, Arora J, et al.rpoBgene sequencing and spoligotyping of multidrug-resistantMycobacteriumtuberculosisisolates from India. Infect Genet Evol, 2006, 6(6): 474-483.
[15] Hillemann D, Kubica T, Rüsch-Gerdes S, et al. Disequilibrium in distribution of resistance mutations amongMycobacteriumtuberculosisBeijing and non-Beijing strains isolated from patients in Germany. Antimicrob Agents Chemother, 2005, 49(3): 1229-1231.
[16] Lipin MY, Stepanshina VN, Shemyakin IG, et al. Association of specific mutations inkatG,rpoB,rpsLandrrsgenes with spoligotypes of multidrug-resistantMycobacteriumtuberculosisisolates in Russia. Clin Microbiol Infect, 2007, 13(6): 620-626.
[17] Pang Y, Xia H, Zhang Z, et al. Multicenter evaluation of genechip for detection of multidrug-resistantMycobacteriumtuberculosis. J Clin Microbiol, 2013, 51(6): 1707-1713.
(本文编辑:王然 李敬文)
Analysis on drug resistance-associated mutation among multi-drug resistant tuberculosis strains in China
MENGQing-lin,WANGYu-feng,PANGYu,ZHAOYan-lin.
NationalCenterforTuberculosisControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China
ZHAOYan-lin,Email:zhaoyanlin@chinatb.org
Objective To explore the population structure of multidrug-resistant (MDR) tuberculosis strains and distribution of resistance-associated nucleotide alteration among the MDR strains classified as different genotypes in China. Methods A total of 4017Mycobacteriumtuberculosisisolates were collected from the national drug resis-tance survey of China in 2007. By the proportional method for drug susceptibility testing, 376 isolates identified as MDR isolates were enrolled in this study. The RD105 deletion-targeted multiplex PCR method was used to distinguish the Beijing genotype and non-Beijing genotypes amongst 376 MDR strains. In addition, all the MDR isolates were sequenced for genetic mutations conferring rifampicin (rpoB) and isonizid resistance (katG,inhAandoxyR-ahpC). Results Out of the 376 MDR isolates, 261 (69.4%, 261/376) belonged to Beijing genotype, while the other 115 (30.6%, 115/376) were non-Beijing genotype. The Beijing MDR strains had significantly higher proportions of ofloxacin-resistant (Beijingvs. non-Beijing: 31.8%, 83/261vs. 17.4%, 20/115) and pre-XDR isolates (Beijingvs. non-Beijing: 30.7%, 80/261vs. 15.7%, 18/115) than non-Beijing strains (χ2=8.33, 9.32, allPvalues <0.05). When compared with mutation frequency of different mutant types between Beijing genotype and non-Beijing genotype, the proportion of MDR isolates harboring codon 531 mutation (67.4%, 176/261) andkatGmutation (66.3%, 173/261) among Beijing genotype strains was significantly lower than that of non-Beijing genotype (rpoB:54.1%, 62/115,χ2=6.28,P=0.010;katG:50.4%,58/115,χ2=8.46,P=0.000), while non-Beijing genotype (14.8%, 17/115) showed stronger association with isolates lacking mutation in rifampicin resistance determination region (1.1%,3/261,χ2=29.46,P=0.000). Conclusion In conclusion, Beijing genotype MDR strains revealed a significant association with ofloxacin-resistance. In addition, therpoB531 andkatGmutation was more frequently observed among Beijing genotype strains than non-Beijing strains.
Mycobacteriumtuberculosis; Drug resitance,multiple,baterial; Genotype
10.3969/j.issn.1000-6621.2016.02.009
“十二五”国家重大科技专项(2013ZX10003003);国家自然科学基金(81301509)
102206 北京,中国疾病预防控制中心结核病预防控制中心
赵雁林,Email:zhaoyanlin@chinatb.org
2015-08-22)
