绝经后骨质疏松症患者骨组织JMJD2A、JMJD2B表达变化及意义
2016-05-10郭承张颖唐宏宇董路珏周驰霍少川刘勇刘又文王海彬
郭承,张颖,唐宏宇,董路珏,周驰,霍少川,刘勇,刘又文,王海彬
(1广州中医药大学,广州510405;2河南省洛阳正骨医院;3广州中医药大学第一附属医院)
绝经后骨质疏松症患者骨组织JMJD2A、JMJD2B表达变化及意义
郭承1,张颖2,唐宏宇3,董路珏1,周驰3,霍少川1,刘勇1,刘又文2,王海彬3
(1广州中医药大学,广州510405;2河南省洛阳正骨医院;3广州中医药大学第一附属医院)
目的 观察绝经后骨质疏松症(PMOP)患者骨组织组蛋白去甲基化酶JMJD2表达变化,并分析其与骨密度(BMD)的关系。方法 选择拟行全髋关节置换术的绝经后患者30 例,术前根据股骨颈BMD分为骨质疏松组15例和骨量正常组15例。术中取术侧股骨颈松质骨,采用实时定量PCR法和免疫组化法分别检测骨组织中JMJD2A和JMJD2B mRNA和蛋白表达,并分析其与BMD的关系。结果 与骨量正常组比较,骨质疏松组JMJD2A、JMJD2B mRNA相对表达量和蛋白阳性率均显著降低(P均<0.01)。直线相关分析结果显示,BMD与JMJD2A、JMJD2B mRNA相对表达量均呈正相关(r分别为0.705,0.796,P均<0.01)BMD与JMJD2A、JMJD2B蛋白表达阳性率均呈正相关(r分别为0.606、0.674,P均<0.01)。结论 PMOP患者骨组织JMJD2A和JMJD2B表达均降低,二者可能共同参与了PMOP的发病过程。
骨质疏松症;骨组织;组蛋白去甲基化酶;骨密度
绝经后骨质疏松症(PMOP)是以绝经后出现骨转换率增快,骨量减少,骨组织微细结构破坏,骨强度降低为特征的一种全身性代谢性骨病,而绝经后卵巢功能衰退引起雌激素水平降低是其发病的主要原因[1]。女性绝经后体内雌激素受体(ER)蛋白表达降低、功能减退,提示ER与PMOP的发生密切相关,而ER基因启动子甲基化会抑制蛋白表达,从而影响骨形成和成骨细胞分化[2~4]。尽管最初组蛋白甲基化被认为是一种稳定状态的修饰,但随着对甲基化的深入研究,尤其是组蛋白去甲基化酶JMJD2的发现, 人们认识到组蛋白甲基化修饰存在甲基化和去甲基化的动态调节过程,同时这种动态调节对基因表达及下游效应的发生起着至关重要的作用[5~7]。目前关于JMJD2蛋白家族是否与PMOP患者的异常骨代谢有关的报道较少。为此,我们观察了PMOP患者骨组织JMJD2A、JMJD2B的表达变化,并探讨其与骨密度(BMD)的关系。
1 资料与方法
1.1 临床资料 选择2014年10月~2015年6月广州中医药大学第一附属医院收治、因髋关节骨性关节炎拟行全髋关节置换术的绝经后患者30例。纳入标准:①年龄50~70岁;②自然绝经,停经1年以上。排除标准:①合并严重心脑血管疾病、糖尿病以及肝肾功能不全者;②合并甲状腺功能亢进、类风湿性关节炎等可引起继发性骨质疏松症者; ③有糖皮质类激素应用史者;④半年内服用可能影响骨代谢药物者。患者术前采用法国MEDILINK公司双能X线骨密度仪测量术侧股骨颈BMD,分为骨质疏松组15例(T值<-2.5)和骨量正常组15例(T值>-1.0)。骨质疏松组年龄55~70岁、中位年龄61.4岁,BMI 23.88±2.06,股骨颈BMD(0.72±0.05)g/cm2;骨量正常组年龄50~67岁、中位年龄59.3岁,BMI 24.41±3.14,股骨颈BMD(1.02±0.09)g/cm2。两组年龄、BMI具有可比性。本研究通过广州中医药大学第一附属医院伦理委员会审查,所有患者签署书面知情同意书。
1.2 标本采集方法 两组均行全髋关节置换术,术中采用无菌咬骨钳咬取股骨颈处松质骨,放入冻存管中,立即放入小型液氮罐中,送至-80 ℃冰箱保存,用于实时定量PCR检测。同时咬取体积约为1 cm×1 cm×0.5 cm的松质骨,放入10%甲醛溶液中固定,用于免疫组化检测。
1.3 骨组织JMJD2A、JMJD2B mRNA表达检测 采用实时定量PCR法。取液氮保存的松质骨,采用 King FisherDuo全自动磁珠纯化提取仪(Thermo公司)提取总RNA,全波长酶标仪(Thermo公司)检测总RNA样品的纯度,OD260/OD280控制在1.85~2.00,并用琼脂糖凝胶电泳检测总RNA的完整性。以总RNA为模板,按照PrimeScriptTMRT Master Mix试剂盒(TaKaRa公司)说明书逆转录成cDNA。从GeneBank中获取基因序列,由上海英潍捷基有限公司采用Primer Premier 5.0软件设计合成PCR引物,以β-action为内参,引物序列及长度见表1。根据SYBR®Premix Ex Taq Ⅱ试剂盒(TaKaRa公司)说明书,采用两步法PCR扩增反应程序进行检测。CFX96TMRT-PCR仪(BIO-RAD公司)进行实时定量PCR扩增反应,反应体系25 μL:2×SYBR®Premix Ex TaqⅡ12.5 μL,上、下游引物各1 μL,模板cDNA 2.5 μL,去离子水8 μL。PCR反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环。根据标准曲线显示目标基因和内参基因扩增效率均接近100%,且相互间效率偏差在5%以内。目的基因相对表达量以2-ΔΔCT表示。
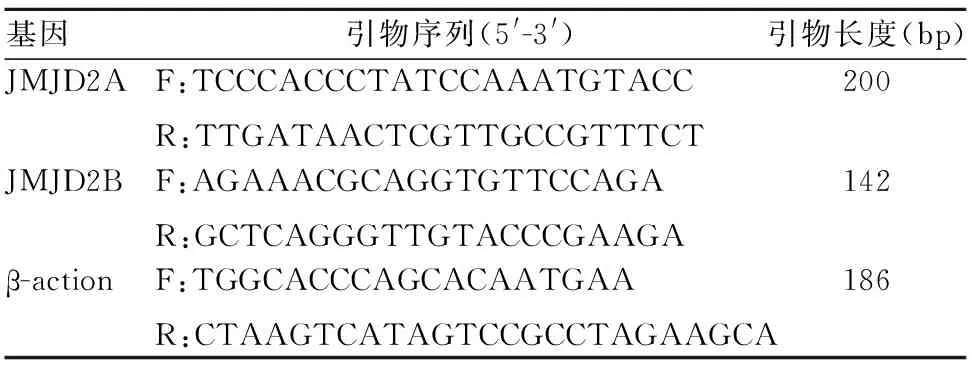
表1 基因引物序列及长度
1.4 骨组织JMJD2A、JMJD2B蛋白表达检测 采用免疫组化法。将放入10%甲醛溶液的松质骨常温下进行固定,PLANK脱钙液脱钙2~3天,期间换脱钙液1次。脱钙完成后用自来水流水冲洗12 h,再进行梯度乙醇脱水、TO透明剂透明、浸蜡,石蜡包埋。病理切片机对石蜡标本进行4 μm厚度切片,将蜡片展于标记的防脱载玻片上,60 ℃烤箱烤片2 h。经脱蜡,抗原修复,封闭,一抗、二抗(CST公司)孵育,DAB显色;苏木素复染,脱水,封片。200倍荧光倒置相差显微镜(Leica公司)下,每张切片随机选取5个视野,观察染色情况。JMJD2A、JMJD2B蛋白阳性表达均定位于细胞核,染色程度评分:阴性着色计0分、淡黄色计1分、棕黄色计2分、棕褐色计3分;阳性细胞百分比评分:0~10%计1分、11%~50%计2分、51%~80%3分、>80%计4分。两评分相乘得0为阴性,1~4为弱阳性,>4为强阳性。弱阳性和强阳性均视为阳性,计算阳性率。
2 结果
2.1 两组骨组织JMJD2A、JMJD2B mRNA表达比较 与骨量正常组相比,骨质疏松组JMJD2A、JMJD2B mRNA相对表达量均显著明显下降(P均<0.01)。见表2。
表2 两组骨组织JMJD2A、JMJD2B mRNA表达比较(相对表达量
注:与骨量正常组比较,*P<0.01。
2.2 两组骨组织JMJD2A、JMJD2B蛋白表达比较 骨质疏松组JMJD2A、JMJD2B蛋白阳性率分别为13.3%、26.7%,骨量正常组分别为66.7%、86.7%;骨质疏松组JMJD2A、JMJD2B蛋白阳性率均低于骨量正常组(P均<0.01)。
2.3 BMD与JMJD2A、JMJD2B表达的关系 直线相关分析结果显示,BMD与JMJD2A、JMJD2B mRNA相对表达量均呈正相关(r分别为0.705、0.796,P均<0.01),与其蛋白表达阳性率均呈正相关(r分别为0.606、0.674,P均<0.01)。校正年龄和BMI后采用偏相关分析结果显示,BMD与JMJD2A、JMJD2B mRNA相对表达量均呈正相关(r分别为0.717、0.787,P均<0.01),与其蛋白表达阳性率均呈正相关(r分别为0.571、0.658,P均<0.01)。
3 讨论
组蛋白甲基化是表观遗传中重要的修饰方式之一,对基因表达的影响具有位点特异性[8],主要发生在组蛋白H3或H4的赖氨酸和精氨酸残基上,又以H3的赖氨酸甲基化最常见,其K4、K9、K27、K36和H4的K20等位点均可被甲基化,且这些位置的赖氨酸残基不仅有单甲基化修饰,还有二甲基化和三甲基化修饰[9]。组蛋白去甲基化酶JMJD2蛋白家族的蛋白序列中均含有组蛋白去甲基化酶标志性结构域Jumonji C(JmjC),除了JmjC结构域之外,这些蛋白质还包含JmJN、PHD和Tudor结构域。JmjC 区域通过氧化反应能催化单、双和三甲基化的赖氨酸残基发生去甲基化,从而发挥生物学功能[7]。研究表明,JMJD2 蛋白可以使双核三甲基化的组蛋白H3蛋白Lys9和Lys36位点去甲基化,且具有转录激活和抑制因子的功能[10,11]。
研究证实,JMJD2A和JMJD2B均可以作为ER的共激活因子而发挥作用[12]。JMJD2A可通过激活ER而促进乳腺癌细胞的增殖;而JMJD2B的表达不仅受到ER和雌激素的调控,还可以与H3的K4位点甲基化酶MLL2结合形成复合物,作为ER的共激活因子发挥功能。JMJD2B首先将ER靶基因启动子H3K9me3去甲基化,之后MLL2启动H3的K4位点甲基化,增加ER靶基因的表达,从而发挥作用[13,14]。因此,我们推测JMJD2A和JMJD2B可能通过雌激素-ER信号通路调节骨代谢和BMD。本研究结果发现,与骨量正常组相比,骨质疏松组JMJD2A、JMJD2B mRNA相对表达量和蛋白阳性率均显著下降;相关性分析显示BMD与JMJD2A、JMJD2B表达均呈正相关。
综上所述,PMOP患者骨组织JMJD2A和JMJD2B表达均降低,并与BMD降低有关,二者可能参与了PMOP的发病过程。本研究为进一步研究PMOP的发病机制提供了依据,但JMJD2A和JMJD2B在骨代谢中的功能和调控机制尚不清楚,仍需进一步研究。
[1] Erdogan MO, Yldz H, Artan S, et al. Association of estrogen receptor alpha and collagen type Ⅰ alpha1gene polymorphisms with bone mineral density in postmenopausal women[J]. Osteoporos Int, 2011,22(4):1219-1225.
[2] Movérare S, Venken K, Eriksson AL, et al. Differential effects on bone of estrogen receptorαand androgen receptor activation in orchidectomized adult male mice[J]. Proc Natl Acad Sci U S A, 2003,100(23):13573-13578.
[3] Lanyon L, Armstrong V, Ong D, et al. Is estrogen receptor α key to controlling bones′ resistance to fracture[J]. Endocrinol, 2004,182(2):183-191.
[4] Lv H, Ma X, Che T, et al. Methylation of the promoter a of estrogen receptor alpha gene in hBMSC and osteoblasts and its correlation with homocysteine[J]. Mol Cell Biochem, 2011,355(1-2):35-45.
[5] Bannister AJ, Schneider R, Kouzarides T, et al. Histone methylation: dynamic or static[J]. Cell, 2002,109(7):801-806.
[6] Shi Y, Lan F, Matson C, et al. Histone demethylation mediated by the nuclear amine oxidase homolog LSD1[J]. Cell, 2004,119(7):941-953.
[7] TsuKada Y, Fang J, Erdjument-Bromage H, et al. Histone demethylation by a family of JmjC domaincontaining proteins[J]. Nature, 2006,439(7078):811-816.
[8] Greer EL, Shi Y. Histone methylation: a dynamic mark in health, disease and inheritance[J]. Nat Rev Genet, 2012,13(5):343-357.
[9] Rivenbark AG, Strahl BD. Unlocking cell fate[J]. Science, 2007,318(5849):403-404.
[10] Klose RJ, Yamane K, Bae Y, et al. The transcriptional repressor JHDM3A demethylates trimethyl histone H3 lysine 9 and lysine 36[J]. Nature, 2006,442(7100):312-316.
[11] Labbe RM, Holowatyj A, Yang ZQ, et al. Histone lysine demethylase(KDM) subfamily 4: structures, functions and therapeutic potential[J]. Am J Transl Res, 2013,6(1):1-15.
[12] Berry WL, Shin S, Lightfoot SA, et al. Oncogenic features of the JMJD2A histone demethylase in breast cancer[J]. Int J Oncol, 2012,41(5):1701-1706.
[13] Gaughan L, Stockley J, Coffey K, et al. KDM4B is a master regulator of the estrogen receptor signalling cascade[J]. Nucleic Acids Res, 2013,41(14):6892-6904.
[14] Shi L, Sun L, Li Q, et al. Histone demethylase JMJD2B coordinates H3K4/H3K9 methylation and promotes hormonally responsive breast carcinogenesis[J]. Proc Natl Acad Sci U S A, 2011,108(18):7541-7546.
国家自然科学基金资助项目(81373655);广东省科技厅项目(2013B021800226)。
王海彬(E-mail: hipman@163.com)
10.3969/j.issn.1002-266X.2016.16.012
R580
B
1002-266X(2016)16-0037-03
2015-11-03)
