不同病理类型肺癌患者孤立性肺结节64排螺旋CT动态增强扫描特点分析
2016-05-10高纪称王君琛梁占东肖战丽杨飞崔书君
高纪称,王君琛,梁占东,肖战丽,杨飞,崔书君
(1廊坊市中医院,河北廊坊065000;2河北北方学院附属第一医院)
不同病理类型肺癌患者孤立性肺结节64排螺旋CT动态增强扫描特点分析
高纪称1,王君琛2,梁占东2,肖战丽2,杨飞2,崔书君2
(1廊坊市中医院,河北廊坊065000;2河北北方学院附属第一医院)
目的 分析不同病理类型肺癌患者的孤立性肺结节64排螺旋CT动态增强扫描特点。方法 选择肺癌患者79例,均伴有孤立性肺结节,病理类型为鳞癌17例、小细胞癌6例、腺癌56例。采用64排螺旋CT对患者行平扫及动态增强扫描,比较不同病理类型孤立性肺结节的CT值变化、达峰时间、强化方式、强化净增值、强化率,动态增强峰值出现后延迟扫描180、300、600 s的相对廓清值及廓清率。结果 不同病理类型孤立性肺结节CT值随延迟扫描时间延长先升高后降低,峰值出现在60~180 s,小细胞癌结节强化达峰时间早于鳞癌和腺癌结节。腺癌结节的强化方式以均匀强化为主(占75.0%),鳞癌结节以不均匀强化为主(占64.7%),小细胞癌结节无明显的强化方式,腺癌和鳞癌结节的强化方式构成比比较有统计学差异(P<0.05)。腺癌与鳞癌结节强化净增值均高于小细胞癌结节(P均<0.05),腺癌与鳞癌结节强化净增值比较差异无统计学意义(P>0.05)。腺癌、鳞癌和小细胞癌结节的强化率比较差异无统计学意义(P>0.05)。腺癌、鳞癌和小细胞癌结节延迟扫描300 s的相对廓清值及廓清率比较无统计学差异(P>0.05),小细胞癌结节延迟扫描180 s相对廓清值、廓清率均高于腺癌、鳞癌结节,腺癌结节延迟扫描600 s的相对廓清值、廓清率均低于鳞癌、小细胞癌结节(P均<0.05)。结论 小细胞癌孤立性肺结节强化达峰时间早,强化净增值低,延迟扫描180 s相对廓清值、廓清率较高;腺癌孤立性肺结节的强化方式以均匀强化为主,延迟扫描600 s相对廓清值、廓清率较低;鳞癌孤立性肺结节的强化方式以不均匀强化为主。
肺癌;孤立性结节;计算机断层扫描;动态增强
孤立性肺结节指直径≤3 cm的全肺惟一圆形或类圆形孤立性病灶,通常不伴有肺不张、卫星病灶和局部淋巴结肿大[1]。孤立性肺结节具有较高的恶性率,早期诊断对于改善患者预后具有重要意义,但是结节病变性质的判断及鉴别一直是影像医学中的重点及难点[2,3]。多层螺旋CT对孤立性肺结节的检出率较高,随着CT动态增强技术的发展,国内外很多学者开始关注孤立性肺结节的CT动态增强扫描特点[4~6]。本研究以79例经病理证实、伴孤立性肺结节的肺癌患者为研究对象,分析其64排螺旋CT动态增强扫描特点,为临床鉴别其性质提供依据。
1 资料与方法
1.1 临床资料 选择2007年5月~2011年7月廊坊市中医院收治的肺癌患者79例,均伴有孤立性肺结节,男51例、女28例,年龄42~78(59.39±1.21)岁;均经病理检查证实,其中鳞癌17例、小细胞癌6例、腺癌56例。纳入标准:结节均为孤立性,直径≤30 mm;均经手术切除或穿刺病理证实为肺癌结节;结节内不伴空洞。本研究患者均知情同意。
1.2 64排螺旋CT平扫及增强扫描方法 采用Aquilion 64排螺旋CT机,管电压80 kV、管电流150 mA,探测器准直为0.5 mm×64,球管旋转速度0.5 s/周,层厚及层距均为1 mm。患者取仰卧位,浅呼吸屏气后扫描且保证重复扫描时屏气深度相同。平扫范围自肺尖至双肾上极,观察结节部位并以此确定增强扫描部位及范围,确保结节整体位于扫描野内(结节直径≤2 cm者扫描范围为4 cm,结节直径2~3 cm者扫描范围为5 cm)。增强扫描使用双管高压注射器,经肘正中静脉以4~5 mL/s的速度注射非离子对比剂碘海醇(350 mgI/mL)80~100 mL,对比剂注射完成后以相同速度团注生理盐水20 mL,以减少上腔静脉伪影。造影剂注入后选择7个序列(30、60、90、120、180、300、600 s)进行扫描,纵隔窗(窗宽350 HU,窗位50 HU)。感兴趣区的选取:选择结节中心层面、连续上下各一层作为测量层面,每一层选取三个感兴趣区(均避开出血、坏死、钙化等),直径约为测量层面半径,多个序列感兴趣区尽量保持一致。感兴趣区的放置均由同一名观察者完成。
1.3 相关指标观察 ①各序列CT值:采用标准算法重建图像,计算不同病理类型孤立性肺结节平扫及增强各序列CT值,并绘制平扫及增强各序列时间-密度曲线,观察达峰时间。②强化方式:根据何超等[3]的方法评价孤立性肺结节强化方式,将其分为无强化(强化值<5 HU)、均匀强化(增强后无肉眼辨认密度不均匀区)、不均匀强化(增强后肉眼所见密度不均匀)、周围强化(中心部分无强化)和包膜样强化。③强化净增值:为增强后扫描序列内最大CT值减去平扫CT值。④强化率:为强化净增值与平扫CT值的百分比。⑤相对廓清值及廓清率:记录不同病理类型孤立性肺结节动态增强峰值出现后延时扫描180、300、600 s的相对廓清值及廓清率,相对廓清值为各时间点CT值与最大CT值之差,廓清率为各时间点廓清值与最大CT值的百分比。各指标测量均由同一名观察者完成。
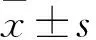
2 结果
2.1 不同病理类型孤立性肺结节CT值变化 不同病理类型孤立性肺结节CT值随时间延长先升高后降低,峰值出现在60~180 s,小细胞癌结节强化达峰时间早于鳞癌和腺癌结节。不同病理类型孤立性肺结节平扫及增强各序列CT值见表1,时间-密度曲线见插页Ⅲ图4。
2.2 不同病理类型孤立性肺结节强化方式比较 腺癌结节以均匀强化为主(占75.0%),鳞癌结节以不均匀强化为主(占64.7%),小细胞癌结节无明显的强化方式。腺癌和鳞癌结节的强化方式构成比比较,P<0.05。见表2。
2.3 不同病理类型孤立性肺结节强化净增值及强化率比较 腺癌与鳞癌结节强化净增值均高于小细胞癌结节(P<0.05),腺癌与鳞癌结节强化净增值比较差异无统计学意义(P>0.05)。腺癌、鳞癌和小细胞癌结节的强化率比较差异无统计学意义(P>0.05)。见表3。
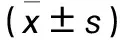
表1 不同病理类型孤立性肺结节平扫及增强各序列CT值
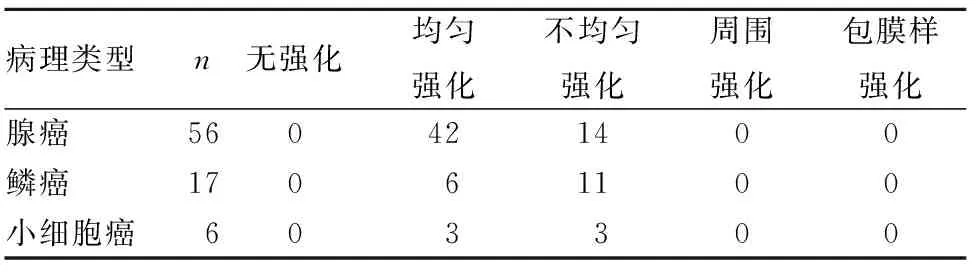
表2 不同病理类型孤立性肺结节强化方式比较(例)
2.4 不同病理类型孤立性肺结节相对廓清值及廓清率比较 腺癌、鳞癌和小细胞癌结节延迟扫描300 s的相对廓清值及廓清率比较无统计学差异(P>0.05)。小细胞癌结节延迟扫描180 s的相对廓清值、廓清率均高于腺癌、鳞癌结节,腺癌结节延迟扫描600 s的相对廓清值、廓清率均低于鳞癌、小细胞癌结节(P均<0.05)。见表4。
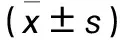
表3 不同病理类型孤立性肺结节强化净增值及强化率比较
注:与小细胞癌比较,*P<0.05。
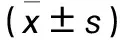
表4 不同病理类型孤立性肺结节相对廓清值及廓清率比较
注:与腺癌比较,*P<0.05;与鳞癌比较,#P<0.05。
3 讨论
本研究显示,腺癌与鳞癌结节在强化方式构成比例上有所区别,腺癌以均匀强化为主,而鳞癌以不均匀强化为主。国内外研究报道,腺癌癌巢均匀分布,且易出现间质胶原纤维反应,在肿瘤间质中形成网格状、多而宽的纤维间隔,肿瘤实质由丰富的筛孔状微小血管网供血,不易发生坏死,故腺癌结节多呈均匀强化;而鳞癌结节不均匀强化与其癌巢分布极不均匀,易发生斑点状及斑片状坏死有关[7~9]。因此,根据孤立性肺结节的强化方式可以大致推断其病理性质。
不同病理类型的孤立性肺结节具有不同的血流动力学特征,导致其时间-密度曲线存在差异[10]。本研究结果显示,腺癌与鳞癌结节强化净增值均高于小细胞癌结节,而腺癌、鳞癌和小细胞癌结节的强化率比较差异无统计学意义。黄维荪等[11]研究发现,肿瘤分化程度与G蛋白信号通路调节蛋白5(RGS5)的表达呈正相关,而RGS5表达与新生血管密度呈负相关。由于不同病理类型的肺癌结节分化程度不同,其实质及间质内存在的微小新生血管数量和血管壁管腔的强化程度也不同。本研究小细胞癌结节强化达峰时间早于非小细胞癌结节,可能原因是本研究收集的小细胞癌均为低分化型,其新生血管密度大,血管完整性差,血液很快渗透到肿瘤间质内;而且分化程度低的肿瘤呈快速浸润性生长,瘤巢间隙增大,阻力减小,造影剂滞留时间短,导致小细胞癌结节强化净增值低,增强达峰时间早。陈绪珠等[12]研究显示,周围型肺癌的增强幅度与病理类型无关,与本研究结果不一致,可能与患者的肿瘤组织分化程度不同有关,有待于扩大样本量进一步研究验证。
本研究结果显示,腺癌结节延迟扫描600 s的相对廓清值、廓清率均低于鳞癌、小细胞癌结节。分析原因,对比剂是通过血管及血管外间质在肺内完成运输的,因此在病变中的廓清途径也分为血管内廓清和血管外间隙淋巴回流廓清两种,如果对比剂廓清途径明显受阻,就会呈现延迟、持续强化[13,14]。腺癌易出现间质胶原纤维反应,在间质中易形成纤维间隔,大量纤维组织使血管外间隙淋巴回流廓清途径受阻,致使对比剂滞留在纤维间质中的时间延长。
综上所述,64排螺旋CT动态强化特点在肺癌患者孤立性肺结节定性诊断方面具有重要的临床价值。动态增强CT扫描不仅可以观察孤立性肺结节的形态,而且可联合对比剂流入及流出等诸多参数综合分析其病变特点,提高不同病理类型肺癌患者孤立性肺结节的诊断率。本研究的不足之处为未依据结节的大小进行分组研究、样本量较小、CT增强扫描采集时间不够密集等,将会在以后的研究中进一步完善。
[1] 刘立雄,谭理连,李志铭,等.320层容积CT灌注成像诊断肺孤立性结节[J].中国医学影像技术杂志,2013,29(5):722-726.
[2] 张玉立,张雪梅.孤立性肺结节CT灌注成像灌注参数的Meta分析[J].中国CT和MRI杂志,2013,11(2):22-25.
[3] 何超,林万里,任巧文.孤立性肺结节应用CT动态增强扫描鉴别良恶性的特异度与灵敏度[J].中国CT和MRI杂志,2014,12(3):67-69,99.
[4] 高鹏宇,徐兵智.多层螺旋CT动态增强扫描在孤立性肺结节中的应用价值[J].临床肺科杂志,2013,18(9):1651-1652.
[5] Zhang M, Kono M. Solitary pulmonary nodules: evaluation of blood flow pattems with dynamic CT[J]. Radiology, 1997,205(2):471-478.
[6] Swensen SJ, Brown LR, Colby TV, et al. Pulmonary nodules: CT evaluation of enhancement with iodinated contrast material[J]. Radiology, 1995,194(2):393-398.
[7] 常娜,李云,陈清亮,等.孤立性肺结节的CT诊断研究进展[J].罕少疾病杂志,2011,18(1):52-55.
[8] Yamashita R, Matsunobe S, Tarahashi R, et al. Small peripheral lung car-cinoma evaluated with incremental dynamic CT: radiology-pathologic correlation[J]. Radiology, 1995,196(2):401-408.
[9] Kumar V, Abbas AK, Fauston N. Robbins and cotran pathologic basis of disease[M]. Philadelphia: Elsevion Saunders, 2005:743-744.
[10] Sim YT, Goh YG, Dempsey MF, et al. PET-CT evaluation of solitary pulmonary nodules: correlation with maximun standardized uptake value and pathology[J]. Lung, 2013,191(6):625-632.
[11] 黄维荪,王靖华,陈龙邦,等.胃癌GRS5蛋白的表达及其与肿瘤组织分化程度和血管生成的关系[J].临床肿瘤学杂志,2010,15(4):319-322.
[12] 陈绪珠,孔庆奎,安丰新.周围型肺癌CT增强幅度与其病理类型的相关性分析[J].实用医学影像杂志,2005,6(5):272-273.
[13] Tateishi U, Nishihara H, Watanabe S, et al. Tumor angiogenesis and dynamic CT in lung andenocarcinoma:radiologic-pathologic correlation[J]. Comput Assist Tomogr, 2001,25(1):23-27.
[14] Jeong YJ, Lee KS, Jeong SY, et al. Solitary pulmonary nodule: characterization with combined wash-in and washout features at dynamic multi-detector row CT[J]. Radiology, 2005,237(2):675-683.
Characteristic analysis of dynamic enhanced 64 row-spiral CT for solitary lung cancer nodules with different pathological patterns
GAOJichen1,WANGJunchen,LIANGZhandong,XIAOZhanli,YANGFei,CUIShujun
(1LangfangHospitalofTraditionalChineseMedicine,Langfang065000,China)
Objective To analyze the characteristics of dynamic enhanced 64 row-spiral computerized tomography (CT) for solitary lung cancer nodules with different pathological patterns. Methods Seventy-nine patients with histologically confirmed solitary lung cancer nodules were enrolled. According to the pathological type classification, there were 17 cases of patients with squamous-cell carcinoma, 6 cases of patients with small cell lung cancer and 56 cases of patients with adenocarcinoma. All patients received plain scan and dynamic-enhanced scan by using 64 row-spiral CT. We recorded the numerical changes, tmax, intensive way, intensive net added value, reinforcement ratio and expurgation rate in delayed scanning of 180 seconds, 300 seconds and 600 seconds after dynamic-enhanced peak value. Results The CT values of all kinds of solitary lung cancer nodules first increased and then decreased with the prolonged time, and the peak appeared in 60-180s. The time to peak of the small cell lung cancer nodules appeared earlier than the other two types. About 75% adenocarcinoma nodules were evenly reinforced, about 64.7% squamous-cell carcinomas nodules were unevenly reinforced, the small cell lung cancer nodules had no obvious way of strengthening. Significant difference was found in the constituent ratio of schedule of reinforcement between adenocarcinoma and squamous cell carcinoma (P<0.05). The reinforced net added value of adenocarcinoma and squamous-cell carcinoma was higher than that of the small cell lung cancer nodules (P<0.05). The reinforced net added value of nodules in the adenocarcinoma and squamous cell carcinoma had no statistically significant difference (P>0.05). The nodule reinforcement rate of all type had no statistically significant difference in delayed scanning of 300 seconds (P>0.05). The relatively clear value and expurgation rate in delayed scanning of 180 seconds of the small cell lung cancer was higher than the other two types, and the relatively clear value and expurgation rate in delayed scanning of 600 seconds of the adenocarcinoma was lower than the other two types (allP<0.05). Conclusions The small cell lung cancer has a low tmax, low intensified net added value, and the relatively clear value and expurgation rate after 180 s is higher. The reinforcement of adenocarcinoma is uniform and it has a low relatively clear value and expurgation rate after 600 s. The reinforcement of squamous-cell carcinoma is non-uniform.
lung carcinoma; isolated nodules; computerized tomography; dynamic enhancement
张家口市科技攻关计划项目(11110013D)。
高纪称(1977-),女,主治医师,研究方向为胸部影像诊断。 E-mail: 517153922@qq.com
崔书君(1966-),男,主任医师,研究方向为肺小结节及慢性阻塞性肺病。E-mail: 13932316949@126.com
10.3969/j.issn.1002-266X.2016.16.007
R734.2
A
1002-266X(2016)16-0023-04
2016-01-18)
