丝素蛋白三维支架与骨髓间充质干细胞的生物相容性观察
2016-05-10范青洪余锋吴术红杨晋金瑛刘毅
范青洪,余锋,吴术红,杨晋,金瑛,刘毅
(1遵义医学院附属医院,贵州遵义563000;2仁怀市人民医院)
丝素蛋白三维支架与骨髓间充质干细胞的生物相容性观察
范青洪1,余锋2,吴术红1,杨晋1,金瑛1,刘毅1
(1遵义医学院附属医院,贵州遵义563000;2仁怀市人民医院)
目的 制备丝素蛋白三维支架,并与大鼠骨髓间充质干细胞(MSCs)复合培养,观察二者的生物相容性。方法 将家用蚕丝反复脱胶,计算脱胶率;将脱胶的蚕丝溶于LiBr溶液中获得丝素蛋白溶液,置于真空冷冻干燥机中作用24 h,获得成型的丝素蛋白三维支架。液体置换法计算支架孔隙率;将该支架与MSCs复合培养,记录支架降解1~8周降解液的pH值变化,MTT法检测支架的细胞毒性(以吸光度值表示),扫描电镜下观察支架结构及MSCs生长情况。结果 平均脱胶率为20.72%,平均支架孔隙率为65.25%。复合培养1~8周降解液pH值分别为6.98、6.93、6.90、6.83、6.72、6.75、6.78、6.76。两组吸光度值比较,P均>0.05。扫描电镜下观察到该支架具有三维空间结构,孔隙大小分布较均匀;复合物中可见MSCs在支架上生长良好,部分细胞嵌入支架孔隙中,与支架黏附良好;细胞外基质分泌量多,细胞与细胞间、细胞与支架间通过细胞外基质紧密相连。结论 成功制备丝素蛋白三维支架,该支架对MSCs无毒性作用,具有良好的生物相容性,是一种理想的韧带组织工程学支架材料。
丝素蛋白三维支架;组织工程;骨髓间充质干细胞;生物相容性
组织工程技术是修复组织或器官缺损的一种新方法,是目前医学研究的热点。不同组织或器官缺损修复所需要的种子细胞与支架不同,而种子细胞、支架材料以及二者的复合是组织工程技术的三大核心点。大鼠骨髓间充质干细胞(MSCs)是目前研究较为成熟的种子细胞之一,丝素蛋白为天然高分子纤维蛋白,具有良好的生物相容性和力学特性[1]。2013年3月~2014年12月,本研究采用冷冻真空干燥法制备丝素蛋白三维支架,并观察其与MSCs复合培养的生物相容性。
1 材料与方法
1.1 材料 天然蚕丝由西南大学纺织学院提供。LG-DMEM培养基:LG-DMEM粉剂10 g、HEPES 3.2 g,三蒸水搅拌混匀,定容至1 000 mL;将pH值调至7.2,滤膜过滤(0.22 μm)灭菌,分装后4 ℃保存。完全培养基:10 mL胎牛血清、1 mL双抗(青霉素、链霉素各100 U/mL)、1 mL谷氨酰胺及88 mL LG-DMEM培养基。MTT溶液:MTT粉末250 mg+PBS缓冲液50 mL,浓度5 mg/mL,避光保存。真空冷冻干燥机购于无锡市海昌机械设备有限公司。
1.2 实验方法
1.2.1 丝素蛋白三维支架制备 采用冷冻真空干燥法。称取蚕丝,采用Na2CO3作为脱胶剂,脱胶条件:试剂浓度0.4%,温度98 ℃,脱胶时间30 min,水浴比为1∶100。连续脱胶2次,取出脱胶后的蚕丝,用三蒸水洗净,置入56 ℃烘箱中烘干,称质量。取2 g脱胶后的蚕丝溶于9 mol/L LiBr溶液,水浴比为1∶50。溶丝过程中不断均匀搅拌,并适当加热,待完全溶解后冷却至室温。倒入中等分子量半透膜中,两端封闭,以流水透析72 h。收集透析袋中的溶液,即为丝素蛋白溶液,4 ℃保存备用。将上述丝素蛋白溶液用三蒸水稀释至100 mL,配成浓度为2%的丝素蛋白溶液;分装到24孔细胞培养板中(底面直径约1.56 mm,厚度约5 mm),-80 ℃冰箱中过夜。在放入真空冷冻干燥机前一天,取出该24孔板,弃去孔板上盖,以封口膜完全封闭,用粗针头在封口膜上戳3~5个小孔,继续-80 ℃保存。当丝素蛋白凝固后迅速放入真空冷冻干燥机中,作用条件:温度-50 ℃,压力0.5 MPa,持续时间24 h。取出模板,即可获得成形的丝素蛋白三维支架。
1.2.2 丝素蛋白三维支架与MSCs的体外复合培养 取上述支架,干燥后环氧乙烷消毒,无菌条件下干燥后保存;在支架与MSCs复合前一夜,无菌条件下将支架取出放入6孔板中,用含10%胎牛血清的LG-DMEM培养基浸润、包被,使培养基充分浸入支架,超净台中过夜。将MSCs按1×106/mL接种于支架上,采用半换液方式2~3天换液一次,每次换液量为原培养液的1/2~2/3。
1.3 相关指标观察
1.3.1 脱胶率 根据脱胶前后蚕丝的质量,计算脱胶率;重复6次,取平均值。
1.3.2 支架孔隙率 采用液体置换法。取10 mL正乙烷,记录体积为V1;将1个支架放入正乙烷中,作用10 min,确保支架完全浸入正乙烷中,记录体积为V2;取出支架,记录此时剩余正乙烷体积为V3。采用如下公式计算,支架孔隙率(%)=(V2-V1)/(V2-V3)×100%。重复5次,取平均值。
1.3.3 降解液pH值 将制备好的支架经环氧乙烷消毒后放入完全培养基中,观察支架降解1~8周降解液的pH值变化情况。
1.3.4 细胞毒性 取上述支架作为观察组,取MSCs进行常规培养作为对照组。采用MTT法检测两组培养第1、3、5、7、9天的吸光度值(A值),A值越高,说明细胞数量越多,支架对细胞的毒性越小。重复30次,取平均值。
1.3.5 支架结构及MSCs生长情况 将MSCs与支架复合培养至第5天,进行扫描电镜下观察。方法如下:沿培养孔壁完全吸去培养液,加入2.5%戊二醛溶液固定,要求溶液体积至少为复合物体积的5~10倍,作用2 h;吸出戊二醛,D-PBS液洗涤3次;经梯度乙醇脱水、中间液代换、临界点干燥后,用导电胶将样品黏贴在样品台上,观察面朝上。采用离子溅射真空镀膜法喷镀导电金属,完成镀金后,扫描电镜下观察支架结构及MSCs生长情况。
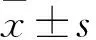
2 结果
2.1 脱胶率及支架孔隙率 6次脱胶率检测分别为21.49%、19.74%、21.45%、19.89%、20.98%、20.79%,平均脱胶率为20.72%。5次支架孔隙率检测分别为65.63%、65.71%、67.86%、62.96%、64.10%,平均支架孔隙率为65.25%。
2.2 降解液pH值 支架降解1~8周降解液pH值分别为6.98、6.93、6.90、6.83、6.72、6.75、6.78、6.76。
2.3 细胞毒性 观察组及对照组培养第1、3、5、7、9天的A值比较,P均>0.05。见表1。
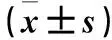
表1 观察组及对照组细胞毒性比较
2.4 支架结构及MSCs生长情况 扫描电镜下观察到该支架具有三维空间结构,孔隙大小分布均匀。复合物中可见MSCs在支架上生长良好,部分细胞嵌入支架孔隙中,与支架黏附良好;细胞外基质分泌量多,细胞与细胞间、细胞与支架间通过细胞外基质紧密相连。
3 讨论
临床中将丝素纤维作为手术缝线已有100多年的历史,除此以外,丝素蛋白还广泛用于血管、角膜及其他生物医用材料中[2]。研究表明,丝素蛋白具有良好的生物相容性和力学特性,且降解性能缓慢,是作为韧带组织工程材料的最佳选择之一[3~5]。蚕丝中的丝胶具有一定的免疫原性,故试验中需要反复脱胶以减少丝胶残留[6,7]。周燕等[8]研究表明,采用Na2CO3脱胶对丝素纤维的结构和降解性能有明显影响,其浓度越大,纤维表面的刻蚀越显著。本研究中,丝素平均脱胶率为20.72%,说明脱胶较彻底。
Greenwald等[9]将丝素纤维植入大鼠皮下6周后,发现其强力损失55%,弹性模量损失16%。Soong等[10]将丝素纤维和冷冻真空干燥法制成的丝素神经导管植入兔皮下24周,发现丝素神经导管质量基本损失,而丝素纤维质量减少到65.7%,但仍保持着完整的结构。以上均说明,丝素纤维是可以降解的,但降解速率可能与外界环境的理化作用、患者的生理特点、丝素纤维处理过程中蛋白质结构的变化等因素有关[11,12]。
支架的孔隙及孔隙率对细胞的生长、增殖及转移具有重要意义。目前主要是通过扫描电镜采集图片以测量分析支架孔隙,或采用液体置换法计算孔隙率,而多大的孔隙率适合细胞的生长少见报道。杨亚冬等[13]研究发现,随壳聚糖比例增加,支架孔隙减小,孔隙率明显升高,但无论是大孔隙+小孔隙率,还是小孔隙+高孔隙率,其力学性能均不如将丝素/壳聚糖按5∶5及4∶6制成的支架。所以孔隙率的大小既不能影响骨架的力学性能,又要有利于营养物质与细胞基质的传输、转移。本研究中支架的平均孔隙率为65.25%。理论上孔隙率越高,越有利于细胞的植入,但其力学特性也越小,而丝素蛋白浓度与孔隙率的具体关系及细胞生长所需的最佳孔隙率还有待进一步研究证实。
本研究中支架降解前5周pH值逐渐下降,最低时达到6.72;5周后pH值趋于稳定,均不超过6.80,该pH值变化对细胞生长几乎无影响。而且观察组和对照组培养第1、3、5、7、9天的A值比较无统计学差异,说明支架材料对MSCs无明显毒性作用。扫描电镜下观察到该支架具有三维空间结构,孔隙大小分布均匀;复合物中可见MSCs在支架上生长良好,细胞外基质分泌量多,细胞与细胞间、细胞与支架间通过细胞外基质紧密相连。以上均说明丝素蛋白三维支架对大鼠MSCs具有良好的亲和力及生物相容性,能促进细胞外基质的分泌,同时支架材料降解过程中对细胞无明显毒性作用。
综上所述,本研究成功获得具有一定孔隙率的丝素蛋白三维支架,该支架对MSCs无毒性作用,具有良好的生物相容性,是一种理想的韧带组织工程学支架材料。
[1] 刘毅,张承昊,范青洪,等.TGF-β1和bFGF-1对单层共培养MSCs和韧带成纤维细胞韧带特异性的影响[J].中国修复重建外科杂志,2014,28(11):1406-1412.
[2] Bucknall TE, Tearel L, Ellis H. The choice of a suture to close abdominal incisions[J]. Eur Surg Res, 1983,15(2):59-66.
[3] Cao Y, Wang B. Biodegradation of silk biomaterials[J]. Int J Mol Sci, 2009,10(4):1514-1524.
[4] Wang Y, Rudym DD, Walsh A, et al. In vivo degradation of three-dimensional silk fibroin scaffolds[J]. Biomaterials, 2008,29(24-25):3415-3428.
[5] Kim UJ, Park J, Kim HJ, et al. Three dimensional aqueous-derived biomaterial scaffolds from silk fibroin[J]. Biomaterials, 2005,26(15):2775-2785.
[6] Hartmann DJ, Charriere G, Richard-Blum S, et al. Immunogenicity of injectable collagen implants[J]. J Dermatol Surg Oncol,1990,16(4):394-398.
[7] Meinel L, Hofmann S, Karageorgiou V, et al. The inflammatory responses to silk films invitro and invivo[J]. Biomaterials, 2005,26(2):147-155.
[8] 周燕,吴惠英,左保齐.碳酸钠质量浓度对蚕丝脱胶效果及丝素纤维结构与降解性能的影响[J].丝绸,2015,52(3):16-20.
[9] Greenwald D, Shumway S, Albear P, et al. Mechanical comparison of 10 suture materials before and after in vivo incubation[J]. J Surg Res, 1994,56(4):372-377.
[10] Soong HK, Kenyon KR. Adverse reactions to virgin silk sutures in cataract surgery[J] . Ophthalmology, 1984,91(5):479-483.
[11] Li M, Ogiso M, Minoura N. Enzymatic degradation behavior of porous silk fibroin sheets[J]. Biomaterials, 2003,24(2):357-365.
[12] Salthouse TN, Matlaga BF, Wykoff MH. Comparative tissue response to six suture materials in rabbit comea, sclera, and ocularmuscle[J]. Am J Ophthalmol, 1977,84(2):224-233.
[13] 杨亚冬,张文元,房国坚.丝素-壳聚糖复合制作的三维可降解多孔支架[J].中国组织工程研究与临床康复,2009,13(51):100704-100708.
Biocompatibility between three dimensional silk fibroin scaffolds and BMSCs
FANQinghong1,YUFeng,WUShuhong,YANGJin,JINYing,LIUYi
(1TheAffiliatedHospitalofZunyiMedicalCollege,Zunyi563000,China)
Objective To prepare the three-dimensional (3-d) silk fibroin scaffolds and culture it with bone marrow mesenchymal stem cells (BMSCs), and to discuss the biocompatibility between them. Methods Degumming and calculating the loss rate, then dissolving the silk with LiBr to get the silk fibroin liquor. We put the silk fibroin liquor in vacuum freeze drying machine, and let it work for 24 hours under a specific condition to get the 3-d scaffolds. Measuring the porosity of the scaffold, culturing the scaffold with BMSCs, and PH of the medium from the first to eighth weeks was recorded. the cytotoxic effect was detected by MTT, and the framework and the growth of cells on the scaffold were observed by scanning electron microscope (SEM). Results The degumming percentage of silk fibroin was 20.72%, and the porosity of 3-d silk fibroin scaffolds was 65.25%. In the 1-8 weeks, the PH values were 6.98, 6.93, 6.90, 6.83, 6.72, 6.75, 6.78 and 6.76. No significant difference was found in the optical density between these two groups (P>0.05). Under SEM, the silk fibroin scaffold was 3-d, the pore size was homogeneous. BMSCs grew well in the silk fibroin scaffolds. It had good adhesion which showed the extracellular matrix secretion was enough, and cells and scaffolds were closely linked through extracellular matrix. Conclusions The 3-d scaffold is successfully prepared, which is non-toxic to BMSCs. It has good biocompatibility and might be an ideal scaffold material for the ligament tissue engineering.
three-dimensional silk fibroin scaffolds; tissue engineering; bone marrow mesenchymal stem cells; biocompatibility
贵州省科技厅社发攻关基金资助项目(黔科合SY[2010]3091号)。
范青洪(1987-),男,硕士,研究方向为四肢骨科与运动损伤。E-mail: fanqh110@126.com
刘毅(1962-),男,教授,研究方向为关节、创伤与运动医学。E-mail: 13308529536@163.com
10.3969/j.issn.1002-266X.2016.16.002
R318.08
A
1002-266X(2016)16-0005-03
2015-11-17)
