慢病毒介导siRNA沉默ERK2对创伤性骨性关节炎大鼠软骨退变的影响及其机制
2016-05-10宁仁德孔令超周业金王祥
宁仁德,孔令超,周业金,王祥
(1安徽医科大学第三附属医院,合肥230031;2上海交通大学医学院附属第三人民医院)
·论著·
慢病毒介导siRNA沉默ERK2对创伤性骨性关节炎大鼠软骨退变的影响及其机制
宁仁德1,孔令超1,周业金1,王祥2
(1安徽医科大学第三附属医院,合肥230031;2上海交通大学医学院附属第三人民医院)
目的 观察慢病毒介导siRNA沉默细胞外信号调节激酶2(ERK2)对创伤性骨性关节炎大鼠软骨退变的影响,并探讨其机制。方法 将30只右膝创伤性骨性关节炎大鼠随机分为三组,每组10只,分别于右膝关节腔注射无菌PBS(模型组)、ERK2 siRNA阴性慢病毒溶液(对照组)及ERK2 siRNA慢病毒溶液(观察组)。8周后处死大鼠,取其右膝关节观察膝关节软骨形态并进行评分,行HE、甲苯胺蓝及番红“O”染色后观察软骨组织病理形态,采用Mankin半定量法进行关节软骨评分。采用Real-time PCR法检测各组软骨组织MMP3、MMP13及Col2a mRNA相对表达量。结果 观察组软骨面溃疡、缺损程度均轻于模型组和对照组。HE、甲苯胺蓝、番红“O”染色均显示,观察组软骨面较光滑,裂隙出现、表面组织丢失、基质染色减轻、软骨细胞增生和排列紊乱程度均轻于模型组和对照组。模型组、对照组软骨形态评分、关节软骨评分均高于观察组(P均<0.05),模型组和对照组比较无统计学差异(P均>0.05)。观察组MMP3、MMP13 mRNA相对表达量均低于模型组和对照组,Col2a mRNA相对表达量均高于模型组和对照组(P均<0.01);模型组和对照组MMP3、MMP13及Col2a mRNA相对表达量比较无统计学差异(P均>0.05)。结论 慢病毒介导siRNA沉默ERK2能够减轻创伤性骨性关节炎大鼠的软骨退变,机制可能与降低MMP3、MMP13表达及增加Col2a表达有关。
骨性关节炎;软骨退变;慢病毒;小干扰RNA;细胞外信号调节激酶2;大鼠
骨性关节炎是最常见的关节疾病,关节创伤后发生的骨性关节炎占12%,其发病机理尚未完全明确[1,2]。研究表明,创伤性骨性关节炎的发生、发展与多种细胞炎性因子的调控密切相关,如IL-1β和TNF-α等[3]。RNA干扰是由双链RNA诱发的导致同源mRNA高效特异性降解的一种基因沉默现象,能够快速、有效地阻断相应基因的表达[4]。直接转染合成的小干扰RNA(siRNA)亦能阻断相应基因表达,但存在体内容易降解的缺点[5]。慢病毒载体技术是近年发展起来的,其介导的siRNA能够稳定、持久和高效地阻断相应基因表达,目前已证实其在骨性关节炎、类风湿性关节炎和假体周围骨溶解等许多关节疾病的治疗方面具有重要价值[6~8]。2014年10月~2015年5月,本研究参照前期试验的方法[5],构建和包装慢病毒介导沉默大鼠细胞外信号调节激酶2(ERK2)基因的siRNA,观察其对创伤性骨性关节炎大鼠软骨退变的影响,并探讨其机制。
1 材料与方法
1.1 材料 雌性Wistar大鼠30只,12周龄,体质量180~200 g,购于上海实验动物研究中心。人胚肾293T细胞(上海生命科学院)。TRIzol试剂、Lipofectamine 2000(美国Invitrogen公司),SYBR Green Ⅰ Real-time PCR 试剂盒、反转录试剂盒(日本TaKaRa公司),DMEM、胎牛血清(美国Gibco公司),携带绿色荧光蛋白的慢病毒载体系统(pshRNA-H1-Luc质粒,上海吉凯基因公司)。7500实时荧光定量PCR仪(美国ABI公司),低温超速离心机(美国BD公司),荧光倒置显微镜(IX51型,日本Olympus公司)。
1.2 ERK2 siRNA慢病毒载体的转染及滴度测定 参照前期试验方法[5],体外构建大鼠ERK2 siRNA慢病毒载体,并对慢病毒进行包装。大鼠ERK2 siRNA序列:5′-GCACCTCAGCAATGATCAT-3′,ERK2 siRNA阴性对照序列:5′-TGCAGTTCGGAATCAGCTT-3′。体外合成后,通过携带绿色荧光蛋白的pshRNA-H1-Luc质粒构建慢病毒载体,取对数生长期的人胚肾293T细胞进行慢病毒包装。取感染复数(MOI)为10、25、50的慢病毒载体浓缩液转染人胚肾293T细胞,荧光倒置显微镜下观察转染情况。镜下可明显观察到293T细胞内有绿色荧光,表明慢病毒载体成功转染293T细胞。当MOI为10、25、50时,其转染率分别为60%、75%、90%。以MOI为50时的慢病毒载体浓缩液进行转染,制备慢病毒溶液,经系列稀释法计算出ERK2 siRNA慢病毒及其阴性慢病毒的滴度。ERK2 siRNA慢病毒滴度为1×108tu/mL,ERK2 siRNA阴性慢病毒滴度为0.5×109tu/mL,将慢病毒溶液置于-80 ℃保存备用。
1.3 模型制作与分组处理 将30只大鼠分笼饲养,0.5%水合氯醛按0.35 g/100 g体质量腹腔内注射麻醉。参照Baragi等[9]的方法,选择右膝关节制备创伤性骨性关节炎模型:于无菌状态下行髌骨外侧旁切口暴露右膝关节,切除内侧半月板,缝合关节囊与皮肤,关闭切口。手术后不固定肢体,肌注青霉素20万U/d,连用3 d。术后1周,将30只大鼠随机分为模型组、对照组和观察组,各10只。无菌条件下取21号无菌注射针行右膝髌骨旁穿刺,进行关节腔内药物注射。模型组注射0.1 mL无菌PBS,对照组注射0.1 mL ERK2 siRNA阴性慢病毒溶液,观察组注射0.1 mL ERK2 siRNA慢病毒溶液。注射后适当伸屈膝关节5 min,使注射液体均匀分布于膝关节腔。
1.4 相关指标观察
1.4.1 软骨退变情况 各组注射后第8周,处死大鼠,取右膝关节。首先观察右膝关节软骨形态,参照董刚等[10]的方法进行软骨形态评分。切取右股骨内侧髁软骨组织,生理盐水冲洗后依次行4%甲醛固定、甲酸-甲醛脱钙、梯度乙醇脱水,封蜡后制成软骨组织切片。分别行HE、甲苯胺蓝及番红“O”染色,于50倍光镜下观察关节软骨组织病理形态,番红“O”染色后采用Mankin半定量法进行关节软骨评分[11]。
1.4.2 软骨组织基质金属蛋白酶3(MMP3)、MMP13及Ⅱ型胶原酶(Col2a)mRNA表达 采用Real-time PCR法检测。取大鼠右股骨内侧髁退变区软骨组织,根据TRIzol试剂盒说明提取总RNA,逆转录后合成cDNA第一链。逆转录反应体系:5×M-MLV逆转录酶缓冲液5 μL,M-MLV逆转录酶1 μL,dNTP 2 μL,RNAase抑制剂0.5 μL,Oligdt 2 μL,加入DEPC去离子水补至20 μL。充分混匀后42 ℃反应60 min,75 ℃持续15 min灭活逆转录酶,cDNA链合成后-20 ℃备用。参照So等[12]的方法设计MMP3、MMP13、Col2a及内参基因β-actin的上下游引物,见表1。PCR反应体系:SYBR GreenⅠ混合物10 μL,上、下游引物各0.4 μL,cDNA 2 μL,ddH2O补至25 μL。置入Prism 7500荧光定量PCR仪,设定扩增程序:95 ℃ 10 s,60 ℃ 20 s,62 ℃ 20 s,重复35个循环。每个样品重复3次且设置3个平行孔。目的基因mRNA相对表达量以2-ΔΔCt表示。

表1 MMP3、MMP13、Col2a及内参基因β-actin引物序列
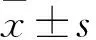
2 结果
2.1 各组软骨退变情况比较 各组右膝关节内侧胫骨平台均较外侧退变严重,其中模型组和对照组膝关节软骨面无光泽,溃疡明显,缺损深达软骨深层,部分可见软骨剥脱,有骨赘形成;观察组膝关节软骨面欠光滑,光泽稍灰暗,部分区域软骨面毛糙有糜烂,有少量骨赘形成。模型组软骨形态评分为(3.50±0.55)分,对照组为(3.33±0.52)分,观察组为(2.50±0.55)分;模型组、对照组均高于观察组(P均<0.05),模型组和对照组比较无统计学差异(P均>0.05)。
HE染色可见,模型组和对照组软骨面大部分区域粗糙不平滑,基质染色明显且不均匀,软骨细胞排列严重紊乱,组织重度增生,潮线模糊;观察组软骨面部分区域不光滑,基质染色、软骨细胞排列紊乱程度、组织增生程度均明显轻于模型组和对照组,潮线隐约可见。
甲苯胺蓝染色可见,模型组和对照组关节表面软骨组织丢失明显,软骨面较多区域可见裂隙,软骨细胞增多,基质染色明显减轻且不均匀;观察组关节表面软骨组织轻度丢失,软骨面部分区域可见裂隙,软骨细胞轻度增生,基质染色轻于模型组和对照组。
番红“O”染色可见,模型组和对照组软骨面明显粗糙不平,较多区域连续性中断,软骨细胞排列紊乱且染色不明显,部分潮线可见血管穿过;观察组软骨面轻度粗糙,少许区域连续性中断,软骨细胞排列轻度紊乱,基质染色较轻。模型组关节软骨评分为(12.50±1.05)分,对照组为(12.33±1.21)分,观察组为(7.33±1.03)分;模型组、对照组均高于观察组(P均<0.05),模型组和对照组比较无统计学差异(P>0.05)。
2.2 各组软骨组织MMP3、MMP13及Col2a mRNA表达比较 观察组MMP3、MMP13 mRNA相对表达量均低于模型组和对照组,Col2a mRNA相对表达量均高于模型组和对照组(P均<0.01);模型组和对照组MMP3、MMP13及Col2a mRNA相对表达量比较无统计学差异(P均>0.05)。见表1。

表1 各组软骨组织MMP3、MMP13及Col2a mRNA表达比较(相对表达量
注:与模型组比较,*P<0.01;与对照组比较,#P<0.01。
3 讨论
关节创伤后形成骨性关节炎的病理过程涉及众多因素,目前其确切的发生机理尚未完全明确[12]。研究表明,细胞炎性因子在创伤性骨性关节炎的发生、发展过程中具有重要作用,关节创伤后其关节液IL-1β水平显著升高,而IL-1β目前被认为是导致关节软骨退变和破坏的最重要的细胞因子之一[3,13]。前期试验显示,ERK2通路是IL-1β诱导软骨细胞分泌MMP3、MMP13,并抑制Col2a表达的一个重要信号转导通路[9]。研究显示,MMP13能够分解软骨基质中的Ⅱ型胶原酶,MMP3可降解软骨组织细胞外基质成分,如纤维连接蛋白和层粘连蛋白。而关节软骨组织中Ⅱ型胶原酶、纤维连接蛋白以及层粘连蛋白等对于维持正常软骨组织的修复重建和新陈代谢十分重要,如果这些成分发生异常,将会严重影响软骨组织的新陈代谢平衡,最终可导致关节软骨组织的退变和破坏[14,15]。
关节创伤后发生的骨性关节炎早期临床表现与传统骨性关节炎明显不同,当其发展到伴随关节疼痛、畸形等传统骨性关节炎典型的临床表现时,患者一般处于骨性关节炎的晚期,此时可采取的外科手段只能是关节置换、截骨和融合等方式[3,14]。针对创伤后激活关节软骨退变和破坏的信号转导机制,在不同时间点采取特别干预信号转导措施来控制其演变,可能成为预防和治疗其发生和发展的方向[3,14]。早期研究显示,一些能够导致软骨细胞死亡、控制炎症因子释放和蛋白多糖丢失等的小分子物质,能够明显减少软骨细胞死亡,修复破损的软骨细胞膜,清除氧自由基,从而延缓创伤后骨性关节炎的炎性发展过程,但此类小分子物质具有易降解、持续效果时间短等不足[16,17]。
慢病毒载体技术是近年发展起来的一项新技术,具有转染率高、在传代和静止期细胞中表达稳定的特性,而慢病毒载体介导的siRNA能够稳定、持久和高效地阻断相应基因的表达[6]。本研究参考以往的研究[10],切除大鼠内侧半月板制备大鼠创伤性骨性关节炎动物模型,并于其膝关节腔内注射前期构建包装好的慢病毒介导的ERK2 siRNA,观察沉默ERK2基因后对创伤性骨性关节炎软骨退变的影响。结果显示,观察组软骨面溃疡、缺损程度均轻于模型组和对照组。HE、甲苯胺蓝、番红“O”染色均显示观察组软骨面较光滑,裂隙出现、表面组织丢失、基质染色、软骨细胞增生和排列紊乱程度均轻于模型组和对照组。模型组、对照组软骨形态评分、关节软骨评分及MMP3、MMP13 mRNA相对表达量均明显高于观察组,Col2a mRNA相对表达量均明显低于观察组,而模型组、对照组上述指标比较无明显统计学差异。
综上所述,慢病毒介导siRNA沉默ERK2能够减轻创伤性骨性关节炎大鼠的软骨退变,机制可能与降低MMP3、MMP13表达及增加Col2a表达有关。本研究为未来临床基因治疗创伤性骨性关节炎提供了一个新的药物治疗靶点,值得借鉴。
[1] Brown TD, Johnston RC, Saltzman CL, et al. Posttraumatic osteoarthritis: a first estimate of incidence, prevalence, and burden of disease[J]. J Orthop Trauma, 2006,20(10):739-744.
[2] Anderson DD, Chubinskaya S, Guilak F, et al. Post-traumatic osteoarthritis: improved understanding and opportunities for early intervention[J]. J Orthop Res, 2011,29(6):802-809.
[3] Riordan EA, Little C, Hunter D. Pathogenesis of post-traumatic OA with a view to intervention[J]. Best Pract Res Clin Rheumatol, 2014,28(1):17-30.
[4] Elbashir SM, Harborth J, Lendeckel W, et al. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[J]. Nature, 2001,411(6836):494-498.
[5] Li F, Fan C, Cheng T, et al. Efficient inhibition of fibroblast proliferation and collagen expression by ERK2 siRNAs[J]. Biochem Biophys Res Commun, 2009,382(2):259-263.
[6] Matrai J, Chuah MK, Vanden Driessche T. Recent advances in lentiviral vector development and applications[J]. Mol Ther, 2010,18(3):477-490.
[7] Miller AD. Delivery of RNAi therapeutics: work in progress[J]. Expert Rev Med Devices, 2013,10(6):781-811.
[8] Li F, Ruan H, Fan C, et al. Efficient inhibition of the formation of joint adhesions by ERK2 small interfering RNAs[J]. Biochem Biophys Res Commun, 2010,391(1):795-799.
[9] Baragi VM, Becher G, Bendele AM, et al. A new class of potent matrix metalloproteinase 13 inhibitors for potential treatment of osteoarthritis: evidence of histologic and clinical efficacy without musculoskeletal toxicity in rat models[J]. Arthritis Rheum, 2009,60(7):2008-2018.
[10] 董刚,乐军,周辉,等.PDTC关节腔注射对兔创伤性OA软骨MMP-1、MMP-9 mRNA表达的影响[J].浙江中西医结合杂志,2013,23(8):609-612.
[11] Mankin HJ, Dorfman H, Lippiello L, et al. Biochemical and metabolic abnormalities in articular cartilage from osteo-arthritic human hips Ⅱ. Correlation of morphology with biochemical and metabolic data[J]. J Bone Joint Surg Am, 1971,53(3):523-537.
[12] So JS, Song MK, Kwon HK, et al. Lactobacillus casei enhances type Ⅱ collagen/glucosamine-mediated suppression of inflammatory responses in experimental osteoarthritis[J]. Life Sci, 2011,88(7-8):358-366.
[13] Kramer WC, Hendricks KJ, Wang J. Pathogenetic mechanisms of posttraumatic osteoarthritis: opportunities for early intervention[J]. Int J Clin Exp Med, 2011,4(4):285-298.
[14] Wang X, Li F, Fan C, et al. Effects and relationship of ERK1 and ERK2 in interleukin-1beta-induced alterations in MMP3, MMP13, type Ⅱ collagen and aggrecan expression in human chondrocytes[J]. Int J Mol Med, 2011,27(4):583-589.
[15] Klatt AR, Paul-Klausch B, Klinger G, et al. A critical role for collagen Ⅱ in cartilage matrix degradation: collagen Ⅱ induces pro-inflammatory cytokines and MMPs in primary human chondrocytes[J]. J Orthop Res, 2009,27(1):65-70.
[16] Moon SJ, Jeong JH, Jhun JY, et al. Ursodeoxycholic Acid ameliorates pain severity and cartilage degeneration in monosodium iodoacetate-induced osteoarthritis in rats[J]. Immune Netw, 2014,14(1):45-53.
[17] 刘宪民,杜明昌,柳椰,等.猪膝关节软骨全层缺损、软骨下骨损伤后滑液中炎性因子水平变化[J].创伤与急危重病医学,2015,3(1):9-12.
Effect of siRNA mediated by lentivirus silencing ERK2 on cartilage degeneration in rat models of post traumatic osteoarthritis and its mechanism
NINGRende1,KONGLingchao,ZHOUYejin,WANGXiang
(1TheThirdAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230031,China)
Objective To observe the effect of siRNA mediated by lentivirus silencing extracellular signal-regulated kinase 2 (ERK2) on cartilage degeneration in rat models of post-traumatic osteoarthritis and to investigate its mechanism. Methods Thirty light knees of traumatic osteoarthritis model rats were randomly divided into 3 groups with 10 rats in each group, then the right knee joint cavities of theirs were injected with sterile PBS (PBS group), negative ERK2 siRNA lentivirus solution (negative control group) and ERK2 siRNA lentivirus solution (observation group), respectively. After 8 weeks, the rats were sacrificed and the general morphology of the articular cartilage was observed and scored, then the articular cartilage pathological changes were observed under the optical microscope with HE, toluidine blue and safranin "O" staining, respectively, and the degree of cartilage degeneration was analyzed by Mankin semi-quantitative method. Meanwhile, the relative mRNA expression of matrix metalloproteinase 3 (MMP3), MMP13 and Col2a of cartilage tissues was analyzed by real-time fluorescence quantitative PCR. Results The articular cartilage surface ulcers and defects in the observation group were significantly lighter than those of the PBS group and negative control group, the extent of smooth articular surface of cartilage, crack area, loss of tissue, matrix staining, the proliferation of chondrocytes and the disorder of arrangement in the cartilage tissues of the observation group were lighter than those of the PBS group and negative control group; and the normal morphology and articular cartilage score in the observation group were significantly lower than those in the PBS group and negative control group (allP<0.05), there was no significant difference between the PBS and negative control groups (P>0.05). In addition, the relative mRNA expression levels of MMP3 and MMP13 in the observation group were lower than those in the PBS group and negative control group, while the relative mRNA expression level of Col2a was higher than that in the PBS group and negative control group (allP<0.01); there was no significant difference in the expression of MMP3, MMP13 and Col2a mRNA between the PBS group and negative control group (allP>0.05). Conclusion siRNA mediated by lentivirus silencing ERK2 can significantly reduce the cartilage degeneration of post-traumatic osteoarthritis, whose mechanism may be related with the decreased expression of MMP3 and MMP13 and increased expression of Col2a.
osteoarthritis; cartilage degeneration; lentivirus; small interfering RNA; extracellular signal-regulated kinase 2; rats
国家自然科学基金资助项目(81101380)。
宁仁德(1972-),男,博士,副主任医师,研究方向为骨与关节损伤。E-mail: nrd192@qq.com
王祥(1978-),男,博士,副主任医师,研究方向为骨与关节损伤。E-mail: doctorwangxiang@sohu.com
10.3969/j.issn.1002-266X.2016.16.001
R684.3
A
1002-266X(2016)16-0001-04
2015-10-21)
