苦菜多酚的提取及其抗氧化性研究
2016-05-09郑翠萍田呈瑞马婷婷权美平
郑翠萍,田呈瑞*,马婷婷,权美平,2
1(陕西师范大学 食品工程与营养科学学院,陕西 西安, 710062) 2(渭南师范学院 多河流湿地重点实验室,陕西 渭南, 714000)
苦菜多酚的提取及其抗氧化性研究
郑翠萍1,田呈瑞1*,马婷婷1,权美平1,2
1(陕西师范大学 食品工程与营养科学学院,陕西 西安, 710062)2(渭南师范学院 多河流湿地重点实验室,陕西 渭南, 714000)
摘要采用响应面法优化了苦菜多酚提取工艺,对苦菜多酚成分进行了分析,并测定了其抗氧化活性。以单因素试验为基础,选择提取温度、乙醇体积分数和料液比为自变量,以苦菜多酚得率为响应值,进行3因素3水平响应面分析。得到苦菜多酚的最佳提取条件为,提取温度77 ℃,乙醇体积分数56%,提取时间45 min,在此条件下,苦菜多酚的得率可达到14.72%;应用高效液相色谱法分析其成分,结果显示:苦菜多酚主要成分为芦丁、绿原酸、咖啡酸、芹菜素、原儿茶素;苦菜多酚、Vc和BHT清除DPPH自由基的IC(50)分别为0.097、0.113和0.258 mg/mL,苦菜多酚清除能力大于Vc和BHT;原能力大于BHT,但小于Vc;β-胡萝卜素/亚油酸漂白试验中,苦菜多酚抗氧化能力大于Vc,但小于BHT,三者的抑制率分别为77.2%、28.49%、69.59%。
关键词苦菜;多酚;响应曲面法;HPLC;抗氧化活性
苦菜(SonchusoleraceusL.)为菊科苦苣菜属多年生草本植物,除西南和青藏地区外全国均有分布,资源十分丰富。苦菜作为中药始载于《神农本草经》,药名为“败酱草”,不仅是一种营养丰富的野菜,也是一种良好的中药材,药用历史悠久。现代医学研究表明,苦菜还具有抗癌抗肿瘤、保肝治肝炎和抗菌抗病毒等功效[1-3],药理作用非常广泛。目前,关于苦菜的研究主要有苦菜的成分分析、分离鉴定、生物活性作用[4-8],其中生物活性主要以苦菜黄酮类物质研究为主,但针对苦菜多酚的研究很少。本实验通过响应面法优化苦菜多酚的提取工艺,高效液相色谱法对苦菜多酚进行成分鉴定,同时采用3种体外抗氧化体系测定了其抗氧化活性。
1材料与方法
1.1材料与仪器
1.1.1材料与试剂
苦菜,榆林市东方红食品开发有限责任公司提供。
没食子酸、DPPH、没食子酸、原儿茶素、绿原酸、芦丁、芹菜素,购于Sigma公司;福林酚试剂、丙酮、甲醇、乙醇、石油醚、三氯甲烷、BHT、Vc、K3Fe(CN)6、三氯乙酸、FeCl3、无水Na2CO3、β-胡萝卜素、亚油酸、Tween-20等均为分析纯。
1.1.2主要仪器设备
电子天平(AL204),梅特勒-托利多仪器有限公司;恒温振荡器(SHA-C),金坛市富华仪器有限公司;台式离心机(TDL80-2B),上海安亭科学仪器厂制造;可见分光光度计(722型),上海光谱仪器有限公司制;造旋转蒸发器(RE-52A),上海亚荣生化仪器厂;Breeze1525 高效液相色谱仪,美国Waters 公司。
1.2实验方法
1.2.1样品总酚含量的测定
移取0.2 mL样液,依次加入0.5 mL福林酚,1.5 mL的Na2CO3(17.5%),蒸馏水定容至10 mL摇匀,暗室反应90 min,765 nm测定吸光度(A)。配制不同浓度没食子酸标准溶液,同方法测定吸光值,以没食子酸标准溶液质量浓度(g/mL)为横坐标X、吸光度(A)为纵坐标绘制标准曲线,标准曲线方程为:Y=1.088 9X+0.087 8,相关系数R2=0.997 6。
1.2.2苦菜多酚提取工艺流程
苦菜(干燥)→粉碎→过60目筛→物料与溶剂混合→浸提→离心→取上清液
1.2.3苦菜多酚提取单因素试验
按照1.2.1的总酚测定方法和1.2.2的提取工艺,分别考察了不同体积分数的甲醇、乙醇和丙酮溶剂,提取温度,提取时间及料液比对苦菜多酚得率的影响。
1.2.4响应面法优化苦菜多酚提取试验
应用Box-Behnken 模型,以提取温度(℃)、料液比(mL∶g)、乙醇体积分数(%)3个显著性影响因素为考察因子(自变量),以苦菜多酚得率Y为响应值,利用Design-ExpertV.7.0软件设计了3因素3水平的响应曲面法试验,共有17个试验点,编码结果见表1。

表1 Box-Benhnken 试验设计因素和水平
1.2.5HPLC分析
Diamonsil C18色谱柱(5 μm,250 mm×4.6 mm);柱温:30 ℃;检测波长:280 nm;进样量:20 mL;流速:1 mL/min;流动相A:体积分数0.1%的甲酸高纯水;B相:体积分数0.1%的甲酸乙腈;梯度洗脱程序:0 min,8%B;20 min,18%B;25 min,22%B;40 min,50%B。
1.2.6苦菜多酚的体外抗氧化活性研究
1.2.6.1DPPH 自由基清除能力的测定
参照BUBONJA-SONJE等[9]的方法并稍作修改。配制DPPH乙醇溶液0.1 mmol/L,取0.1 mL不同浓度的苦菜多酚溶液与3.9 mL DPPH溶液充分混匀,30 min室温避光反应,515 nm处测定其吸光度。相同浓度浓度梯度的BHT和Vc作为对照组,水为空白组,同方法测定吸光值。3次平行实验,取平均值。清除率计算公式为:
I/%=(1-Ai/A0)×100
(1)
其中:I,自由基清除率,%;Ai,样品溶液和DPPH溶液混合液的吸光值;A0,DPPH溶液的吸光度值。
1.2.6.2还原能力的测定
参考VAQUERO等[10]的方法并做调整。分别取1 mL不同浓度的样品,加入2 mL磷酸缓冲液(0.2 mol/L,pH=6.6)和2 mL质量分数为1%的K3Fe(CN)6,混匀,50 ℃反应20 min,反应液中加入2.5 mL 10%三氯乙酸, 4 000 r/min离心10 min,移取上清液2 mL,与2 mL蒸馏水, 0.2 mL质量分数0.1%的FeCl3充分混匀。避光反应10 min,在波长700 nm处测定其吸光值。反应原理为:

混合液的吸光度越高表示黄苦菜多酚提取液的还原能力越强。
1.2.6.3β-胡萝卜素/亚油酸体系中抗氧化能力的测定
根据SIDDHURAJU等[11]的方法并稍作修改。 5 mg β-胡萝卜素中加入10 mL三氯甲烷,0.125 mL亚油酸和2 mL Tween-20, 50℃旋转蒸发4 min,加入500 mL蒸馏水充分混匀形成反应液。取0.5 mL各浓度样液和20 mL反应液混匀, 50℃水浴,每隔25 min测反应液在470 nm处的吸光值。抗氧化能力按公式(2)计算:
S/%=[1-(A0-At)/(A0’-At’)]×100
(2)
其中:S,样品的抗氧化能力,%;A0,样品溶液在零反应时刻的吸光值;A0’,空白对照溶液在零反应时刻的吸光值;At,样品溶液在t反应时刻的吸光值;At’,空白对照溶液在t反应时刻的吸光值。
1.2.7数据统计与分析
试验数据均采用DPS软件、Excel 2007进行数据处理、分析及绘图,以平均值±标准偏差来表示。
2结果与分析
2.1水浴振荡提取苦菜多酚的单因素结果
2.1.1不同浓度的不同溶剂对苦菜多酚提取量的影响
准确称取一定量的苦菜粉,按照1∶35(g∶mL)的料液比分别加入水、不同浓度(体积分数40%、50%、60%、70%、80%)的丙酮、甲醇和乙醇,60℃下水浴振荡提取2h。多酚提取效果如图1所示。

图1 浸提溶剂对多酚得率的影响Fig.1 Influence of the king of solvent on yield of polyphenol
由图1可知,苦菜多酚的提取效果是乙醇>甲醇>丙酮>水。乙醇组中,乙醇体积分数在40%~80%内,多酚得率随着乙醇浓度的增加先增加后下降,在60%时,多酚得率达到最大值。根据相似相溶原理,60%的乙醇溶液与苦菜多酚的极性最接近,因此,选择 60%作为后续试验的乙醇浓度。
2.1.2温度对苦菜多酚得率的影响
按照乙醇体积分数60%、提取时间2h、料液比1∶35,温度为40、50、60、70、80、90 ℃各条件下提取苦菜多酚,多酚得率结果见图2。由图2可知,在40~90℃内,苦菜多酚得率先增加后降低,在 80℃时,多酚得率最大。这与多酚物质的热稳定性有关,温度过高,多酚物质被氧化,故多酚得率在90℃条件下降低。

图2 温度对多酚得率的影响Fig.2 Influence of the temperature on yield of polyphenol
2.1.3料液比对多酚得率的影响
按照温度80 ℃,乙醇体积分数60%,料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40、1∶50 (g∶mL),水浴振荡提取2h,多酚得率如图3所示。由图3可知,料液比在1∶20~1∶35,多酚得率随着溶剂添加量的增加而增加,当料液比在1∶35~1∶50,多酚得率变化不明显。这是因为在样品量一定时,料液比在一定范围内,增加溶剂量,可以降低样品在溶剂中的浓度,提高样品颗粒与溶剂的接触面积,从而提高样品在溶剂中的溶出效果[12]。但溶剂添加量过高,会增加提取成本,也会造成资源浪费,后续分离纯化试验量过大。综合考虑,料液比为1∶35 (g∶mL)适宜。

图3 料液比对多酚得率的影响Fig.3 Influence of solid-to-solvent ratio on yield of polyphenol
2.1.4提取时间对多酚得率的影响
按照乙醇体积分数60%、提取温度80 ℃、料液比1∶35,提取时间分别为30、50、70、90、110 min条件下水浴振荡提取苦菜多酚,多酚得率结果见图4。图4分析可得,在 30~110 min,苦菜多酚得率随时间的延长先增加后降低,在50 min时,苦菜多酚得率最大。这是因为加热时间过长,有效成分因热不稳定而发生降解或氧化,故50 min提取时间最佳。

图4 时间对多酚得率的影响Fig.4 Influence of time on yield of polyphenol
2.2响应面优化试验结果与分析
2.2.1模型的建立与方差分析
根据 2.1中所得试验结果,选择提取温度(A),乙醇体积分数(B),提取时间(C)进行3 因素3水平的Box-Benhnken 试验中心组合试验。响应面分析方案与结果见表2。利用Design-Expert 7.0 软件对表2试验结果进行分析,得到响应值为苦菜多酚得率的回归方程:
Y=1.47-0.028A-0.032B-0.026C+0.049AB-0.016AC-0.475 0E-003BC-0.081A2-0.052B2-0.039C2
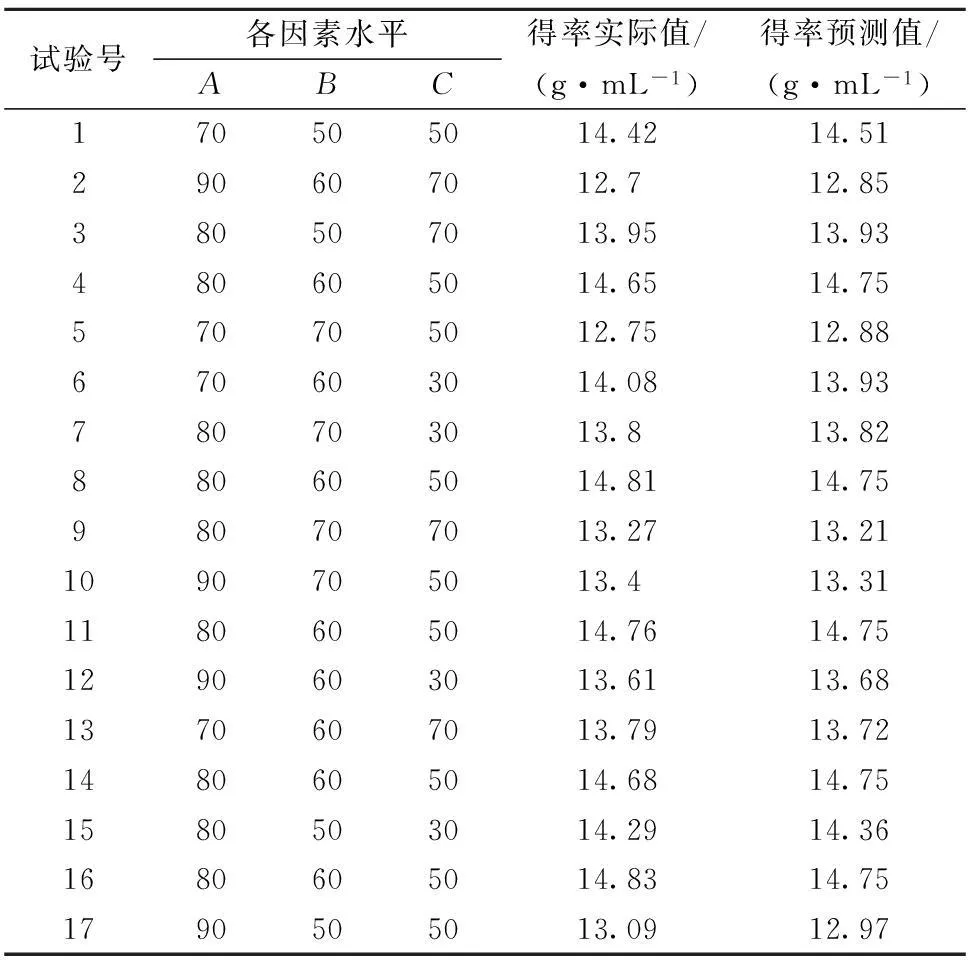
表2 苦菜多酚得率响应面方案及结果
由表3分析数据可知,该回归模型为极显著水平(P<0.000 1),失拟项差异不显著(P=0.055 9>0.05),表示该方程对苦菜多酚提取试验拟合效果好。该回归模型决定系数R2=0.983 0,校正决定系数Adj.R2=0.961 1,说明该模型拟合程度良好,且总变异中只有3.99%不能用此模型解释。预测决定系数PredR2=0.771 4,说明预测值和真实值之间相关性高,实验误差小。比较F值的大小可知,对苦菜多酚得率的影响顺序为:提取温度>提取时间>乙醇浓度。一次项A、B,交互项AB,二次项A2、B2、C2,对多酚得率的影响都达到了极显著水平(P<0.001);而一次项C为显著水平(P<0.01);交互项AC和BC对试验结果影响不显著.

表3 响应面回归模型ANOVA分析结果
注:*P<0.05;**P<0.01;***P<0.001。
2.2.2响应面分析
根据回归方程得出不同因子的响应面和等高线结果见图5~图7。

图5 提取温度和乙醇体积分数对得率的影响Fig.5 RSM analysis for interactive effects of extraction temperature and alcohol concentration

图6 提取温度和时间对得率的响应面分析Fig.6 RSM analysis for interactive effects of extraction temperature and time

图7 乙醇体积分数和时间对得率的响应面分析Fig.7 RSM analysis for interactive effects of alcohol oncentration and time
如图5~图7所示,响应面图和等高线均可阐明该模型。在响应曲面图中,单因素影响效果与曲面陡峭相关,曲面越陡峭,影响越显著。等高线图与响应面图相对应,响应值越大曲线越接近中心。各因素交互作用与等高线形状相关,圆形则为不显著,椭圆为显著[14]。
图5为温度和乙醇分数的交互作用对苦菜多酚得率的影响效果图。从图5可知,响应曲面陡峭,影响为显著,等高线为椭圆形,交互作用显著。图6为温度和时间对苦菜多酚得率的影响。由图6可知,响应曲面陡峭,影响为显著,但等高线接近圆形,相互作用不显著(P=0.064 4)。图7为乙醇分数和时间的交互作用对苦菜多酚得率的影响。响应曲面陡峭,影响显著,等高线近似圆形,交互作用不显著(P=0.523 1)。
Design-Expert 7.0分析可得,苦菜多酚最佳提取条件为,温度77.20℃、乙醇体积分数55.77%、提取时间45.04 min,苦菜多酚得率预测可达到14.88%。为实际操作方便,将上述最优提取条件简化为提取温度77℃、乙醇体积分数56%、提取时间45 min。在该条件下进行3次试验验证,苦菜多酚得率平均值为14.72%,与预测值的误差仅为1.07%,表明该模型可靠性高。
2.3HPLC分析苦菜多酚成分分析鉴定
苦菜多酚粗提物的HPLC色谱图如图9所示。通过与图8各标准品的吸收峰保留时间相对比,确定了 5种多酚类成分,其中以芦丁为主要成分,含量为120.987 9 mg/g(每克干物质的量),其后依次为绿原酸7.047 mg/g、咖啡酸0.677 1 mg/g、芹菜素0.423 1 mg/g、原儿茶酸0.115 1 mg/g。

图8 混合标准品溶液的HPLC图谱Fig.8 HPLC chromatogram of mixed standard solution

图9 苦菜多酚粗品的HPLC图谱Fig.9 HPLC chromatogram of crude extracts
2.4苦菜多酚的抗氧化活性分析
2.4.1清除DPPH自由基的能力
苦菜多酚和阳性对照组BHT、Vc清除DPPH自由基能力如图10所示。从图10可以得出,苦菜多酚样品清除DPPH自由基的能力在0.042~0.168 mg/mL浓度范围内量效关系增加明显,但在0.209 mg/mL时清除能力增加较为平缓; Vc在整个浓度范围内清除能力随着浓度的增加而增加,且成线性相关; BHT在浓度范围内也呈线性相关,但BHT清楚能力明显弱于样品和Vc。苦菜多酚样品、Vc和BHT清楚DPPH自由基的IC50分别为0.097、0.113和0.258 mg/mL,苦菜多酚样品对DPPH自由基清除能力大于阳性对照组Vc和BHT,故苦菜多酚有较强的抗氧化能力。

图10 苦菜多酚样品、BHT和Vc对DPPH自由基的清除效果Fig.10 Scavenging effects of polyphenols from Ixeris Sonchifolia,BHT and VC on DPPH radical
2.4.2还原能力的测定
图11为苦菜多酚、BHT和Vc的还原能力。图11表明,在0.042~0.209 mg/mL内,随着浓度的增加,苦菜多酚、BHT和Vc的还原能力也不断增强,且呈明显的计量依耐关系。在相同浓度的条件下,还原能力的大小顺序为VC>样品>BHT。

图11 苦菜多酚样品、BHT和Vc的还原能力Fig.11 Reducing power of polyphenols from Ixeris Sonchifolia,BHT and VC
2.4.3β-胡萝卜素/亚油酸体系中的抗氧化能力
苦菜多酚、Vc、BHT作为抗氧化剂在β-胡萝卜素/亚油酸体系中抗氧化能力如图12所示。由图12可知,在0~6h内,0.209 mg/mL BHT>同浓度苦菜多酚样品>0.168 mg/mL苦菜多酚样品>0.209 mg/mL Vc。这是因为Vc是一种亲水性抗氧化剂,而β-胡萝卜素/亚油酸体系为水包油型乳化体系,根据相似相溶原理,所以Vc在该体系中抗氧化能力小,相反,苦菜多酚和BHT作为亲脂性抗氧化剂具有较强的抗氧化能力。所以,苦菜多酚在β-胡萝卜素/亚油酸体系中具有较强的抗氧化能力,这与BECKER K.等[15]的研究结果一致。图13为不同质量浓度的苦菜多酚、Vc和BHT在β-胡萝卜素/亚油酸体系中反应6h后的抗氧化能力结果。从图13可知,抗氧化能力最强为BHT,在该体系中达到77.2%,同浓度苦菜多酚为69.59%,低浓度苦菜多酚为59.72%,Vc抗氧化能力最小,仅为28.49%。所以,苦菜多酚样品在该体系中具有较强的抗氧化能力。

图12 苦菜多酚样品、BHT和Vc在β-胡萝卜素/亚油酸体系中的抗氧化能力Fig.12 Antioxidant activity of polyphenols from Ixeris Sonchifolia,BHT and VC by β-carotene-linoleate model system

图13 苦菜多酚样品、BHT和Vc对β-胡萝卜素漂白的抑制效果Fig.13 Bleaching inhibitory effect of polyphenols from Ixeris Sonchifolia,BHT and VC on the β-carotene
3结论
(1)响应面法优化苦菜多酚提取条件为温度77℃、乙醇体积分数56%,时间45 min。在此条件下,苦菜多酚得率为14.72%,与预测值14.75%基本一致。单因素影响苦菜多酚得率为,提取温度>提取时间>乙醇体积分数。其中提取时间与提取温度、乙醇体积分数与提取时间的交互作用均不显著,而温度和乙醇体积分数交互作用显著。
(2)通过高效液相色谱分析苦菜多酚主要组成成分,确定了5种多酚类成分,芦丁、绿原酸、咖啡酸、芹菜素、原儿茶素。
(3)本文分别采用3种抗氧化体系对苦菜多酚抗氧化活性进行综合评价。结果表明,苦菜多酚具有较强的清除DPPH自由基的能力、较好的还原能力和抗氧化能力,DPPH指标比Vc和BHT两个阳性指标都好。因此,苦菜多酚的抗氧化活性较强,可进一步开发利用。
参考文献
[1]沈德凤,杨波,李进京.黄花败酱总皂苷提取物抗肿瘤作用的实验研究[J]. 黑龙江医药科学, 2007, 30 (3):35-41.
[2]卢新华,陈虎云,戴俊,等.苦菜总黄酮对实验性肝损伤的保护作用[J]中国现代医学杂志, 2002,12(3): 8-9.
[3]SEO S W, PARK C S, HONG S H, et al. Inhibitory effec t o f Patr inia scab io saefo lia on acute pancreatitis[J].World J G astroen terol, 2006, 12 (7):1 110-11 141.
[4]郑冉.长裂苦苣菜化学成分的研究[D].吉林:吉林大学,2006.
[5]权洪峰,付雪艳,董琳,等.HPLC 法测定苦苣菜中槲皮素和木犀草素的含量[J].现代中药研究与实践, 2009,22(6): 60-62.
[7]芦佳琨.败酱草中黄酮类化合物的提取及其抗氧化活性、抑制生物被膜作用的研究[D].锦州:渤海大学,2013.
[8]RADES, THOMAS,MCPOWELL, et al.Anti-Ageing Effects ofSonchusoleraceusL. (puha) leaf extracts on H2O2-induced cell senescence [J]. Molecular Plant.2015,20: 4 548-4 564.
[9]BUBONJA-SONJE M, GIACOMETTI J, ABRAM M. Antioxidant and antilisterial activity of olive oil, cocoa and rosemary extract polyphenols [J]. Food Chemistry, 2011,127(4): 4 548-4 564.
[10]VAQUERO M J R,SERRAVALLE L R T,de NADRA M C M,et al.Antioxidant capacity and antibacterial activity of phenolic compounds from argentinean herbs infusions[J]. Food Control,2010,21(5):779-785.
[11]SIDDHURAJU P,BECKER K.Studies on antioxidant activities of mucuna seed(Mucuna pruriens var utilis)extract and various non-protein amino/imino acids through in vitro models [J].Journal of the Science of Food and Agriculture,2003,83(14):1 517-1 524.
[12]于亚莉,高峰,刘静波,等.声波法提取花生壳中多酚类物质的研究[J].食品科学,2007,28(11):257-260.
[13]石珂心,赵武奇,朱远棋,等. 超声波辅助提取石榴籽多酚工艺的响应面优化[J].陕西师范大学学报:自然科学版,2014,42(2):104-108.
[14]BECKER K,SIDDHURAJU P. Antioxidant properties of various solvent extracts of total phenolic constituents from three different agroclimatic origins of drumstick tree(MoringaoleiferaLam.)leaves [J]. Journal of Agriculture and Food Chemistry,2003,51(8):2 144-2 155.
Response surface methodology for optimization of extracting polyphenol fromSonchusoleraceusL. and antioxidant evaluation
ZHENG Cui-ping1, TIAN Cheng-rui1*, MA Ting-ting1, QUAN Mei-ping1,2
1(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’ an 710062, China)2(Key Lab of Wet Land Ecology and Environment of Duoheliu of Shanxxi Province, Weinan 714000, China)
ABSTRACTResponse surface methodology (RSM) was employed to optimize the extraction conditions of Polyphenol from Sonchus oleraceus L. and the chemical composition. Antioxidant activity of the polyphenols are also analyzed. Based on single-factor tests, Box-Benhnken center composite experiment was carried out with three factors, including extraction temperature, alcohol concentration, extracting time. RSM was used to determine the effect of prime factors on the yield of polyphenol. Results showed that the optimum extraction conditions were: 77 ℃, ethanol concentration 56%, and extraction time 45 min. Under these conditions, the extraction yield of polyphenol was 14.72%. The results of chromatography analysis with HPLC show that rutin, chlorogenic acid, caffeic acid, apigenin and original catechins are the main components existing in polyphenols. The IC(50) of the polyphenol extracts, Vitamin C and BHT against DPPH radicals were 0.097 mg/mL, 0.113 mg/mL and 0.258 mg/mL, respectively. The scavenging impact of the radical was more effective than that of BHT and vitamin C at the same concentration. The total reducing power was more than BHT but lower than vitamin C. Furthermore, β-carotene/linoleicbleaching test showed that the antioxidant ability was decreased in the order: BHT>the polyphenol extracts>vitamin C with the amount(%) of 77.2%,69.59% and 28.49%, respectively.
Key wordsSonchus oleraceus L.; polyphenol; response surface methodology; HPLC; antioxidant activity
收稿日期:2015-07-30,改回日期:2015-09-29
DOI:10.13995/j.cnki.11-1802/ts.201603040
第一作者:硕士研究生(田呈瑞教授为通讯作者)。
