硼酸、肉桂油及亚磷酸钾对采后病原菌Fusarium oxysporum生长发育的影响
2016-05-09周佳一刘雅红王娅妮戚琴芹赖童飞
周佳一, 刘雅红, 王娅妮, 戚琴芹, 汪 莹, 赖童飞, 周 婷
(杭州师范大学生命与环境科学学院,农产品质量安全控制技术研究杭州市重点实验室,浙江 杭州 310036)
硼酸、肉桂油及亚磷酸钾对采后病原菌Fusariumoxysporum生长发育的影响
周佳一, 刘雅红, 王娅妮, 戚琴芹, 汪 莹, 赖童飞, 周 婷
(杭州师范大学生命与环境科学学院,农产品质量安全控制技术研究杭州市重点实验室,浙江 杭州 310036)
为寻找针对果蔬镰刀菌枯萎病主要致病菌Fusariumoxysporum的有效防治方法,从腐烂的番茄(Solanumlycopersicum)中分离主要致病菌之一,经核糖体RNA基因内转录间隔区(rDNA-ITS)鉴定后,利用硼酸、肉桂油、亚磷酸钾处理病菌,确定最低抑菌浓度,并通过生理、生化指标以及果实接种实验,研究3种抑菌物质与病原菌发育及致病力的关系.结果表明:分离的病原菌为F.oxysporum;3种物质的抑菌效果均与浓度成正比;在最低抑菌浓度下,可以显著抑制F.oxysporum的孢子萌发,延缓芽管伸长及菌丝扩展速度,降低病原菌生物量积累,引起病原菌糖吸收障碍,并对F.oxysporum引起的番茄腐烂有明显的防治作用,其中肉桂油的防治效果尤为突出.
尖孢镰刀菌;内转录间隔区;抑菌物质;贮藏保鲜
0 引 言
近年来,一些能够用于果蔬采后病害防治的无毒或低毒的无机化学物质陆续被发现,并展现出一定的应用前景.例如硼酸(Boric acid)能抑制灰霉菌(Botrytiscinerea)诱发的葡萄灰霉病[4]、链核盘菌(Monilinialaxa)诱发的桃褐腐病[5]、胶胞炭疽菌(Colletotrichumgloeosporioides)诱发的芒果炭疽病[6],促进生防菌罗伦隐球酵母(Cryptococcuslaurentii)对红枣果实中青霉的抑制效果[7];肉桂油(Cinnamon oil)对黄曲霉(Aspergillusflavus)、扩展青霉(Penicilliumexpansum)、黑根霉(Rhizopusnigricans)、串珠镰刀菌(Fusariumverticillioides)有很好的抑制效果[8-12];亚磷酸盐(Phosphite)能够有效防治樟疫霉(Phytophthoracinnamomi)引起的山龙眼根腐病[13]、恶疫霉(Phytophthoracactorum)引起的草莓革状腐病[14]、腐皮镰刀菌(Fusariumsolani)引起的马铃薯根腐病[15]以及P.expansum引起的苹果青霉病[16],提高马铃薯对致病疫霉(Phytophthorainfestans)的抗性[17].
因此,本研究从腐烂的番茄中分离致病菌F.oxysporum,利用rDNA-ITS法确定其遗传背景,并通过相关生理、生化指标测定以及果实接种实验,评估了硼酸、肉桂油、亚磷酸钾3种抑菌物质对F.oxysporum发育及致病力的影响,实验结果将为果蔬采后病原菌的防治提供理论依据.
1 材料与方法
1.1 菌株及主要试剂
实验所用病原菌F.oxysporum分离自自然发病的番茄(Solanumlycopersicum).硼酸、肉桂油、亚磷酸、氢氧化钾购自美国Sigma公司,PCR所需试剂购自日本TAKARA公司,其他主要试剂购自生工生物工程(上海)股份有限公司,DNeasy Plant Mini Kit(Cat. No. 69106)及Gel Extraction Kit(Cat. No. 28706)购自德国Qiagen公司,番茄果实购自当地市场.
1.2 病原菌的分离及rDNA-ITS法鉴定
利用75%的无水乙醇对发病番茄果实进行消毒,风干后在病斑边缘去除果皮,切取面积为0.1 cm2左右的果肉置于PDA(Potato Dextrose Agar)培养基上,25 ℃培养72 h后,在菌落边缘分离菌种,转移至新的PDA培养基上,25 ℃培养,观察、拍照.用含有0.05% Tween-20的无菌水收集孢子,培养12 h后收集菌丝,使用DNeasy Plant Mini Kit提取病原菌基因组.利用真菌ITS通用引物(ITS4:5′-TCCTCCGCTTATTGATATGC-3′;ITS5:5′-GGAAGTAAAAGTCGTAACAAGG-3′)进行PCR扩增.利用Gel Extraction Kit回收扩增产物后送往上海桑尼生物科技有限公司测序,结果在http://blast.ncbi.nlm.nih.gov /Blast.cgi中进行同源性分析.
1.3 抑菌物质最低抑菌浓度的筛选及对F.oxysporum芽管伸长的影响
老陈的酒量不可小觑,我喝得晕头转向,他还在那里谈笑风生。见我软成一滩泥,老陈把我背上了四楼。他那身板,不愧是当过侦察兵的,一把年纪了还那么硬朗。把我搁床上后,老陈问我,喝水吗?我说,不喝。老陈说,你要喝水的话,就告诉我一声。我说,陈师傅,你回去吧,我没事的。老陈说,不行,你喝多了,身边没个人怎么行。我走了,不放心的。我醉得不行,不一会就打着呼噜睡着了。我不记得夜里醒过没有,喝过水没。第二天早晨,我醒来,却见老陈正躺在沙发上打瞌睡。
收集培养两周的F.oxysporum孢子,加入到含有100 mL PDB(Potato Dextrose Broth)培养基的250 mL三角瓶中,调节孢子终浓度为1.0×106spores/mL,分别加入硼酸(最终质量浓度为0、2、4、6 g/L)、肉桂油(最终质量分数为0、0.01%、0.02%、0.03%)、亚磷酸钾(终浓度为0、10、15、20 mmol/L),其中亚磷酸钾由KOH与H3PO3配制,终溶液中K2O:P2O5的摩尔比为28:26[18].在25 ℃、200 r/min条件下振荡培养,分别在3、4、5、6、7 h后用光学显微镜统计孢子萌发率,确定3种物质的最低抑菌浓度(Minimum inhibitory concentration,MIC),本文指相同培养时间内,空白组孢子萌发率≥85%时,处理组孢子萌发率≤10%时的抑菌物质浓度.并分别在培养6、7、8、9、10 h后,测量F.oxysporum芽管的长度.每种处理随机统计300个孢子的萌发率及芽管长度,重复3次,整个实验重复两次.
1.4 抑菌物质对F.oxysporum菌丝生物量积累及总糖吸收率的影响
将培养2周的F.oxysporum孢子悬浮液等量加入到含有100 mL PDB培养基的250 mL三角瓶中,调节孢子终浓度为1.0×106spores/mL.培养基中分别含有硼酸(4 g/L)、肉桂油(0.02%)、亚磷酸钾(15 mmol/L),空白PDB作为对照.25 ℃、200 r/min振荡培养24 h后,分别收集上清液和沉淀.沉淀在65 ℃烘箱中烘干至恒重(约2 h)后称重.上清液利用3,5-二硝基水杨酸法(DNS法)对培养基总糖含量进行定量分析[19].简述如下:取5 mL待测样品,加入4 mL 6 mol/L HCl溶液,沸水浴中水解0.5 h,冷却后定容至50 mL,然后用6 mol/L NaOH溶液中和至pH 7.0后用滤纸过滤,滤液用蒸馏水定容至100 mL.取出1 mL滤液,加入1 mL DNS试剂混匀后,在沸水浴中煮沸5 min,冷却后加入蒸馏水8 mL,利用分光光度计(UV-160,Shimadzu)测定A540光吸收值,通过葡萄糖标准曲线的对比,获得样品中可溶性糖浓度C.总糖吸收率=(C培养前-C培养后)/C培养前×100%,每种处理重复3次.
1.5 抑菌物质对F.oxysporum菌落扩展的影响
将100 μL 1.0×106spores/mL的F.oxysporum孢子悬浮液均匀涂布在PDA培养基上,培养24 h后,用打孔器获取直径为0.5 cm的菌饼,放置在含15 mL PDA培养基的培养皿(直径为9 cm)中央,培养基中分别含有硼酸(4 g/L)、肉桂油(0.02%)、亚磷酸钾(15 mmol/L),空白PDA作为对照.25 ℃培养,培养1、2、3、4、5、6 d后测量菌落直径(每种处理6次重复).
1.6 抑菌物质对F.oxysporum侵染番茄果实的影响
在含有硼酸(4 g/L)、肉桂油(0.02%)、亚磷酸钾(15 mmol/L)以及空白的PDB中加入F.oxysporum孢子,终浓度为1.0×106spores/mL.25 ℃、200 r/min振荡培养3 h后,收集孢子,无菌水漂洗两次后稀释至1×104spores/mL备用.接种果实为当地市场购买的番茄,成熟度基本一致、无明显机械损伤.在2%次氯酸钠溶液中浸泡2 min后清水漂洗,自然风干.每个处理取30个果实,用灭过菌的接种针在果实中部刺0.3 mm深的伤口,接种10 μL上述制备的病原菌孢子悬浮液,果实保存在95%相对湿度、25 ℃环境中,分别在2、4、6、8、10 d测量病斑直径,统计最终发病率.
1.7 数据统计与分析
实验中数据为3个或3个以上样本平均值,利用SPSS 11.5软件进行分析.比较两个以上数据时,采用单因素方差分析,且先对平均数进行Levene’s等方差性分析.若这些数据等方差,则用Duncan’s检验进行多重比较;若这些数据不满足等方差,则用Dunnett’s T3检验进行多重比较.P<0.05时为差异显著.
2 结果与分析
2.1 形态学观察结合遗传背景分析确定分离的病原菌为F.oxysporum
真核生物基因组中5.8 S、18 S、28 S rDNA基因组成一个转录单元,三者高度保守,其间的间隔区为内转录间隔区( Internal transcribed spacer, ITS).该间隔区进化相对迅速且具多态性,能够快速、准确地反映生物亲缘关系与分类情况[20].本研究从番茄上分离的病原菌经回接实验表明F.oxysporum为主要致病真菌(图 1A),致病性强,针刺接种后发病率达到100%.利用ITS4和ITS5通用引物扩增病原菌rDNA-ITS区域序列,获得550 bp左右的PCR产物(图 1D左),回收测序(图 1D右)后进行Megablast同源性分析.结果表明,分离菌株与F.oxysporum品系HWG2(1)、YTG3(1)、DTJ1(1)、PSU-ES157、PSU-ES115的相关序列匹配率均达到了100%.同时,在PDA平板上,菌落呈突起絮状,随着培养时间的增加,逐渐由白色转为粉色,最后变为暗红色(图 1B);显微镜下,小型分生孢子无色,单胞,卵形,而大型分生孢子多胞,镰刀型,略有弯曲,两端稍尖,与镰刀菌属的形态特征一致(图 1C),因此确定所分离的病原菌为F.oxysporum.
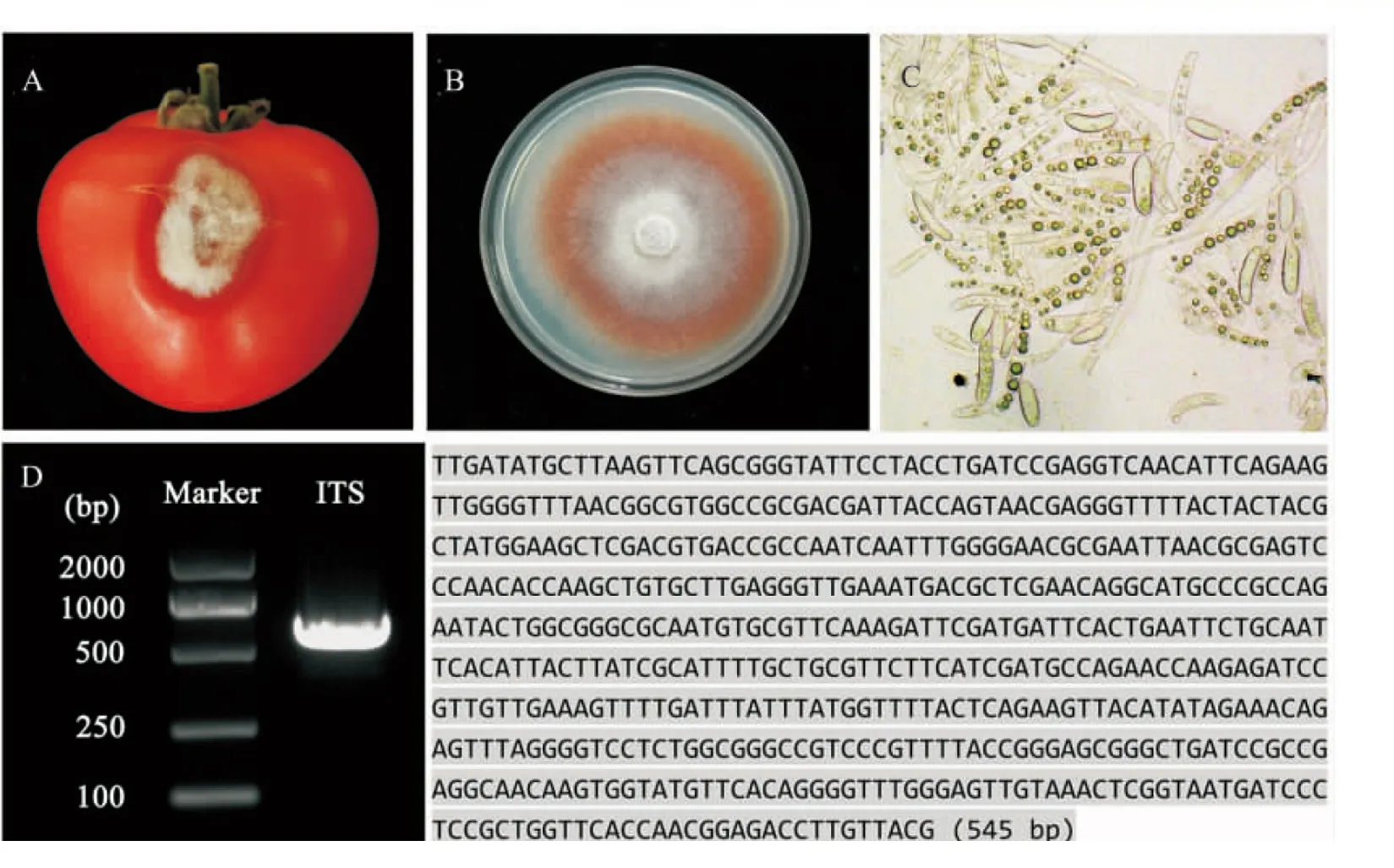
A:F. oxysporum侵染番茄果实症状;B:F. oxysporum菌落形态;C:F. oxysporum菌丝形态;D:ITS通用引物扩增产物(左)及测序结果(右).图1 Fusarium oxysporum的形态特征及rDNA-ITS分子特征Fig. 1 The phenotype and rDNA-ITS molecular character of Fusarium oxysporum
2.2 通过孢子萌发率确定外源抑菌物质最低抑菌浓度
利用不同浓度的硼酸、肉桂油以及亚磷酸钾处理F.oxysporum孢子,结果表明3种物质的抑菌效果与浓度正向相关,低浓度时几种物质对孢子的萌发影响较小,当硼酸、肉桂油以及亚磷酸钾浓度达到2 g/L、0.01%和10 mmol/L时,已经表现出对F.oxysporum孢子发育的抑制作用,孢子萌发率明显下降;随着浓度的逐渐增加,抑菌效果进一步加强,当硼酸、肉桂油以及亚磷酸钾浓度达到4 g/L、0.02%和15 mmol/L时,对照孢子培养7 h后,萌发率已超过85%,而处理孢子的萌发率均低于10%,因此,将4 g/L、0.02%和15 mmol/L确定为硼酸、肉桂油和亚磷酸钾对F.oxysporum的最低抑菌浓度(表 1).
注:表中数据为平均值±标准偏差,不同的小写字母代表显著性差异P<0.05.
2.3 外源抑菌物质抑制F.oxysporum芽管伸长及菌落扩展
通过显微镜观察,外源抑菌物质处理的F.oxysporum孢子,体积显著低于对照.但随着培养时间的延长,部分孢子还会继续完成膨大以及芽管伸长的过程.培养6 h后,硼酸及亚磷酸钾处理的孢子芽管长度与对照组差异不显著,肉桂油处理的孢子芽管长度最短;培养8 h后,各处理组孢子的芽管长度均显著低于对照组;培养10 h后,硼酸、肉桂油以及亚磷酸钾处理的孢子芽管长度之间无明显差异,且均不足对照的30%.结果表明,3种抑菌物质处理后,F.oxysporum芽管伸长速度显著低于对照,肉桂油抑制效果相对好于硼酸和亚磷酸钾(表 2).
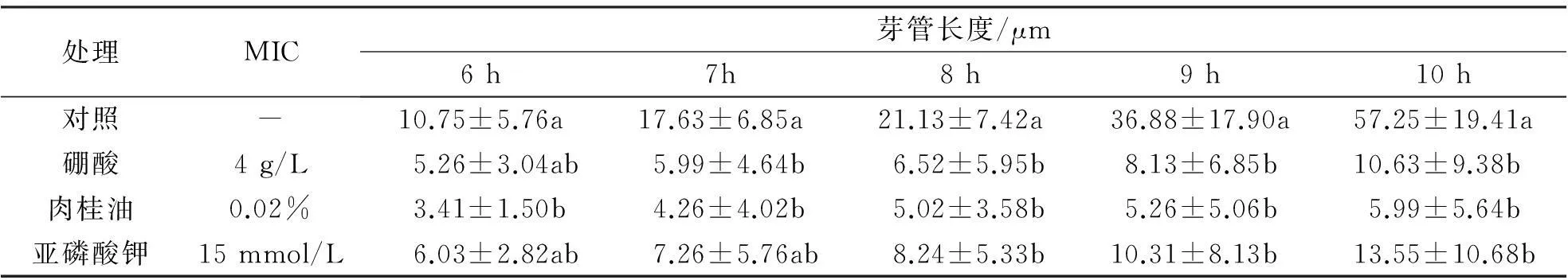
表2 不同抑菌物质对F. oxysporum芽管伸长的影响
注:表中数据为平均值±标准偏差,不同的小写字母代表显著性差异P﹤0.05,MIC代表最低抑菌浓度.
与对照相比,F.oxysporum在含有外源抑菌物质的PDA培养基上生长缓慢.培养2 d后,菌落在含亚磷酸钾的PDA上直径已显著小于对照,而在含有硼酸和肉桂油的PDA上,尚无明显的菌落形成;随着培养时间的增加,在含有不同抑菌物质PDA上的菌落差异逐渐增加,培养6 d后,在含有硼酸、肉桂油以及亚磷酸钾的PDA培养基上,菌落直径均值分别约为对照的28%、17%以及44%.肉桂油的抑制效果最好,亚磷酸钾的抑制效果相对较低(表 3).
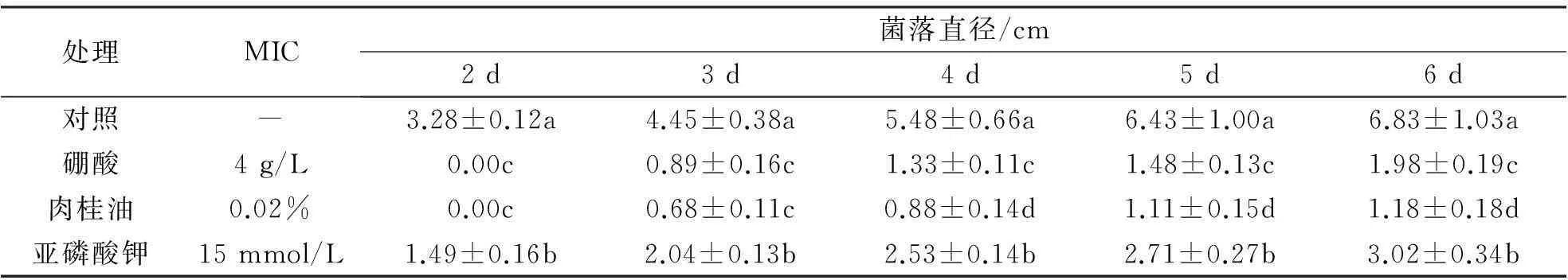
表3 不同抑菌物质对F. oxysporum菌落扩展的影响
注:表中数据为平均值±标准偏差,不同的小写字母代表显著性差异P<0.05,MIC代表最低抑菌浓度.
2.4 外源抑菌物质抑制F.oxysporum菌丝生物量积累并引起F.oxysporum糖吸收下降
菌丝生物量的积累是病原菌的生长速度及状态的重要指标,而作为异养微生物碳源的主要来源,培养基中的总糖变化反映着病原菌能量及物质代谢的状况.在含有外源抑菌物质的PDB培养基中培养36 h后,菌丝生物量与对照相比明显减少,培养84 h后,硼酸及亚磷酸钾的抑制效果基本相同,肉桂油处理后的菌丝生物量最少,仅为对照的13%(图 2A).总糖吸收率检测结果与生物量积累趋势基本一致,外源抑菌物质处理后,均表现出明显的下降,其中硼酸和肉桂油对F.oxysporum的糖吸收影响较大(图 2B).

图2 不同抑菌物质对F. oxysporum菌丝量及总糖吸收的影响Fig. 2 Effects of antifungal substances with minimal inhibitory concentration on mycelia production andabsorption of total carbohydrate
2.5 外源抑菌物质对F.oxysporum引起的番茄腐烂具有明显的防治效果
硼酸、肉桂油及亚磷酸钾对F.oxysporum诱发的番茄腐烂都有一定的防治效果.接种3 d后,对照果实的发病率即达到了100%,而外源物质处理后的接种果实的最终发病率减少了16%~28%.同时,硼酸和肉桂油对接种果实的病斑直径也有明显的抑制作用,接种10 d后,病斑直径分别为对照的42%和55%(表 4).
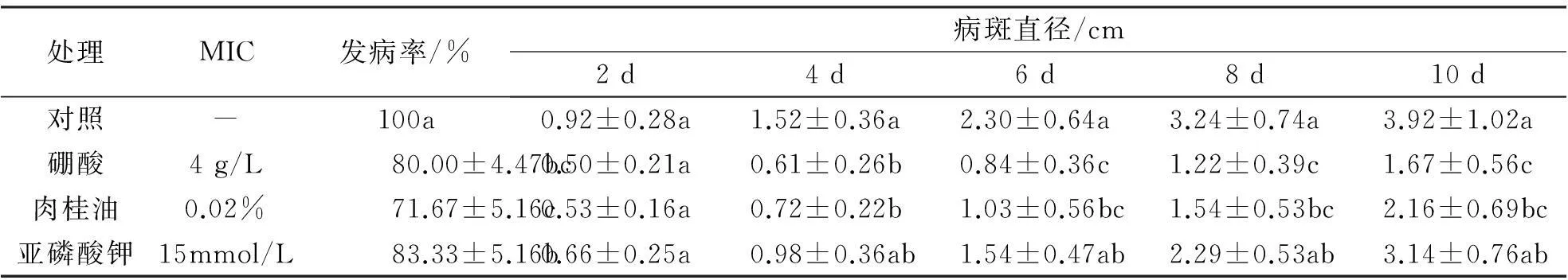
表4 不同抑菌物质对侵染果实的影响
注:表中数据为平均值±标准偏差,不同的小写字母代表显著性差异P﹤0.05,MIC代表最低抑菌浓度.
3 讨 论
硼酸曾被美国国家环境保护局(U.S. Environmental Protection Agency)当作控制蟑螂、白蚁、跳蚤和其他害虫的杀虫剂,目前已经有多篇硼酸应用于果实采后病害防治的报道,其抑菌机理可能是通过引起病原菌细胞内活性氧代谢紊乱,破坏线粒体的功能,导致蛋白质氧化损伤,抑制病原菌细胞外水解酶的分泌[6-21].Qin等的研究表明[4],硼酸能够直接破坏病原菌的质膜,导致胞内物质的渗漏,本研究中硼酸同样对F.oxysporum具有出色的抑制作用,但在实际应用中,硼酸能够引起皮肤刺激,其生物安全性有待进一步的评估.肉桂油为樟科植物肉桂(Cinnamomumcassia)的干燥枝、叶经水蒸气蒸馏得到的挥发油,在食品、香精香料、医药等方面有广泛应用.植物精油的成分复杂,肉桂油的主要抑菌活性成分为肉桂醛,由于本身为天然产物,使用安全,用量少,具有很大的应用前景.亚磷酸盐已广泛地用于疫霉菌(Phytophthora)的防治[22],氢氧化钾和亚磷酸反应的中间产物亚磷酸二氢钾(KH2PO3)和亚磷酸氢二钾(K2HPO3)是多种杀菌剂及肥料的活性成分.Thao等认为亚磷酸盐不但直接作用于病原菌,还与刺激宿主的防御反应有关[23],但亚磷酸盐确切的抑菌机制尚不明确.
在此基础上,本文评估了硼酸、肉桂油和亚磷酸钾3种颇具应用前景的抑菌物质对F.oxysporum发育及致病力的影响.结果表明3种抑菌物质均能有效抑制F.oxysporum孢子的萌发及芽管伸长;硼酸和肉桂油对F.oxysporum的菌落扩展及菌丝量积累的抑制效果优于亚磷酸钾;在番茄接种试验中,肉桂油对F.oxysporum诱导的番茄腐烂的防治效果最好.研究结果为F.oxysporum的综合防治拓展了思路.未来将着眼于3种抑菌物质对F.oxysporum具体抑菌机制研究及产业化应用,两种或多种抑菌物质的交互使用也有很大的研究空间.
[1] MICHIELSE C B, REP M. Pathogen profile update:Fusariumoxysporum[J]. Molecular Plant Pathology,2009,10(3):311-324.
[2] MIROCHA C J, ABBAS H K, KOMMEDAHL T, et al. Mycotoxin production byFusariumoxysporumandFusariumsporotrichioidesisolated from Baccharis spp. from Brazil[J]. Applied and Environmental Microbiology,1989,55(1):254-255.
[3] DRAKE S R, ELFVING D C, DRAKE M A, et al. Effects of aminoethoxyvinylglycine, ethephon, and 1-methylcyclopropene on Apple fruit quality at harvest and after storage[J]. Hort Technology,2006,16(1):16-23.
[4] QIN G Z, ZONG Y Y, CHEN Q L, et al. Inhibitory effect of boron againstBotrytiscinereaon table grapes and its possible mechanisms of action[J]. International Journal of Food Microbiology,2010,138(1/2):145-150.
[5] THOMIDIS T, EXADAKTYLOU E. Effect of boron on the development of brown rot (Monilinialaxa) on peaches[J]. Crop Protection,2010,29(6):572-576.
[6]SHI X Q, LI B Q, QIN G Z, et al. Mechanism of antifungal action of borate againstColletotrichumgloeosporioidesrelated to mitochondrial degradation in spores[J]. Postharvest Biology and Technology,2012,67:138-143.
[7] CAO B H, LI H, TIAN S P, et al. Boron improves the biocontrol activity ofCryptococcuslaurentiiagainstPenicilliumexpansumin jujube fruit[J]. Postharvest Biology and Technology,2012,68:16-21.
[8] SINGH G, MAURYA S, DELAMPASONA M P, et al. A comparison of chemical, antioxidant and antimicrobial studies of cinnamon leaf and bark volatile oils, oleoresins and their constituents[J]. Food and Chemical Toxicology,2007,45(9):1650-1661.
[9] XING Y G, LI X H, XU Q L, et al. Antifungal activities of cinnamon oil againstRhizopusnigricans,AspergillusflavusandPenicilliumexpansumin vitro and in vivo fruit test[J]. International Journal of Food Science and Technology,2010,45(9):1837-1842.
[10] MANSO S, CACHO-NERIN F, BECERRIL R, et al. Combined analytical and microbiological tools to study the effect onAspergillusflavusof cinnamon essential oil contained in food packaging[J]. Food Control,2013,30(2):370-378.
[11] XING F G, HUA H J, SELVARAJ J N, et al. Growth inhibition and morphological alterations ofFusariumverticillioidesby cinnamon oil and cinnamaldehyde[J]. Food Control,2014,46:343-350.
[12] RAJKOVIC K, PEKMEZOVIC M, BARAC A, et al. Inhibitory effect of thyme and cinnamon essential oils onAspergillusflavus: Optimization and activity prediction model development[J]. Industrial Crops and Products,2015,65:7-13.
[13] SHEARER B L, CRANE C E. Influence of site and rate of low-volume aerial phosphite spray on lesion development ofPhytophthoracinnamomiand phosphite persistence inLambertiainermisvar. inermis andBanksiagrandis[J]. Australasian Plant Pathology,2009,38(3):288-304.
[14] REBOLLAR-ALVITER A, WILSON L L, MADDEN L V, et al. A comparative evaluation of post-infection efficacy of mefenoxam and Potassium phosphite with protectant efficacy of azoxystrobin and Potassium phosphite for controlling leather rot of strawberry caused byPhytophthoracactorum[J]. Crop Protection,2010,29(4):349-353.
[15] OLIVIERI F P, FELDMAN M L, MACHINANDIARENA M F, et al. Phosphite applications induce molecular modifications in potato tuber periderm and cortex that enhance resistance to pathogens[J]. Crop Protection,2012,32:1-6.
[16] AMIRI A, BOMPEIX G. Control ofPenicilliumexpansumwith potassium phosphite and heat treatment[J]. Crop Protection,2011,30(2):222-227.
[17] BURRA D D, BERKOWITZ O, HEDLEY P E, et al. Phosphite-induced changes of the transcriptome and secretome inSolanumtuberosumleading to resistance againstPhytophthorainfestans[J]. BMC Plant Biology,2014,14:254-270.
[18] THAO H T B, YAMSKAWA T, SHIBATA K, et al. Growth response of komatsuna (Brassicarapavar. peruviridis) to root and foliar applications of phosphate[J]. Plant and Soil,2008,308(1):1-10.
[19] SAQIB A A, WHITNEY P J. Differential behaviour of the dinitrosalicylic acid (DNS) reagent towards mono-and di-saccharide sugars[J]. Biomass and Bioenergy,2011,35(11):4748-4750.
[20] PARK M J, CHOI Y J, HONG S B, et al. Genetic variability and mycohost association of Ampelomyces quisqualis isolates inferred from phylogenetic analyses of ITS rDNA and actin gene sequences[J]. Fungal Biology,2010,114(2/3):235-247.
[21] QIN G Z, TIAN S P, CHAN Z L, et al. Crucial role of antioxidant proteins and hydrolytic enzymes in pathogenicity ofPenicilliumexpansum[J]. Molecular & Cellular Proteomics,2007,6(3):425-438.
[22] WONG M H, MCCOMB J, HARDY G S, et al. Phosphite induces expression of a putative proteophosphoglycan gene inPhytophthoracinnamomi[J]. Australasian Plant Pathology,2009,38(3):235-241.
[23] THAO H T B, YAMAKAQA T. Phosphite (phosphorous acid): Fungicide, fertilizer or bio-stimulator?[J] Soil Science and Plant Nutrition,2009,55(2):228-234.
Effects of Boric Acid, Cinnamon Oil and Potassium Phosphite on the Development of Postharvest DiseaseFusariumOxysporum
ZHOU Jiayi, LIU Yahong, WANG Yani, QI Qinqin, WANG Ying, LAI Tongfei, ZHOU Ting
(Hangzhou Key Laboratory for Safety of Agricultural Products, College of Life and Environmental Science, Hangzhou Normal University,Hangzhou 310036, China)
Fusariumoxysporumis a kind of fungal pathogen that causesFusariumwilt, so that searching effective control methods has the vital practical significance. In this study, one of main pathogens from naturally infected tomato (Solanumlycopersicum) is isolated and identified by internal transcribed spacer sequences of ribosomal DNA (rDNA-ITS). Then minimum inhibitory concentrations (MICs) of boric acid, cinnamon oil and potassium phosphiteare confirmed. The relationship between three exogenous antifungal substances and fungal growth or pathogenicity is evaluated via the assessment of physiological, biochemical indexes and inoculation experiment of fruits. The results indicate that the isolated pathogen isFusariumoxysporum. The antibacterial effect of the 3 substances is proportional to the concentration.Under the minimum concentration,the spore germination can be inhibited, germ tube elongation and mycelium extension rate can be reduced, biomass accumulation can be decreased, sugar malabsorption ofF.oxysporumwill be caused, and the fruit rot of tomato caused byF.oxysporumcan be controlled, especially in the control of cinnamon oil.
Fusariumoxysporum; internal transcribed spacer; antifungal substance; preservation
2015-07-02
浙江省大学生科技创新活动暨新苗人才计划项目(2014R421028);国家级大学生创新创业训练计划项目(201410346016);杭州市农业科研攻关项目(20140432B02);杭州师范大学本科生创新能力提升工程项目(CX2015098).
周 婷(1983—),女,讲师,博士,主要从事农产品贮藏与加工技术研究. E-mail: zt20100061@163.com
10.3969/j.issn.1674-232X.2016.02.007
S436.412
A
1674-232X(2016)02-0149-07
