一种合成α-硫代-β-氨基酸酯的新方法
2016-05-09扈晓艳胡方芝袁伟成张晓梅
扈晓艳 , 胡方芝 , 袁伟成 , 张晓梅
(1.中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100049)
·快递论文·
一种合成α-硫代-β-氨基酸酯的新方法
扈晓艳1,2, 胡方芝1,2, 袁伟成1*, 张晓梅1*
(1.中国科学院 成都有机化学研究所,四川 成都 610041; 2. 中国科学院大学,北京 100049)
以β-烯胺酯和N-硫代-丁二酰亚胺为原料,溴化铜为催化剂,经氧化偶联反应制得5个新型α-硫代-β-脱氢氨基酸酯(3a~3e); 3经氢化硅烷化反应,合成了5个α-硫代-β-氨基酸衍生物(4a~4e),其结构由1H NMR表征。在最佳反应条件(3 0.1 mmol,三氯硅烷2.0 eq., DCE 1 mL,于室温反应12 h)下,4a收率97%。
α-硫代-β-氨基酸衍生物; 氢化硅烷化; 合成
α-硫代-β-氨基酸衍生物作为一类多官能团化合物,除了用于合成手性N,S-配体[1-2]外,也是合成多种具有生物活性的天然产物[3]和药物分子[4-5]的重要砌块。目前报道的合成方法主要有:硫亲核试剂和氮杂环丙烷的开环反应法[6-11];硫亲核试剂和亚胺的Mannich加成反应法[12-13];β-氨基酸酯和硫醚的偶联反应法[14-15]。这些方法都有其自身的局限性,有的原料昂贵,有的反应条件苛刻。基于此类化合物的重要应用价值和现有合成方法的局限性,开发新的合成α-硫代-β-氨基酸衍生物的方法尤为重要。
本文以β-烯胺酯(1a~1d)和N-硫代-丁二酰亚胺(2a, 2e)为原料,溴化铜为催化剂,经氧化偶联反应制得5个新型α-硫代-β-脱氢氨基酸酯(3a~3e);室温条件下,3发生自催化氢化硅烷化反应合成了5个α-硫代-β-氨基酸衍生物(4a~4e),收率45%~97%。其结构经1H NMR表征。该方法为首次报道。以2-苄硫基-3-(N-对甲氧苯基)-3-苯丙烯酸乙酯(3a)经自催化氢化硅烷化反应合成2-苄硫基-3-(N-对甲氧苯基)-3-苯丙酸乙酯(4a)为模板反应,优化了其反应条件,并对底物进行了扩展研究。
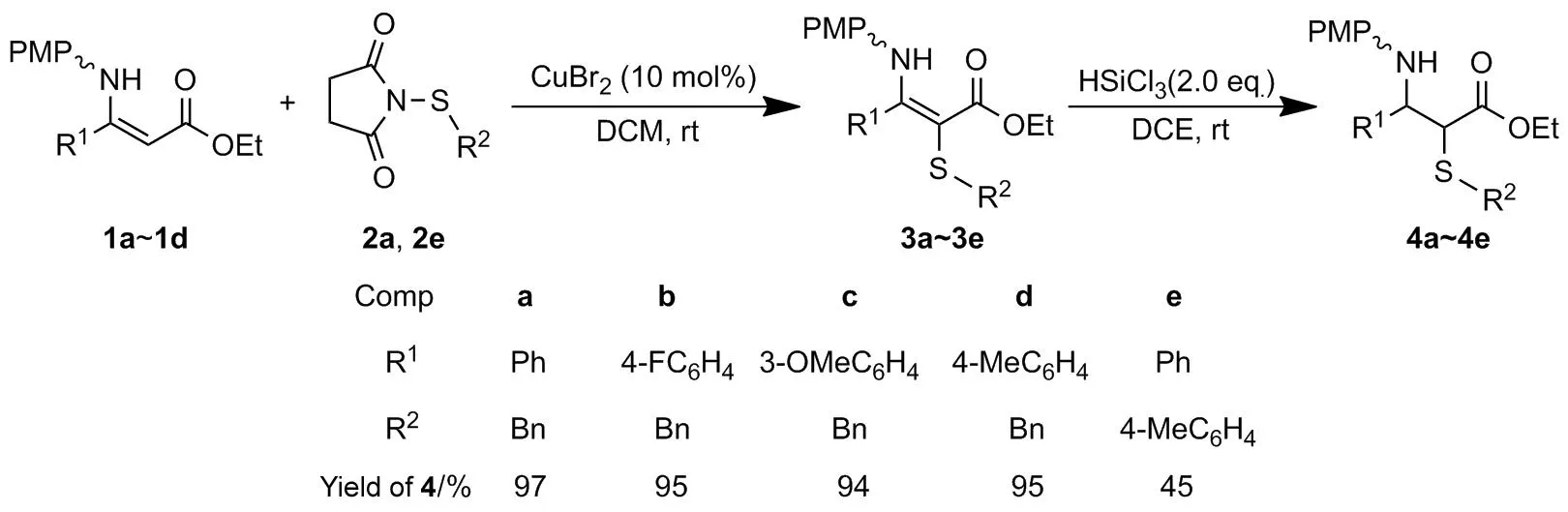
Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker-300型核磁共振仪测定(CDCl3为溶剂,TMS 为内标)。
石油醚和乙酸乙酯使用前重蒸;二氯甲烷和1,2-二氯乙烷使用前用金属钠、氢化钙等干燥剂处理。其余所用试剂均为分析纯。
1.2 合成
(1) 3a~3e的合成(以3a为例)
在反应瓶中加入β-烯胺酯(1a) 2.97 g(10 mmol)和二氯甲烷50 mL,搅拌使其溶解;加入溴化铜0.50 g和N-苄硫基丁二酰亚胺(2a) 2.60 g(10 mmol),于室温反应过夜。用水(3×15 mL)洗涤,合并有机相,用无水硫酸钠干燥,浓缩,剩余物经柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=100 ∶1]纯化得3a。
用类似方法合成3b~3e。
3a: 黄色固体,收率64%;1H NMRδ: 11.48(s, 1H), 7.20~7.26(m, 4H), 7.11~7.16(m, 2H), 6.97~7.00(m, 2H), 6.68~6.70(m, 2H), 6.54(m, 4H), 4.31(q,J=7.0 Hz, 2H), 3.64(s, 3H), 3.59(s, 2H), 1.42(t,J=7.0 Hz, 3H)。
3b: 黄色液体,收率20%;1H NMRδ: 11.41(s, 1H), 7.23(dd,J=11.8 Hz, 5.0 Hz, 3H), 6.97(dd,J=7.3 Hz, 1.9 Hz, 2H), 6.78(t,J=8.7 Hz, 2H), 6.54(ddd,J=16.8 Hz, 7.3 Hz, 3.0 Hz, 6H), 4.32(q,J=7.1 Hz, 2H), 3.67(s, 3H), 3.58(s, 2H), 1.42(t,J=7.1 Hz, 3H)。
3c: 黄色液体,收率56%;1H NMRδ: 11.45(s, 1H), 7.28~7.17(m, 4H), 7.08(d,J=8.1 Hz, 1H), 7.05~6.96(m, 2H), 6.77(dd,J=8.0 Hz, 2.2 Hz, 1H), 6.58(d,J=11.6 Hz, 4H), 6.32(dd,J=11.2 Hz, 4.9 Hz, 2H), 4.39~4.23(m, 2H), 3.66(d,J=4.7 Hz, 7H), 3.61(s, 2H), 1.39(dd,J=16.5 Hz, 9.4 Hz, 5H)。
3d: 黄色液体,收率25%;1H NMRδ: 11.41(s, 1H), 7.23(dd,J=11.8 Hz, 5.0 Hz, 3H), 6.97(dd,J=7.3 Hz, 1.9 Hz, 2H), 6.78(t,J=8.7 Hz, 2H), 6.54(ddd,J=16.8 Hz, 7.3 Hz, 3.0 Hz, 5H), 4.32(q,J=7.1 Hz, 2H), 3.67(s, 3H), 3.58(s, 2H), 1.42(t,J=7.1 Hz, 3H)。
3e: 白色固体,收率47%;1H NMRδ: 11.71(s, 1H), 7.29~7.14(m, 3H), 7.09(dd,J=8.0 Hz, 1.5 Hz, 2H), 7.06~6.92(m, 4H), 6.68~6.50(m, 4H), 4.21(q,J=7.1 Hz, 2H), 3.65(s, 3H), 2.27(s, 3H), 1.18(t,J=7.1 Hz, 3H)。
(2) 4a~4e的合成通法
在反应瓶中加入3 0.1 mmol和无水1,2-二氯乙烷(DCE) 1.0 mL,用橡胶塞密封后,用注射器加入现配的DCE/三氯硅烷溶液[V(DCE)/V(三氯硅烷)=1/4]0.10 mL,于室温反应至终点。用饱和碳酸氢钠水溶液淬灭反应,用乙酸乙酯(3×15 mL)萃取,合并有机相,用饱和食盐水洗涤,无水硫酸钠干燥。减压浓缩,剩余物经柱层析(洗脱剂: A=100 ∶1)纯化得4。
4a: 黄色油状物;1H NMRδ: 7.39(d,J=1.7 Hz, 2H), 7.36~7.22(m, 8H), 6.65(d,J=8.8 Hz, 2H), 6.44(d,J=8.9 Hz, 2H), 4.55(d,J=8.8 Hz, 2H), 4.02(q,J=7.1 Hz, 2H), 3.75(d,J=4.3 Hz, 2H), 3.68(s, 3H), 3.49(d,J=8.8 Hz, 1H), 1.10(t,J=7.11 Hz, 3H)。
4b: 黄色油状物;1H NMRδ: 7.38~7.31(m, 3H), 7.30~7.15(m, 4H), 6.97(t,J=8.6 Hz, 2H), 6.65(d,J=8.8 Hz, 2H), 6.42(d,J=8.8 Hz, 2H), 4.51(d,J=8.8 Hz, 1H), 4.04(q,J=7.1 Hz, 2H), 3.79(s, 2H), 3.69(s, 3H), 3.45(d,J=8.8 Hz, 1H), 1.13(t,J=7.1 Hz, 3H)。
4c: 黄色液体;1H NMRδ: 7.31~7.15(m, 6H), 7.01~6.88(m, 2H), 6.78(dd,J=8.2 Hz, 1.6 Hz, 1H), 6.70~6.59(m, 2H), 6.45(d,J=8.9 Hz, 2H), 4.53(d,J=8.7 Hz, 1H), 4.04(q,J=7.1 Hz, 2H), 3.82~3.70(m, 5H), 3.71~3.64(m, 3H), 3.50(d,J=8.7 Hz, 1H), 1.12(t,J=7.1 Hz, 3H)。
4d: 黄色液体;1H NMRδ: 7.31~7.20(m, 7H), 7.09(d,J=7.9 Hz, 2H), 6.64(t,J=11.7 Hz, 2H), 6.45(d,J=8.7 Hz, 2H), 4.53(d,J=8.7 Hz, 1H), 4.04(q,J=7.1 Hz, 2H), 3.78(t,J=8.5 Hz, 2H), 3.74~3.61(m, 3H), 3.49(t,J=11.8 Hz, 1H), 2.31(s, 3H), 1.12(t,J=7.1 Hz, 3H)。
4e: 黄色油状物;1H NMRδ: 7.40(d,J=7.0 Hz, 2H), 7.27(dt,J=13.3 Hz, 8.9 Hz, 5H), 7.08(d,J=8.0 Hz, 2H), 6.67(d,J=8.9 Hz, 2H), 6.50(d,J=8.9 Hz, 2H), 4.70(s, 1H), 4.49(d,J=9.0 Hz, 1H), 3.93(q,J=7.1 Hz, 2H), 3.83(d,J=9.0 Hz, 1H), 3.69(s, 3H), 2.32(s, 3H), 1.00(t,J=7.1 Hz, 3H)。
2 结果与讨论
2.1 合成4的反应条件优化
3a 0.1 mmol,三氯硅烷2.0 eq., 溶剂 1 mL,其余反应条件同1.2(2),以3a经自催化氢化硅烷化反应合成4a为模板反应,考察溶剂、反应时间和反应温度对4a收率的影响,结果见表1。
由表1中No.1~No.8可见,在相同的反应温度下,以二氯甲烷,DCE和氯仿为溶剂时,收率较高(94%~97%),其中,DCE为溶剂时,收率最高(97%);以Cl3CCH3为溶剂时,反应很慢,延长反应时间至48 h,仍有大量原料存在,收率仅13%(No.4);以THF为溶剂时,反应速率很慢且有副产物产生,收率71%(No.5);以甲苯和乙醚为溶剂时,反应几乎不发生,只得到痕量产物 (No.6和No.7);以DMF为溶剂时,反应不发生(No.8)。
以二氯甲烷为溶剂,降低反应温度至0 ℃,收率降低至88%(No.9);继续降低温度至-20 ℃,反应速率降低,同时大部分原料都转化成副产物,只有痕量产物(No.10)。
综上所述,氢化硅烷化的最佳反应条件为: 3a 0.1 mmol,三氯硅烷2.0 eq., DCE 1 mL,于室温反应12 h。
表1 氢化硅烷化的反应条件优化*
Figure 1 Optimization of the conditions of hydrosilylation

No.溶剂反应时间/h反应温度/℃收率/%a1CH2Cl21225942DCE1225973CHCl33625954Cl3CCH34825135THF4825716Et2O4825痕量7Toluene4825痕量8DMF4825NR9CH2Cl21208810CH2Cl248-20痕量
*3a 0.1 mmol,三氯硅烷2.0 eq.,其余反应条件同1.2(2);a分离收率。
2.2 底物扩展
在最优反应条件下,对底物进行扩展,结果见Scheme 1。由Scheme 1可见,当R2为苄基时,R1上的取代基不论是吸电子基团还是给电子基团,收率较高(4a~4d);当R2为对甲苯基时,主要生成副产物,收率低(4e)。
3 结论
以β-脱氢氨基酸酯和N-硫代-丁二酰亚胺为原料,经过一步反应合成了5个新型α-硫代-β-脱氢氨基酸酯。
在最佳反应条件(3a 0.1 mmol,三氯硅烷2.0 eq., DCE 1 mL,于室温反应12 h)下,实现了α-硫代-β-脱氢氨基酸酯的自催化氢化硅烷化,合成了5个α-硫代-β-氨基酸衍生物,收率高达97%。 这为此类化合物的合成提供了新思路。
[1] Ekegren J K, Roth P, Källström K,etal. Synthesis and evaluation ofN,S-compounds as chiral ligands for transfer hydrogenation of acetophenone[J].Organic & Biomolecular Chemistry,2003,1:358-366.
[2] Spitz C, Lohier J F O, Reboul V,etal. Catalytic generation of cesium acetylide by CsF:Synthesis of 1,3-benzothiazines from cyclic sulfenamides[J].Organic Letters,2009,11:2776-2779.
[3] Bae J H, Shin S H, Park C S,etal. Preparation of cysteinol derivatives by highly regioselective ring opening of nonactivated chiral aziridines by thiols[J].Tetrahedron,1999,55:10041-10046.
[4] Schwartz A, Madan P B, Mohacsi E,etal. Enantioselective synthesis of calcium channel blockers of the diltiazem group[J].The Journal of Organic Chemistry,1992,57:851-856.
[5] Bariwal J B, Upadhyay K D, Manvar A T,etal. 1,5-Benzothiazepine,a versatile pharmacophore:A review[J].European Journal of Medicinal Chemistry,2008,43:2279-2290.
[6] Li G, Wei H X, Kim S H,etal. Transition metal-catalyzed regioselective and stereoselective aminochlorination of cinnamic esters[J].Organic Letters,1999,1:395-398.
[7] Harpaz Z, Siman P, Kumar K S A,etal. Protein synthesis assisted by native chemical ligation at leucine[J].ChemBioChem,2010,11:1232-1235.
[8] Cassani C, Bernardi L, Fini F,etal. Catalytic asymmetric Mannich reactions of sulfonylacetates[J].Angewandte Chemie International Edition,2009,48:5694-5697.
[9] Zhao Y, Wang G, Zhou S,etal. Diastereoselective formation of aziridines from diazocarbonyl compounds andN-(O-pivaloylated d-galactosyl)benzylideneamines and ring-opening reactions withp-toluenethiol[J].Organic & Biomolecular Chemistry,2014,12:3362-3365.
[10] Matthias M, Norbert D K, Matthias D. Selective synthesis ofcis- andtrans-2-(methyl/phenyl)-3-(trifluoromethyl)aziridines and their regio- and stereospecific ring opening[J].The Journal of Organic Chemistry,2014,79:5558-5568.
[11] Llaveria J, Beltrán, Sameera W M C,etal. Chemo-,regio-,and stereoselective silver-catalyzed aziridination of dienes:Scope,mechanistic studies,and ring-opening reactions[J].Journal of the American Chemical Society,2014,136:5342-5350.
[12] David C, Bischoff L, Meudal H,etal. Investigation of subsite preferences in aminopeptidase A (EC 3.4.11.7) led to the design of the first highly potent and selective inhibitors of this enzyme[J].Journal of Medicinal Chemistry,1999,42:5197-5211.
[13] Heredia-Moya J, Kirk K L. Synthesis ofβ-(S-methyl)thioaspartic acid and derivatives[J].Bioorganic & Medicinal Chemistry,2008,16:5908-5913.
[14] Kantam M L, Mahendar K, Sreedhar B,etal. Synthesis ofα-sulfanyl-β-amino acid derivatives by using nanocrystalline magnesium oxide[J].Tetrahedron,2010,66:5042-5052.
[15] Cassani C, Bernardi L, Fini F,etal. Catalytic asymmetric Mannich reactions of sulfonylacetates[J].Angewandte Chemie International Edition,2009,48:5694-5697.
A New Synthetic Method ofα-Sulfo-β-amino Acid Esters
HU Xiao-yan1,2, HU Fang-zhi1,2, YUAN Wei-cheng1*, ZHANG Xiao-mei1*
(1. Chengdu Institute of Organic Chemistry, Chinese Academy of Sciences, Chengdu 610041, China;2. University of Chinese Academy of Sciences, Beijing 100049, China)
Five novelα-sulfo-β-enamioesters(3a~3e) were synthesized by oxidative coupling reaction ofβ-enamioesters andN-(thio)succinimide, using CuBr2as the catalyst. Then they were hydrosilylated to afford fiveα-sulfo-β-amino acid moieties(4a~4e). The structures were characterized by1H NMR. Under the optimized reaction conditions(3 0.1 mmol, HSiCl32.0 eq., DCE 1 mL, at room temperature for 12 h), the yield of 4a was 97%.
α-sulfo-β-amino acid derivative; hydrosilylation; synthesis
2015-04-20; 修订日期: 2016-01-20
四川省青年科技基金资助项目
扈晓艳(1988-),女,汉族,河南辉县人,博士研究生,主要从事不对称合成研究。 E-mail: huxiaoyan06@126.com
张晓梅,研究员, E-mail: xmzhang@cioc.ac.cn; 袁伟成,研究员, E-mail: yuanwc@cioc.ac.cn
R977.4; O621.3 文献标志码: A DOI: 10.15952/j.cnki.cjsc.1005-1511.2016.04.15164
