黄连解毒汤最佳提取工艺研究
2016-04-22徐玉玲谭小君徐腾达周传勇
徐玉玲, 谭小君, 徐腾达, 周传勇, 刘 涛
(成都大学 药学与生物工程学院, 四川 成都 610106)
黄连解毒汤最佳提取工艺研究
徐玉玲, 谭小君, 徐腾达, 周传勇, 刘涛
(成都大学 药学与生物工程学院, 四川 成都610106)
摘要:为了优选黄连解毒汤最佳提取工艺.以盐酸小檗碱、黄芩苷、栀子苷及固含物含量作为指标成分,利用单因素试验及正交试验对提取、精制工艺进行研究,优选黄连解毒汤最佳提取工艺参数.黄连、黄柏组,最佳提取工艺为6倍量70%乙醇,提取3次,每次1.5 h;黄芩、栀子组,最佳提取工艺为12倍量水,提取3次,提取时间0.5 h,黄芩、栀子的精制工艺为加95%乙醇使其醇沉浓度为65%.结果表明,优选得到的提取工艺稳定可行,可为黄连解毒汤的提取提供实验依据.
关键词:黄连解毒汤;提取工艺;正交设计;液相色谱法
0引言
黄连解毒汤由黄连、黄柏、黄芩、栀子等组成,是治疗火热毒盛、充斥三焦的常用方,临床上除用于细菌性感染性疾病外,还用于防治心脑血管疾病、老年性痴呆等症[1-2].此汤剂的传统煎煮方法为合煎,按经验掌握煎煮时间与加水量[3],但在煎煮过程中黄连、黄柏中的生物碱与黄芩中的黄芩苷发生反应生成沉淀,从而影响药效[4-6].故本研究将方中4味药材分成2组,黄连、黄柏组和黄芩、栀子组,分煎,因黄连、黄柏中的小檗碱水溶性差,为最大程度保留该类成分,采用乙醇提取;黄芩、栀子组采用水提醇沉法,去除醇不溶性杂质,保留有效成分.
1仪器与试药
1.1仪器
实验所用仪器包括:DZF-6050A型真空干燥箱,北京中兴伟业仪器有限公司;KQ-100E型超声波消洗器,昆山超声仪器有限公司;FW100型高速万能粉碎机,北京科伟永兴仪器有限公司;FA2004型分析电子天平,上海良平仪器仪表有限公司;UV230Ⅱ型高效液相色谱仪,大连依利特分析仪器有限公司;HH-S6型电热恒温水浴锅,北京科伟永兴仪器有限公司.
1.2试药
实验所用试药包括:盐酸小檗碱对照品(批号,110713-201212)、黄芩苷对照品(批号,110715-201318)、栀子苷对照品(批号,110749-201115)均购于中国食品药品检定研究院,供含量测定用;黄连、黄柏、黄芩、栀子4味药均购自于四川省中药饮片有限责任公司,经鉴定均符合2010年版《中国药典》要求;甲醇为色谱纯,水为纯净水,其他试剂均为分析纯.
2方法与结果
2.1盐酸小檗碱含量测定
2.1.1色谱条件.
实验的色谱条件为:SinoChrom ODS-BP色谱柱(200 mm×4.6 mm,5 μm);流动相为乙腈—0.1%磷酸溶液(50∶50)(每100 mL加入十二烷基磺酸钠0.1 g);流速1.0 mL/min,进样量10 μL,检测波长265 nm.
2.1.2对照品溶液的制备.
取盐酸小檗碱对照品适量,精密称定,加流动相制成含盐酸小檗碱0.0989 mg/mL的溶液,制得对照品溶液.
每个定位器对应一个运动支链,以支链3为例,建立有关基坐标系、定位器参考坐标系、球铰中心、托架坐标系的空间矢量链,托架矢量链建立方式如图4所示,定位器1,2,4对应的空间矢量链建立方法类似。
2.1.3供试品溶液的制备.
按处方比例称取药材,按一定条件提取,过滤,精密量取续滤液1 mL,置100 mL的容量瓶中,加70%乙醇定容至刻度,摇匀,制得供试品溶液.
2.2黄芩苷含量测定
2.2.1色谱条件.
实验的色谱条件为:SinoChrom ODS-BP色谱柱(200 mm×4.6 mm,5 μm);流动相为甲醇—水—磷酸(47∶53∶0.2);流速1.0 mL/min,进样量10 μL,检测波长280 nm.
2.2.2对照品溶液的制备.
取黄芩苷对照品适量,精密称定,加甲醇制成含黄芩苷0.0505 mg/mL的溶液,制得对照品溶液.
2.2.3供试品溶液的制备.
2.3栀子苷含量测定
2.3.1色谱条件.
实验色谱条件为:SinoChrom ODS-BP色谱柱(200 mm×4.6 mm,5 μm);流动相为乙腈—水(15∶85);流速1.0 mL/min,进样量10 μL,检测波长238 nm.
2.3.2对照品溶液的制备.
取栀子苷对照品适量,精密称定,加甲醇制成含栀子苷0.1283 mg/mL的溶液,制得对照品溶液.
2.3.3供试品溶液的制备.
按处方比例称取药材,按一定条件提取,过滤,精密量取续滤液10 mL,置100 mL的容量瓶中,加水定容至刻度,摇匀,制得供试品溶液.
2.4固含物的测定
量取100 mL提取液置蒸发皿中,水浴挥干溶剂,置105 ℃烘箱中,干燥3 h,取出,置干燥器中冷却至室温,称重,计算.
2.5黄连、黄柏组
2.5.1乙醇浓度考察.
利用单因素实验对乙醇浓度进行筛选,按处方比例称取黄连60 g、黄柏40 g,平行4份,分别加入50%、60%、70%、80%的乙醇600 mL,回流提取2次,每次1.5 h,测定盐酸小檗碱含量及固含物含量,优选乙醇浓度.结果显示,当乙醇浓度为70%时盐酸小檗碱的提取转移率、固含物含量均较高,故选择70%的乙醇作为黄连、黄柏提取的溶剂.
2.5.2提取正交试验设计.
选取溶媒用量、提取时间以及提取次数为考察因素,以盐酸小檗碱含量、固含物含量的综合评分为指标,按处方比例称取黄连30 g、黄柏20 g,共9份,按L9(34)正交试验表进行试验.因素水平安排见表1,试验安排及结果见表2,方差分析见表3.

表1 因素水平表
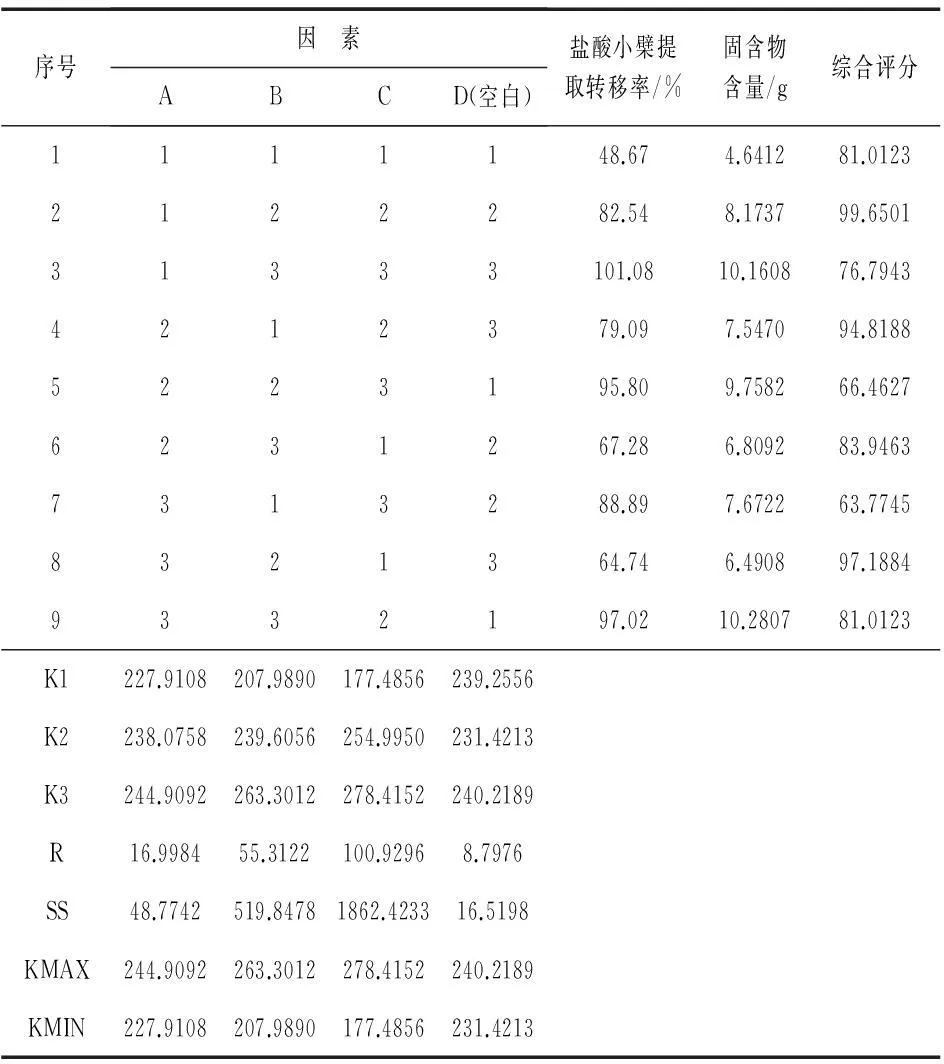
表2 正交试验安排及结果

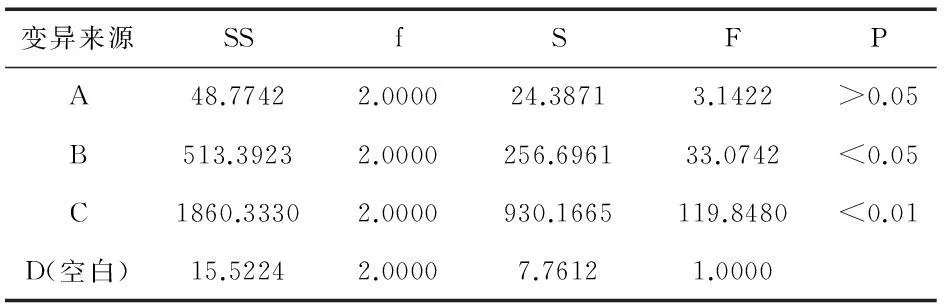
表3 正交试验方差分析表
由表2直观分析可知,各因素对黄连、黄柏提取工艺的顺序为C>B>A.表3方差分析表明,因素B的影响具有显著性意义,因素C的影响具有极显著性意义,因素A的影响则无显著性意义.因此,确定最佳提取工艺为A1B3C3,即加6倍量70%乙醇,提取3次,每次1.5 h.
2.5.3验证实验.
按处方比例分别称取药材50 g(黄连30 g、黄柏20 g)、100 g(黄连60 g、黄柏40 g)、150 g(黄连90 g、黄柏60 g)进行验证实验,结果见表4.结果表明,优选出的提取工艺条件重复性好,工艺稳定可行.

表4 黄连、黄柏组验证实验
2.6黄芩、栀子组
2.6.1提取正交试验设计.
影响提取效果的主要因素有加水量、提取时间以及提取次数.以黄芩苷、栀子苷含量及固含物含量的综合评分为指标,按处方比例称取黄芩40 g、栀子60 g,共9份,按L9(34)正交试验表进行实验.因素水平安排见表5,实验安排及结果见表6,方差分析见表7.

表5 因素水平表
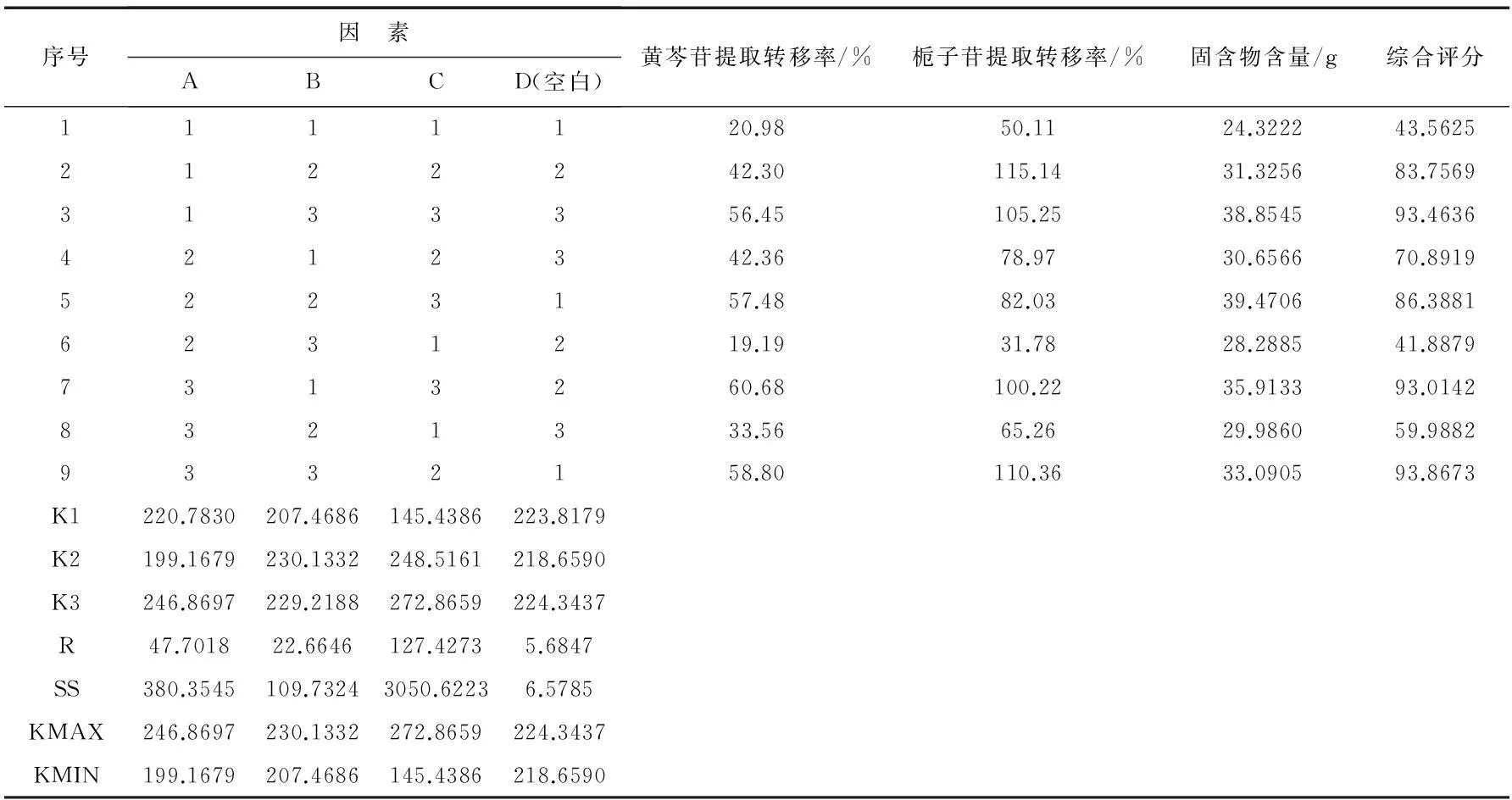
表6 正交试验安排及结果

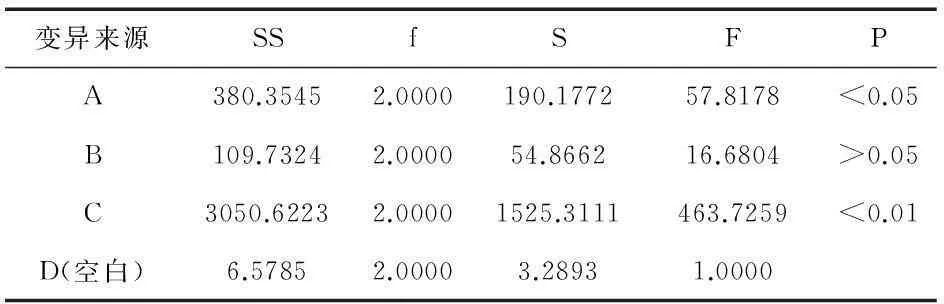
表7 正交试验方差分析表
由表6直观分析可知,各因素对黄芩、栀子提取工艺的顺序为C>A>B.方差分析表明,因素A的影响具有显著性意义,因素C的影响具有极显著性意义,因素B的影响则无显著性意义.因此,确定最佳提取工艺为A3B1C3,即加12倍量水,提取3次,每次0.5 h.
2.6.2验证实验.
按优选的提取工艺参数,按处方比例分别称取药材100 g(黄芩60 g、栀子40 g)、200 g(黄芩120 g、栀子80 g)、300 g(黄芩180 g、栀子120 g)药材3批进行验证实验,结果见表8.

表8 黄芩、栀子组验证实验
表8结果显示,优选出的提取工艺条件重复性好,工艺稳定可行.
2.7黄芩、栀子精制工艺
2.7.1醇沉浓度考察.
取黄芩160 g、栀子240 g,加12倍量水,提取3次,每次0.5 h,合并提取液,滤过,减压浓缩至相对密度为1.10,冷却至室温,分成3份,加入95%乙醇,使含醇量分别达到65%、75%、85%,静置24 h,滤过,测定固含物含量.精密吸取提取液1 mL于100 mL的容量瓶中,测定黄芩苷、栀子苷含量,结果见表9.
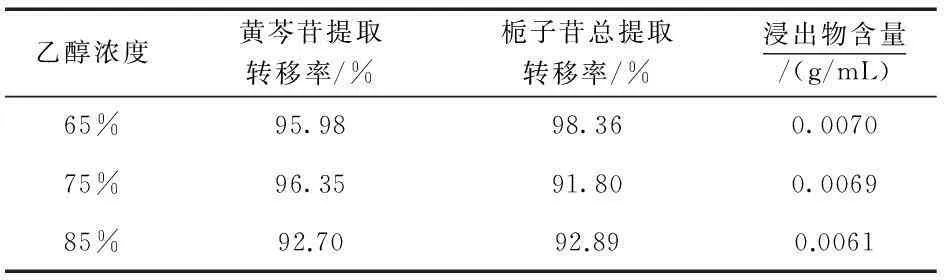
表9 黄芩、栀子精制工艺结果
表9结果显示,各浓度乙醇醇沉效果差别不大,从经济节约的角度考虑,故选择65%作为黄芩、栀子的醇沉浓度.
2.7.2验证实验.
按处方比例称取栀子药材150 g,黄芩药材100 g,加12倍量水,提取3次,每次0.5 h,合并提取液,滤过,减压浓缩至相对密度为1.10,冷却至室温,分成3份,加入95%乙醇,使其醇沉浓度均为65%,静置24 h,滤过,测定固含物含量.精密吸取提取液1 mL于100 mL的容量瓶中,测定黄芩苷、栀子苷含量,结果见表10.结果表明,优选出的精制工艺条件重复性好,工艺稳定可行.
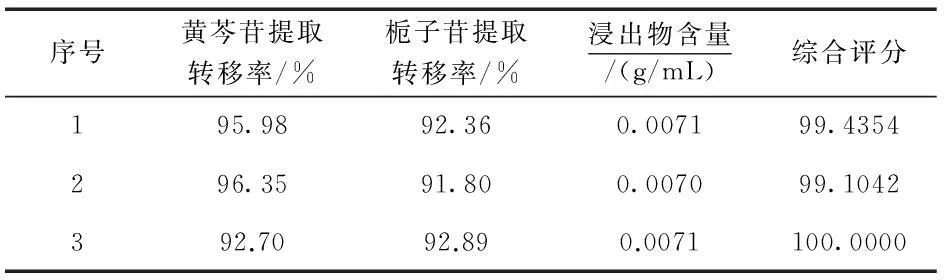
表10 黄芩、栀子组精制工艺验证
3讨论
黄连解毒汤传统的服用方法是煎煮成汤,而在煎煮加热过程中,黄连、黄柏中的小檗碱与黄芩中的黄芩苷发生沉淀反应,将这些沉淀物滤掉后再服用药液会严重影响黄连解毒汤的临床疗效.本实验采用分煎方法,将黄连、黄柏编为一组,黄芩、栀子编为另一组,让小檗碱和黄芩苷在煎煮过程中不再相遇发生反应,煎煮后再合并服用,从而最大限度地保留汤剂的有效成分,提高药物临床疗效.但两组药液在常温条件下是否还继续发生沉淀反应,还需进一步考察.
通常,中药汤剂中有效成分含量与加溶媒量、煎煮时间、煎煮方法及煎煮次数等密切相关.通过正交试验结果表明,黄连、黄柏组加6倍量70%乙醇,提取3次,提取1.5 h;黄芩、栀子组加12倍量水,提3次,提取0.5 h,65%醇沉进行除杂,该方法使汤剂的有效成分保留率较高,且工艺重现性较好,工艺稳定,具有很好的参考价值.
参考文献:
[1]徐静华,于庆海,渡边裕司.黄连解毒汤对脑缺血动物的促智作用及机制探讨[J].时珍国医国药,2002,13(12):705-707.
[2]陈光亮,张秀荣,王钦茂.黄连解毒汤药理研究进展[J].安徽中医学院学报,2001,20(5):67-69.
[3]蒋斌,张星海,唐糅,等.正交试验优选黄连解毒汤的机器煎煮工艺[J].中国实验方剂学杂志,2013,19(2316):32-35.
[4]吴洪元,姜晓群,陈贤琼.黄连解毒胶囊提取工艺研究[J].中成药,1998,20(11):1-3.
[5]黄山,高红宁,郭立玮.膜分离与树脂联用制备黄连解毒汤中药固体制剂的研究[J].南京中医药大学学报,2006,22(1):42-43.
[6]方素萍,邱金瑛.黄连解毒汤浸提工艺及剂型研究进展[J].中成药,2001,23(5):374-376.
Extraction Process of Coptidis Decoction for Detoxification
XUYuling,TANXiaojun,XUTengda,ZHOUChuanyong,LIUTao
(School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China)
Abstract:The paper is going to optimize the extraction process of the coptidis decoction for detoxification.The contents of berberine,baicalin,gardenia and solid content are used as index components.The extraction and purification process are studied by single factor test and orthogonal test.The results show that the best extraction technology for coptis chinensis and golde cypress invovles 6 times of 70% ethanol,extraction for 3 times with 1.5 h each time.The best extraction process for scutellaria baicalensis and cape jasmine involves 12 times of water,extraction for 3 times with 0.5 h each time.The purification process of scutellaria baicalensis and cape jasmine is to add 95% ethanol to obtain 65% alcohol concentration.The conclusion drawn is that the optimized extraction process is stable and feasible,and provides the experimental basis for the extraction of the coptidis decoction for detoxification.
Key words:coptidis decoction for detoxification;extraction process;orthogonal design;liquid chromatography
中图分类号:R284.2;R282.71
文献标志码:A
作者简介:徐玉玲(1975 — ), 女, 硕士, 高级工程师, 从事中成药新药开发与再评价工作.
收稿日期:2015-12-05.
文章编号:1004-5422(2016)01-0019-04
