鱼腥藻PCC7120染色体MazEF同源基因对asr0757/alr0758的初步研究
2016-04-22陈思礼吴汇兰
陈思礼 ,陈 洁 ,吴汇兰
( 中南民族大学 生命科学学院,430074,武汉 )
鱼腥藻PCC7120染色体MazEF同源基因对asr0757/alr0758的初步研究
陈思礼 ,陈洁 ,吴汇兰
( 中南民族大学 生命科学学院,430074,武汉 )
摘要鱼腥藻PCC7120染色体上的基因对asr0757/alr0758,经NCBI比对显示其与大肠杆菌中的毒素-抗毒素基因MazEF具有较高的同源性,且具有毒素-抗毒素系统基因的保守遗传结构,为研究其是否属于MazEF家族系统基因,构建同时含有asr0757和alr0758基因的双启动子选择性表达载体,先选择性诱导了该基因对的表达,再验证了其表达产物对细菌生长的影响. 结果显示:成功诱导表达出了目的蛋白asr0757(13.5KD)和alr0758(17.5KD),当单独诱导asr0757基因表达时,细菌生长状况不受影响,单独诱导alr0758表达时细菌生长明显受到抑制,同时诱导asr0757和alr0758基因时细菌生长恢复正常,说明asr0757/alr0758构成具有生物功能的MazEF家族系统基因对,具有毒性与抗毒性功能.
关键词鱼腥藻PCC7120; 毒素-抗毒素系统; MazEF; asr0757/alr0758
A Preliminary Research of MazEF Homologous Gene Pair asr0757/ alr0758 on the Chromosome of Anabaena sp.PCC7120
ChenSili,ChenJie,WuHuilan
(College of Life Science, South-Central University for Nationalities, Wuhan 430074, China)
AbstractAnabaenasp. PCC7120 chromosomal genesasr0757/alr0758 were predicted to have high homology with the toxin-antitoxin genesMazEFinE.coliby comparing them on NCBI, and they both had the same conservative structure. To study whether they belonged to the MazEF family, selective expression vectors were built with double promoters, which contained bothasr0757 andalr0758 genes. Then geneasr0757 andalr0758 were induced separately to verify the influence of the selective expression product on the growth of bacteria. The results showed that the target proteins asr0757(13.5KD) and alr0758(17.5KD) were successfully induced. The growth of bacteria was not affected whenasr0757 gene was induced, whereas the growth was significantly suppressed whenalr0758 gene was induced. The growth of bacteria reversed to normal, however, whileasr0757 andalr0758 genes were induced at the same time. This result showed thatasr0757 andalr0758 together constituted a gene pair of MazEF family which bequeathed the toxicity and anti-toxicity functions.
KeywordsAnabaenasp. PCC7120; toxin-antitoxin system; MazEF;asr0757/alr0758
蓝藻是一种光能自养型原核生物,兼具植物与细菌特征,其所属中的水华鱼腥藻PCC7120作为一种已于2001年由日本Kazusa研究所完成测序工作的模式生物[1],主要存在于淡水湖泊或海水中,大量繁殖时会形成水华,破坏水体生态平衡,导致鱼类死亡[2],并产生大量毒素,毒性物质通过食物链或者被污染的水源进入动物和人体体内会引起肝脏损伤[3],甚至透过血脑屏障在脑部积累破坏人的大脑神经[4],严重时引起多器官衰竭导致死亡[5,6].
水华鱼腥藻PCC7120体内存在着大量的毒素-抗毒素系统(TAS,toxin-antitoxin system),TAS由2个基因组成,这2个基因具有数个重叠基因且位于同一个操纵子下,一个编码稳定的抗毒素蛋白,另一个编码不稳定的毒素蛋白[7],根据编码产物序列的相似性将已验证过的TA系统分为包括MazE/F,RelB/E,CcdA/B等在内的8大家族,其中MazE/F是研究比较多的II型 TAS,正常情况下MazE和MazF形成异源六聚复合物,不危害菌体生存,但当遭遇外界胁迫时,MazF从复合物中游离出来,并作为一种核酸内切酶[8],特异性地切割mRNA 上的ACA序列,抑制翻译过程使细菌生长抑制或死亡[9],抗毒素MazE能从两个水平对TA 系统进行调控:①通过与毒素蛋白结合形成复合体来直接抑制毒素蛋白活性;②与mazEF基因启动子结合抑制TA 系统表达[10],MazEF系统还可在环境胁迫条件下(如氧化环境,氨基酸缺乏,抗生素压力等)介导细胞的程序性死亡[11].
自E.coil体内第一个毒素-抗毒素系统被鉴定以来,其他细菌体内的许多TAS系统基因也被相继鉴定,但就已知的TAS来看,不同种属的同源性和调控机制存在不同程度生物差异,鱼腥藻PCC7120染色体上的基因对asr0757/alr0758具有数个碱基的重叠区域且与MazEF具有较高的同源性,但该对基因只是TAS家族预测基因,无实验直接证明其确切属于MazE/F家族并具有毒性与抗毒性功能,故本实验通过构建同时含有asr0757和alr0758基因的双启动子选择性表达载体,通过对其进行诱导表达并研究表达产物对细菌的生长的影响,证明了鱼腥藻PCC7120染色体上的基因对asr0757/alr0758具有毒性抗毒性功能,构成MazE/F家族的一个毒素-抗毒系统.
1材料与方法
1.1材料与试剂
Anabaenasp. PCC7120购自中国科学院水生物研究所,E.coilDH5α 以及E.coilBL21(DE3)为本室保存菌种,限制性内切酶、T4 DNA 连接酶、克隆载体pMD18-T(Takara 公司),表达载体pET30a(+),pBAD/HisA 为本室保存,琼脂糖凝胶 DNA 回收试剂盒和质粒 DNA 提取试剂盒(Axygene 公司),PCR引物合成和克隆载体与表达载体测序(南京金斯瑞生物科技有限公司).
1.2实验方法
1.2.1鱼腥藻PCC7120全基因组 DNA 提取
鱼腥藻PCC7120全基因组的提取方法参照文献[12].
1.2.2重组克隆载体pMD-8T-PBAD,pMD-18T-asr0757 和 pMD-18T-alr0758的构建
基因的克隆严格参照分子生物学操作标准方法[13],引物设计按照表1进行. 依次添加酶切位点,配成20 μM/L 的溶液,分装于-20℃保存.以鱼腥藻PCC7120全基因组DNA为模板,运用Touch-Down PCR扩增目的基因对asr0757与alr0758,反应程序为:94 ℃变性4 min; 94 ℃ 1 min, 60 ℃ (0.5 ℃↓) 40 s, 72 ℃ 40 s,15个循环; 94℃ 1min, 55 ℃ 40 s, 72 ℃ 40 s, 20个循环; 72 ℃ 7 min. 基因araC和PBAD的扩增以质粒 PBAD/HisA 为模板,PCR扩增程序为:94 ℃变性4 min; 94 ℃ 1 min, 56 ℃ (0.5 ℃↓)30 s, 72 ℃ 90 s, 15个循环; 94 ℃ 1 min, 50 ℃ 30 s, 72 ℃ 90 s, 20个循环; 72 ℃ 7 min.PCR产物经琼脂糖凝胶电泳检测后纯化后直接与克隆载体pMD18-T连接16 ℃过夜,转入活化的E.coilDH5α中,经蓝白斑筛选挑取阳性克隆,经菌落PCR检测与质粒双酶切检测后的阳性菌送往测序[14]. 测序正确的克隆制作成甘油菌保存,命名为pMD-18T-PBAD,pMD-18T-asr0757 和 pMD-18T-alr0758,并提取质粒同时保存于-20℃.
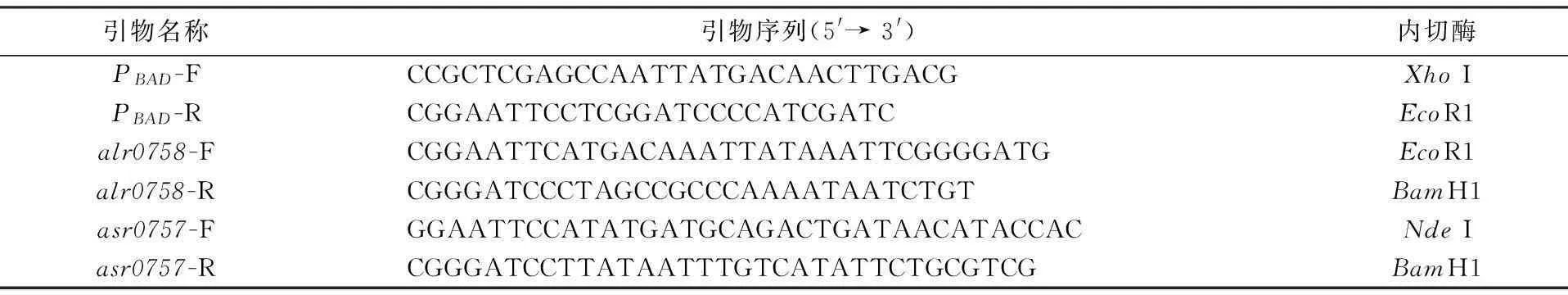
表1 PCR 引物的序列
1.2.3重组选择性表达载体的构建
将测序正确的克隆菌质粒按照表2中的酶进行双酶切,回收酶切的目的片段保存于-20℃,表达载体的构建方法与命名按图1进行,重组表达载体pMJ0700含有araC+PBAD片段,重组表达载体pMJ0757含有抗毒素基因asr0757,重组表达载体pMJ0758载体同时含有抗毒素基因asr0757,毒素基因alr0758.构建完的表达载体菌经过双酶切检测,菌落PCR检测送往测序,测序正确的菌制作成甘油菌保存于-20℃备用.

表2 阳性克隆质粒双酶切

图1 双启动子表达载体构建流程图Fig.1 Flowchart of the construction of the expressionvector with double promoters
1.2.4目的基因asr0757和alr0758的诱导表达
重组选择性表达菌质粒中:抗毒素基因asr0757位于PT7控制下,由 IPTG 诱导表达 ,毒素基因alr0758位于PBAD控制之下,受 L-(+)-阿拉伯糖诱导表达.将重组表达菌pMJ0758-0757-BL21接种于含有Kana抗性的LB液体培养基中,在37℃,220 r/min摇床过夜[15],转入新的LB液体培养基(含有Kana,0.2%葡萄糖抑制本底表达)活化3 h,使OD600=0.4~0.6 后:①加入0.8 mmol/L 的 IPTG诱导PT7启动,抗毒素基因asr0757表达;②加入0.2 % L型阿拉伯糖诱导PBAD启动,毒素基因alr0758表达,诱导10 h收集菌体SDS- PAGE 电泳检测重组蛋白的表达,同时设置对照组即含PET-30a空载的BL21诱导,pMJ0758-0757-BL21不诱导.
1.2.5毒素基因alr0758对菌体细胞的毒性作用和抗毒性基因asr0757对毒素基因毒性的抑制作用
将重组菌pMJ0700,pMJ0758,pMJ0758-0757每种菌分别接种于3种含不同诱导物的M9基本培养基上划线培养,3种含不同添加物的培养基为: ① M9基本培养基+卡那霉素,② M9基本培养基+卡那霉素+0.2%L-阿拉伯糖,③ M9基本培养基+卡那霉素+0.2%L-阿拉伯糖+0.1mM/L IPTG,于37℃培养18 h后观察结果.
2结果与分析
2.1目的基因PCR扩增
运用Touch-down PCR扩增的目基因片段:asr0757,alr0758,araC+PBAD,PCR产物经0.1%的琼脂糖凝胶电泳检测显示出现的条带大小与预测大小一致(见图2),asr0757大小为210 bp(泳道3),alr0758为342 bp(泳道2),araC+PBAD为1300 bp(泳道1).

M) DL2000 标准 Marker; 1) araC+PBAD PCR 产物; 2) alr0758 PCR 产物; 3) asr0757 PCR 产物图2 PCR产物电泳检测Fig.2 Examination of PCR products by agarose electrophoresis
2.2重组克隆载体 pMD-18T-PBAD,pMD-18T-asr0757 和 pMD-18T-alr0758的构建
各克隆载体经过双酶切检测(见图3)和菌落PCR检测(见图4),均在预测大小处出现了目的条带,菌落PCR电泳检测时在100 bp处出现的条带为引物二聚体.双酶切检测电泳图显示每个泳道均出现了2个条带,小的条带为酶切下来的目的条带,大的条带为切下来的空载PMD-18T空载(大小约2700 bp),菌落PCR检测均在预测位置出现了目的条带,送往测序,测序结果经NCBI的Blast比对显示碱基完全匹配,克隆载体构建成功.
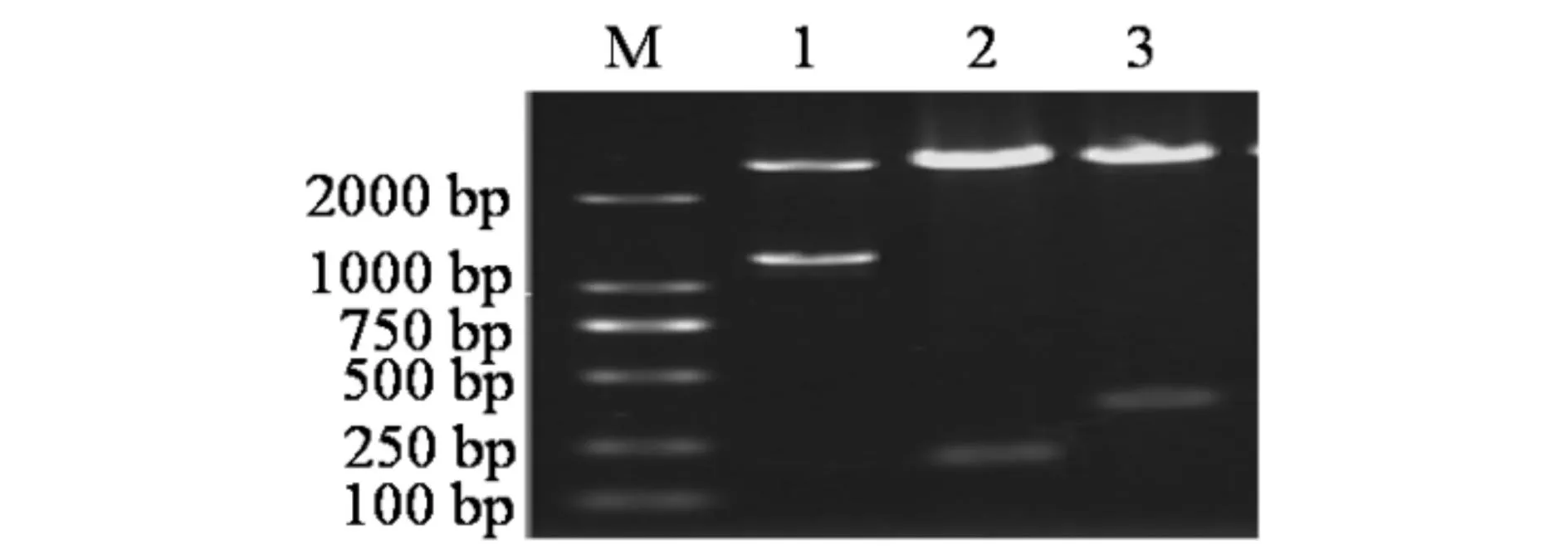
M) DL2000 标准 Marker; 1) pMD-18T-PBAD双酶切产物; 2) pMD-18T-asr0757双酶切产物; 3) pMD-18T-alr0758双酶切产物图3 重组克隆载体pMD-18T-PBAD,pMD-18T-asr0757 和 pMD-18T-alr0758双酶切检测 Fig.3 Examination of cloning vectors pMD18-T-asr0757andpMD18-T-alr0758 with the double enzyme digestion

M) DL2000 标准 Marker; 1) 重组克隆菌pMD-18T-alr0758菌落PCR产物; 2) 重组克隆菌pMD-18T-asr0757菌落PCR产物;3) 重组克隆菌pMD-18T-PBAD菌落PCR产物图4 重组克隆菌pMD-18T-PBAD,pMD-18T-asr0757 和 pMD-18T-alr0758 菌落PCR检测Fig.4 Colony PCR detection of the recombinant bacteria pET-30a-asr0757 and pET-30a-alr0758
2.3重组选择性表达载体的构建
将测序正确的克隆载按照表2所列的酶双酶切,纯化回收酶切的目的片段,按照图1所示的方法构建选择性表达载体pMJ0700, pMJ0758, pMJ0758-0757后对重组选择性表达菌进行双酶切检测(见图5),pMJ0700含有araC+PBAD片段,用XhoI/EcoR1双酶切检测,泳道3为其双酶切后的产物电泳结果,在1300 bp处出现与目标片段大小相符的条带;泳道2为pMJ0758双酶切产物,pMJ0758含有araC+PBAD和asr0758片段,用EcoR1/BamH1双酶切检测,在342 bp处出现与alr0758片段大小相符的目标条带;泳道1为pMJ0758-0757双酶切产物,含有araC+PBAD,asr0757,alr0758片段,用NdeI/BamH1双酶切检测,在210 bp处出现目标条带,选择性表达载体pMJ0758-0757分别用3组引物进行菌落PCR检测,结果显示均在目标处出现条带(未附图),经测序后结果显示3段目标片段均完整地整合入质粒中,选择性表达载体构建成功.
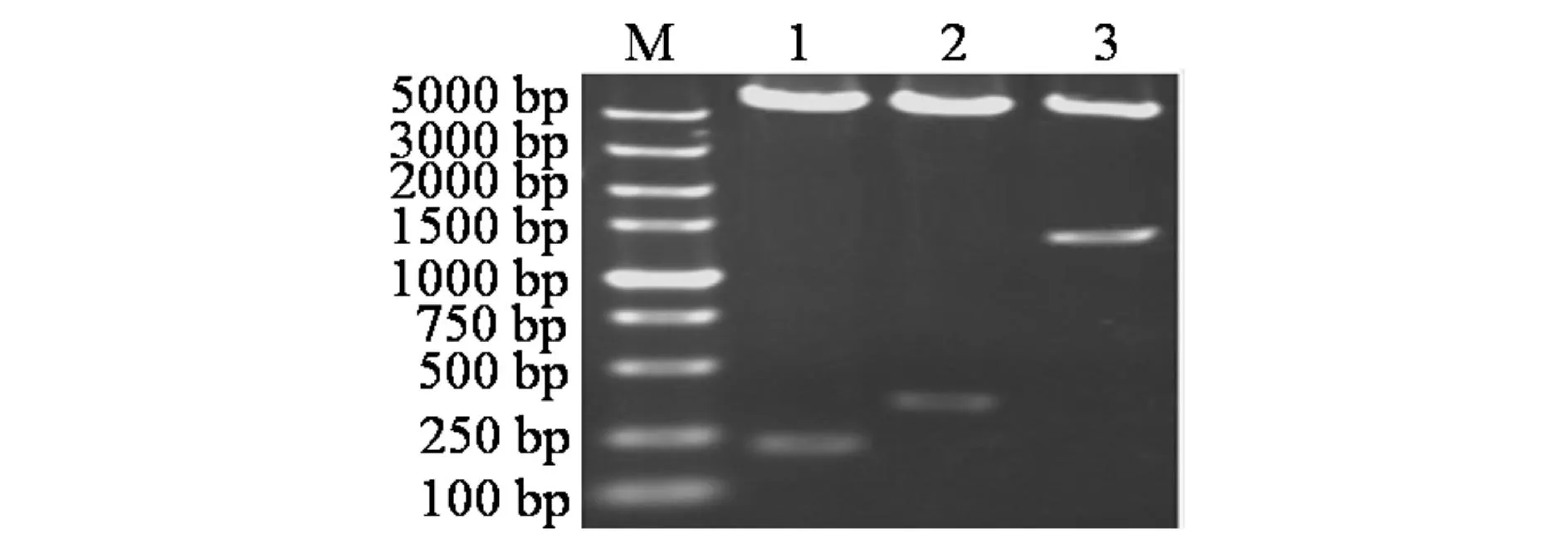
M) DL5000 标准 Marker; 1) 选择性表达载体pMJ0758-0757用Nde I /BamH1双酶切产物; 2) 选择性表达载体pMJ0758用EcoR1/BamH1双酶切产物; 3) 择性表达载体pMJ0700用Xho I/EcoR1双酶切产物图5 重组选择性表达质粒进行双酶切电泳检测Fig.5 Electrophoresis detection of selective expression vectorswith double enzyme digestion
2.4目的基因asr0757和alr0758的诱导表达
选择性表达菌pMJ0758-0757-BL21按照1.2.4中的①②两种诱导方式诱导目的基因表达后,SDS-PAGE电泳检测结果如图6所示,泳道1与4为实验诱导组,分别诱导目的基因alr0758和asr0757的表达,图中椭圆标注的地方即为目的基因诱导产物,大小与基因表达产物预测大小一致,蛋白asr0757为13.5 KD,alr0758为17.5 KD,泳道2与3为实验对照组,在目的基因大小处未出现条带,泳道1中诱导产物是毒素蛋白,由于其本身对菌体有毒害作用,故表达量较低,泳道4中的抗毒素蛋白的诱导表达量较高,蛋白诱导表达成功.
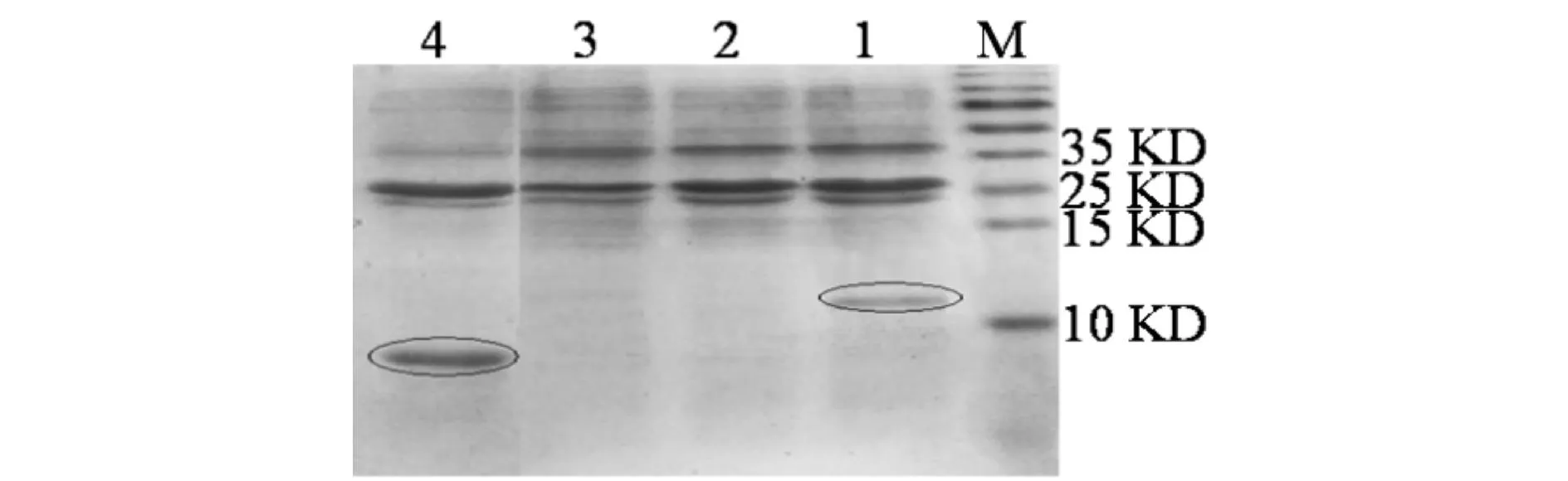
M) 蛋白预染Marker ;1)选择性表达菌pMJ0758-0757-BL21目的基因alr0758的诱导表达;2)选择性表达菌pMJ0758-0757-BL21菌未诱导;3)含PET-30a空载-BL21菌诱导;4)选择性表达菌pMJ0758-0757-BL21目的基因asr0757的诱导表达图6 目的基因asr0757和alr0758的诱导表达SDS-PAGE检测Fig.6 Examination of expression products induced from genes asr0757/alr0758 by SDS- PAGE
2.5毒素基因alr0758对菌体细胞的毒性作用和抗毒性基因asr0757对毒素基因毒性的抑制作用
选择性表达载体诱导毒素基因表达对细胞的毒性作用和抗毒素表达时对毒性的抑制实验结果如图7所示,当M9培养基只作抗性筛选加入Kana并用H2O替代诱导剂时,3种含有重组质粒大的大肠杆菌均能正常生长;当向M9培养基中加入0.2%L-阿拉伯糖作为诱导剂时,PBAD启动子启动,位于阿拉伯糖启动子PBAD调控下的基因alr0758表达,含重组质粒pMJ0700的大肠杆菌细胞能够正常生长,含有重组质粒pMJ0758和pMJ0758-0757的大肠杆菌细胞生长明显受到抑制,说明诱导基因alr0758表达后,其产物具有细胞毒性,对E.coli细胞的生长有明显的抑制作用;当向M9培养基中同时添加0.2%L-阿拉伯糖和0.1mM IPTG 诱导剂时,PBAD启动子和T7启动子启动,基因asr0757,alr0758均可表达,含有重组质粒pMJ0758的大肠杆菌细胞生长明显受到抑制,而含重组质粒pMJ0700和pMJ0758-0757大肠杆菌细胞能够正常生长,说明基因alr0758表达产物对细胞具有毒性作用,而基因asr0757表达产物能抑制这种毒性作用,上述实验结果表明:基因alr0758是毒性基因,基因asr0757是抗毒性基因,两者共同构成鱼腥藻PCC7120染色体上的一个毒素-抗毒素系统.
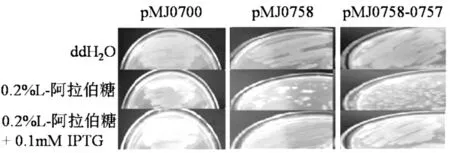
图7 基因asr0757/alr0758在不同诱导物诱导下诱导产物对大肠杆菌细胞生长影响Fig.7 Effects of the products induced under different inducers of genes asr0757/alr0758 on the growth of E.coli cells
3讨论
蓝藻是存在于多种环境中的原核生物,能适应多变的环境,鱼腥藻是其所属的引起水华的最主要的藻种之一,作为一种水华优势种,其抗对环境压迫的能力与其体内染色体和质粒上存在的大量的毒素-抗毒素系统密切相关,而鱼腥藻PCC7120的染色体上的TA系统大多数是基于同源序列比对预测的无直接的实验依据. 因此,通过对Anabaenasp.PCC7120染色体上的毒素-抗毒素系统基因的研究,了解其调控机制,通过人工干涉,有利于减少水华鱼腥藻的危害.
随着TAS研究的日益增多,许多不同种属细菌中的TAS基因也被相继鉴定,但尚缺乏TAS在各种属细胞中作用机制及其生理功能等的深入研究. 本文运用分子生物学手段对蓝藻Anabaenasp. PCC7120染色体上的预测的II型MazEF同源基因对asr0757/alr0758进行了初步研究,构建双启动子表达载体:即含T7和PBAD,基因asr0757位于T7启动子下,alr0758位于PBAD的启动子下,两基因分别诱导和同时诱导,观察不同诱导条件下表达产物对E.coilBL21的影响.本研究首次针对鱼腥藻PCC7120染色
体上asr0757/alr0758,通过构建选择性表达载体,在大肠杆菌中鉴定了这两对基因的毒性和抗毒性功能,在毒素基因诱导表达时宿主菌的生长明显较对照组慢,且基因alr0758诱导表达量较少,在一定程度上说明了基因alr0758表达产物的毒性作用,对鱼腥藻PCC7120 染色体上TAS基因的研究鉴定是对TAS的补充,同时有利于其分子机制的研究.
尽管基因alr0758的诱导产物对E.coliBL21具细胞毒性,能显著抑制细胞生长,但alr0758未导入其来源菌株鱼腥藻PCC7120中,故其在鱼腥藻中的作用机制和生理功能均未知,尚需要更深入的研究. 本研究结果补充了TAS中MazEF大家族,为进一步了解II型毒素-抗毒素应答各种环境胁迫并调节鱼腥藻PCC7120的生长奠定了基础,使进一步阐明蓝藻应对环境胁迫成为可能.
参考文献
[1]Kaneko T, Nakamura Y, Wolk C P, et al. Complete genomic sequence of the filamentous nitrogen-fixing cyanobacteriumAnabaenasp. strain PCC 7120[J]. DNA Res, 2001, 8(5): 205-213.
[2]张爱芹, 王彩霞, 马瑞霞. 21 世纪高等教育规划教材:植物学[M].成都:西南交通大学出版社, 2006.
[3]Cazenave J,Wunderlin D A,Bistoni M A,et al.Uptake,tissue distribution and accumulation of microcystin-RR inCorydoraspaleatus,JenynsiamultidentataandOdontesthesbonariensis: A field and laboratory study [J]. Aquat Toxicol, 2005, 75(2): 178-190.
[4]居静娟, 浦跃朴, 尹立红, 等. 微囊藻毒素神经毒理学研究进展[J]. 生态毒理学报, 2011, 6(1): 18-22.
[5]Carmichael W W, Azevedo S M, An J S, et al . Human fatalities from cyano-bacteria: chemical and biological evidence for cyano-toxins [J]. Environ Health Perspect, 2001, 109(7): 663-668.
[6]Fischer W J, Altheimer S, Cattori V, et al. Organic anion transporting polypeptides expressed in liver and brain mediate uptake of microcystin [J] . Toxicol Appl Pharm, 2005, 203(3) :257-263.
[7]Gerdes K,Christensen S K,Løbner-Olesen A .Prokaryotic toxin-antitoxin stress response loci. [J]. Nat Rev Microbiol, 2005,3(5): 371-382.
[8]Zhang Y, Zhang J, Hoeflich K P, et al. MazF cleaves cellular mRNA specifically At ACA to block protein synthesis inEscherichiacoli[J]. Mol Cell, 2003, 12(4): 913-923.
[9]Yamaguchi Y, Park J H, Inouye M. Toxin-antitoxin systems in bacteria and archaea [J]. Annu Rev Genet, 2011, 45:61-79.
[10]Makarova K S, Wolf Y I, Koonin E V. Comprehensive comparative-genomic analysis of Type 2 toxin-antitoxin systems and related mobile stress response systems in prokaryotes[J]. Biology Direct, 2009, 4: 19
[11]Engelberg-Kulka H, Amitai S, Kolodkin-Gal I, et al. Bacterial programmed cell death and multicellular behavior in bacteria[J]. PLoS Genet, 2006,2 (10): e135.
[12]徐旭东, 王业勤. 鱼腥藻──大肠杆菌 CAT 启动子探测质粒的构建[J].中国科学院研究生院学报, 1993(2):203- 209.
[13]萨姆布鲁克J, 拉塞尔D W.分子克隆实验指南精编版[M]. 3版. 黄培堂, 王恒樑, 周晓巍, 等译. 北京:科学出版社, 2005.
[14]谭艳平, 杨玖英, 朱英国, 等. 琼脂糖电泳凝胶中回收微量DNA片段的新方法[J]. 中南民族大学学报(自然科学版), 2004, 23(1):10- 12.
[15]何冬兰, 牧野圭. 亮氨酸结构蛋白在大肠杆菌重组子中的表达[J]. 中南民族大学学报(自然科学版), 2002, 21(3):4- 7.
中图分类号Q78
文献标识码A
文章编号1672-4321(2016)01-0029-05
基金项目国家自然科学基金资助项目(31001099/C190101); 中央高校自然科学基金资助项目(CJSl3003, CJS13004); 中南民族大学微生物与生物转化重点实验室资助项目(XJS09002)
作者简介陈思礼( 1955-) , 男, 教授, 博士, 研究方向: 分子病原生物学, E-mail: sili.chen@163.com
收稿日期2015-09-03
