α-Bi2O3/TiO2纳米粒子的制备及其光催化性能的研究
2016-04-22黄正喜刘献平吴腊梅袁誉洪
黄正喜,刘献平,吴腊梅,袁誉洪
(中南民族大学 化学与材料科学学院, 武汉 430074)
α-Bi2O3/TiO2纳米粒子的制备及其光催化性能的研究
黄正喜,刘献平,吴腊梅,袁誉洪
(中南民族大学 化学与材料科学学院, 武汉 430074)
摘要采用两步水热法合成了α-Bi2O3/TiO2纳米粒子,利用透射电子显微镜(TEM)、X-射线光电子能谱仪(XPS)、X射线衍射仪(XRD)和紫外-可见固体漫反射光谱(DRS)对其进行了表征,以罗丹明B(RhB)为模型污染物评价了其光催化活性,结果表明:在模拟可见光源的照射下,α-Bi2O3/TiO2比α-Bi2O3、TiO2单体具有更好地光催化活性,当α-Bi2O3与TiO2的摩尔比为1︰5时复合纳米粒子的光催化活性最佳,光照150 min降解率为98.5%.经过3次循环利用,α-Bi2O3/ TiO2纳米粒子具有较好的稳定性.
关键词α-Bi2O3/ TiO2纳米粒子;罗丹明B;光催化降解
Preparation and Photocatalytic Properties ofα-Bi2O3/TiO2Nanoparticles
HuangZhengxi,LiuXianping,WuLamei,YuanYuhong
(College of Chemistry and Materials Science, South-Central University for Nationalities, Wuhan 430074, China)
Abstractα-Bi2O3/TiO2composite nanoparticles were synthesized through a two-step hydrothermal method. Transmission electron microscopy (TEM), X-ray photoelectron spectroscopy (XPS), X-ray diffraction (XRD) and UV-vis diffuse reflection spectroscopy (DRS) were employed to clarify the structure and morphology of the nanoparticles. The photocatalytic activity of the composite was evaluated by using Rhodamine B (RhB) as model contaminant. Compared with the single phaseα-Bi2O3or TiO2, theα-Bi2O3/TiO2exhibited higher photocatalytic activity. The catalyst with 1︰5 molar ratio ofα-Bi2O3and TiO2showed the best photocatalytic activity: 98.5% RhB was degraded within 150 min under visible light irradiation. After three cycles, the catalyst still exhibited good photocatalytic activity.
Keywordsα-Bi2O3/TiO2; Rhodamine B ; photocatalysis
近年发现金属氧化物半导体在光照下能将有害的有机物降解为危害较小的分子[1], 由于TiO2具有极强的稳定性和良好的光催化活性,且成本低、无毒,成为研究最广泛的光催化剂材料之一[2-4].TiO2有金红石、板钛矿、锐钛矿3种晶型,其中锐钛矿和金红石型TiO2常被用作光催化剂[5].但TiO2的禁带较宽[6](约为3.2 eV),作为光催化剂时只能吸收紫外光,限制了其在可见光范围内的应用.研究者通过与其他半导体复合CdS/TiO2[7]、ZnO/TiO2[8],贵金属沉积Au-Ag/TiO2[9]、Pt-TiO2[10]、非金属元素掺杂C-TiO2[11]、离子掺杂Mn2+-TiO2[12]等方法对TiO2进行修饰改性,扩展了其光响应范围,光催化活性获得明显提高.
Bi2O3是一种常见的p型间接带隙半导体,不同晶型的Bi2O3其禁带宽度不同(2.3~2.8 eV[13]),当其受到能量高于其带隙能的光照射时,产生电子和空穴,氧化水产生·O2-和·OH等高活性的氧化物种.Wang等[14]合成了S掺杂的Bi2WO6/Bi2O3复合材料,在Xe灯照射下对RhB的降解率可达95%.但Bi2O3单独作为催化剂时,其产生的电子和空穴易发生复合,光催化效率较低.本文将α-Bi2O3与TiO2纳米复合粒子复合,通过研究其对RhB的降解情况,发现复合的α-Bi2O3/TiO2纳米粒子较α-Bi2O3、TiO2单体具有更好的光催化活性.
1实验部分
1.1试剂和仪器
五水合硝酸铋Bi(NO3)2·5H2O (AR 国药),钛酸四丁酯 (TBOT) C16H36O4Ti (CP沪试),硫酸钡BaSO4(AR 国药),氢氧化钠NaOH (AR天津市凯通化学试剂有限公司),罗丹明B(AR阿拉丁).实验用水为二次蒸馏水,实验所用试剂盐酸、异丙醇、乙醇、乙二醇、对苯醌、三乙醇胺和硝酸均为分析纯.
X-射线衍射仪(D8 ADVANCE型, 德国 Bruker, Cu靶Kɑ射线,扫描速度1.2°/min, 扫描范围10°~80°) ,X-射线光电子能谱仪(VG Multilab 2000型, 美国 Thermal Electron, 激发源为Al靶KɑX-射线),透射电子显微镜(Tecnai G 20型, 荷兰 FEI),双光束紫外-可见分光光度计(Lambda Bio35型,美国 PE, 200~800 nm).
1.2纳米粒子的制备
TiO2纳米粒子的制备:5 mL TBOT分散于70 mL 10 mol/L 的NaOH溶液中,超声30 min后转移至反应釜中,于160℃恒温反应24 h,反应结束后自然冷却到室温,收集沉淀并用稀HCl溶液、蒸馏水和无水乙醇洗涤,80℃干燥10 h得TiO2前驱体,于500℃马弗炉中煅烧2 h得TiO2纳米粒子.
α-Bi2O3/ TiO2的制备:0.485 g Bi(NO3)2·5H2O溶于10 mL 1 mol/L的硝酸溶液中,搅拌2 h得澄清透明溶液,将上述溶液滴加至60 mL五水乙醇中,加入一定量的TiO2粉末,搅拌30 min,于160℃的烘箱中反应12 h,冷却至室温并用蒸馏水和无水乙醇洗涤沉淀,80℃干燥12 h,得到的前驱体于450℃,升温速率为10℃/min的马弗炉中煅烧3 h.α-Bi2O3的制备方法相同.
1.3光催化降解RhB
向光催化反应容器中加入80 mL 10 mg/L的RhB溶液和0.05gα-Bi2O3/ TiO2纳米粒子,暗搅拌30 min,以达到催化剂与RhB溶液之间的吸附脱附平衡,用70 W的金卤灯作为模拟可见光源进行光降解实验,每隔30 min吸取4 mL上层清液,用UV-vis分光光度计于554 nm处测其吸光度.RhB的降解率计算公式如下:
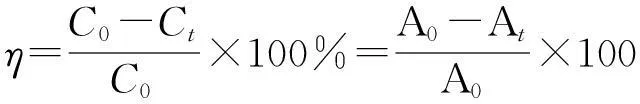
(1)
式(1)中,C0、Ct分别为初始溶液的浓度和t时刻的浓度(mg/L);A0、At分别为染料初始溶液的吸光度和t时刻的吸光度(%).
2结果与讨论
2.1α-Bi2O3/TiO2纳米粒子的表征
图1为合成的Bi2O3及Bi2O3/TiO2样品的XRD谱图,合成的TiO2与锐钛矿型的TiO2[15](JCPDS No. 21-1272)一致,在2θ值为25.3°, 37.8°, 47.9°, 53.7°, 55.0°, 62.6°, 74.9°处分别对应TiO2的(101), (004), (200), (105), (211), (204)和(215)晶面.合成的Bi2O3与单斜结构的α-Bi2O3晶相[16](JCPDS No. 41-1449)一致.当α-Bi2O3与TiO2的摩尔比为1︰5时,在2θ值为29.7°处出现较强的衍射峰,是由于α-Bi2O3的衍射峰在此处叠加所致.
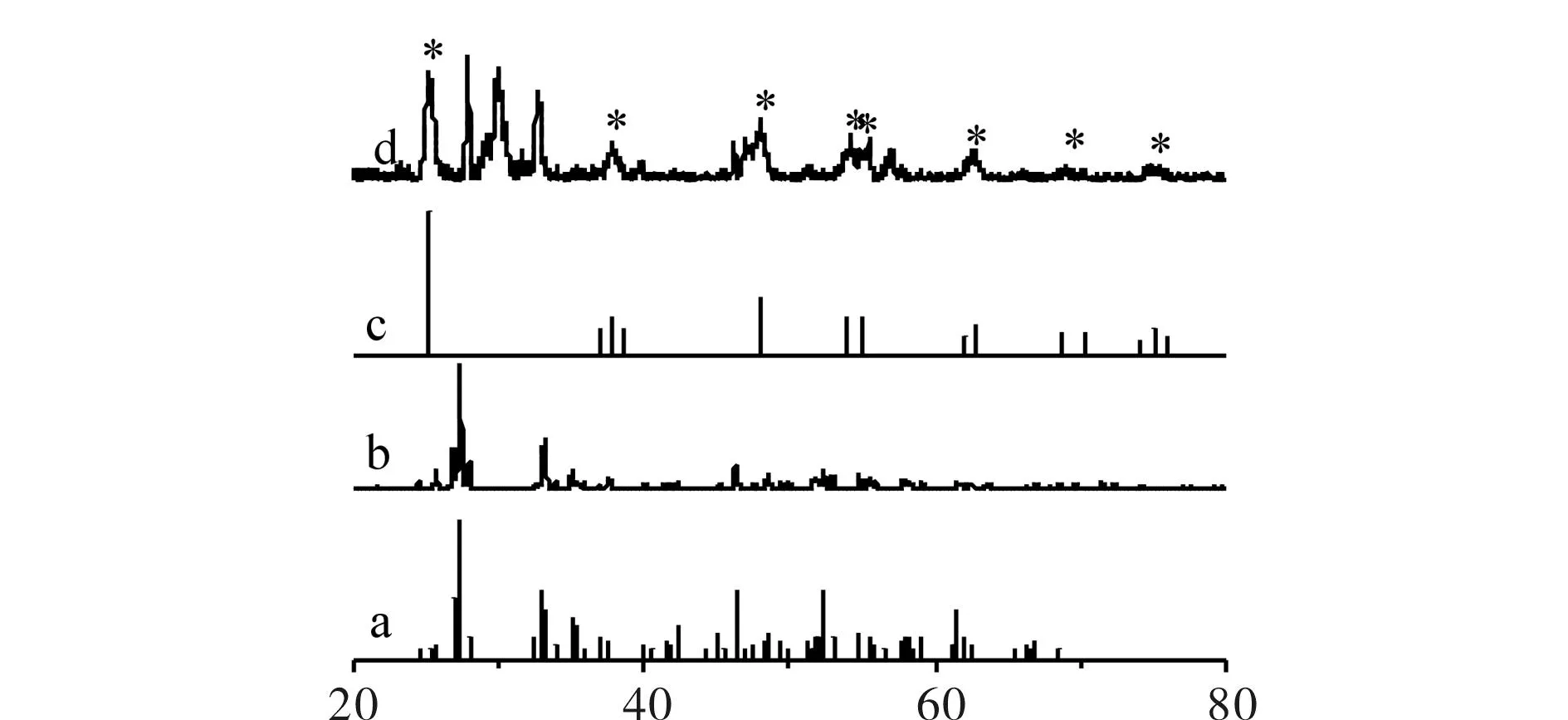
2θ/(°)* TiO2 ; a) PDF NO.41-1449; b) Bi2O3; c) PDF NO.21-1272; d)r(Bi2O3︰TiO2) = 1︰5图1 样品的XRD谱图Fig.1 XRD patterns of as-prepared samples
为了研究纳米粒子形貌特征,我们对合成的TiO2及α-Bi2O3/TiO2纳米粒子进行了TEM表征(见图2),由图2(a)可知合成的TiO2为棒状结构,如图2(b)可见α-Bi2O3均匀负载在TiO2的表面.

a) TiO2; b) α-Bi2O3/TiO2; 图2 样品α-Bi2O3/TiO的TEM电镜图Fig.2 TEM images of as-prepared α-Bi2O3/TiO2
图3为所制样品的DRS光谱及禁带宽度图,实验中用BaSO4作为参比物.图3(a)中各谱线的切线与Y=0的交线得到TiO2对光的吸收边带约为380 nm,α-Bi2O3在400~430 nm有较弱的吸收,α-Bi2O3/TiO2对光的吸收发生红移,吸收边带约为390 nm,此外α-Bi2O3/TiO2在440~530 nm可见光下有明显的吸收峰,α-Bi2O3的负载拓宽了光吸收范围,能更好地利用可见光.
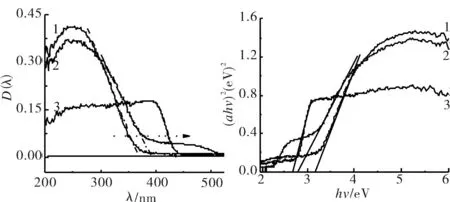
1) TiO2; 2) α-Bi2O3/TiO2; 3) Bi2O3图3 样品的DRS光谱图(a)和禁带宽度(b)Fig.3 UV-Vis diffuses reflectance spectra (a)and bang gap energies(b) of the as-prepared samples
半导体的禁带宽度遵循公式(2)[17]:
αhv=A(hv-Eg)n/2.
(2)
式(2)中α,h,v,A和Eg分别为吸收系数,普朗克常量,光的频率,常系数和禁带宽度.n为整数,由半导体的吸光跃迁类型决定,TiO2为间接跃迁其n= 4,以hv为X轴,(αhv)2为Y轴作图得到图3b,做各曲线的切线与X轴的交点得到样品的禁带宽度大致为α-Bi2O3为2.7 eV,TiO2为3.19 eV,α-Bi2O3/TiO2为2.8 eV.复合催化剂的禁带宽度减小,能有效地利用太阳光.
为研究α-Bi2O3/TiO2表面所含元素的化学状态,对其进行了XPS表征,结果见图4.

a) 全谱; b) O 1s; c) Ti 2p ; d) Bi 4f图4 α-Bi2O3/TiO2纳米粒子的XPS 谱图Fig.4 XPS spectrum of the α-Bi2O3/TiO2 nanoparticles
图4a为样品的全谱图,其中Bi、O、Ti存在于样品中,结合能为284.6 eV处的峰为C1s的特征峰.图4b中530.2 eV处的O1s峰对应于TiO2中Ti-O-Ti键[18],530.9 eV处的峰对应于α-Bi2O3中的Bi-O键[19].图4c中在结合能为459.0 eV和464.7 eV两处较强的特征峰分别对应于Ti 2p3/2和Ti 2p1/2[20],说明制备的催化剂中Ti为Ti4+.图4d中Bi 4f5/2和Bi 4f7/2的电子结合能分别为164.8 eV、159.3 eV与文献[21]中Bi2O3的结合能值一致,Bi为Bi3+.
2.2光催化降解RhB
2.2.1不同催化剂对降解RhB的影响
图5为不同催化剂对RhB的降解情况及动力学曲线,图5a表明,在只有光照无催化剂条件下RhB浓度基本保持不变,加入0.05 gα-Bi2O3/TiO2催化剂暗搅拌150 min,RhB浓度变化较小,而光照150 min后,RhB基本被完全降解.分别加入0.05 g TiO2、α-Bi2O3光照150 min,RhB的降解率分别为34%和75%,复合催化剂的光催化效果明显提高.由图5b可见,催化剂对RhB的降解符合一级反应动力学,复合催化剂的反应速率常数为0.02411min-1,分别为TiO2和α-Bi2O3的9.8倍和3.02倍.
2.2.2不同摩尔比的α-Bi2O3/TiO2对降解RhB的影响

1) 空白反应; 2) 暗反应; 3) TiO2; 4) α-Bi2O3; 5) α-Bi2O3/TiO2图5 不同实验条件对降解RhB的影响(a)及动力学曲线(b)Fig.5 Effects of different conditions on the degradation of RhB(a) and degradation kinetics(b)
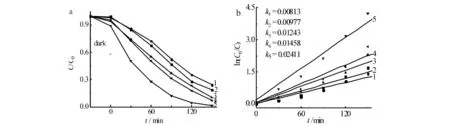
1~5)r(α-Bi2O3︰TiO2)分别为1︰1, 1︰2, 1︰3, 1︰7, 1︰5图6 不同摩尔比的α-Bi2O3/TiO2对降解RhB的影响(a)和动力学曲线(b)Fig.6 Effects of different molar ratio of α-Bi2O3/TiO2 on degradation of RhB(a) and degradation kinetics(b)
图6为不同摩尔比的α-Bi2O3/TiO2对降解RhB的影响及反应动力学曲线,当α-Bi2O3与TiO2的摩尔比分别为1︰1, 1︰2, 1︰3, 1︰5, 1︰7时,0.05 g催化剂光照150 min对RhB的降解率分别为76%, 81%, 90%, 98%, 92%.r(α-Bi2O3︰TiO2)=1︰5时催化剂的活性最高.当二者摩尔比低于1︰5时,随着α-Bi2O3含量增加,光催化活性逐渐升高,继续增加α-Bi2O3含量其活性反而下降.图7为r(α-Bi2O3︰TiO2) =1︰5的α-Bi2O3/TiO2在不同时间降解RhB的吸收光谱图,图7中随着光照时间的增加,RhB吸收峰强度逐渐减小,最大吸收波长发生蓝移,说明在光催化反应过程中RhB分子上的N,N-二乙基基团脱落,RhB逐渐被降解.
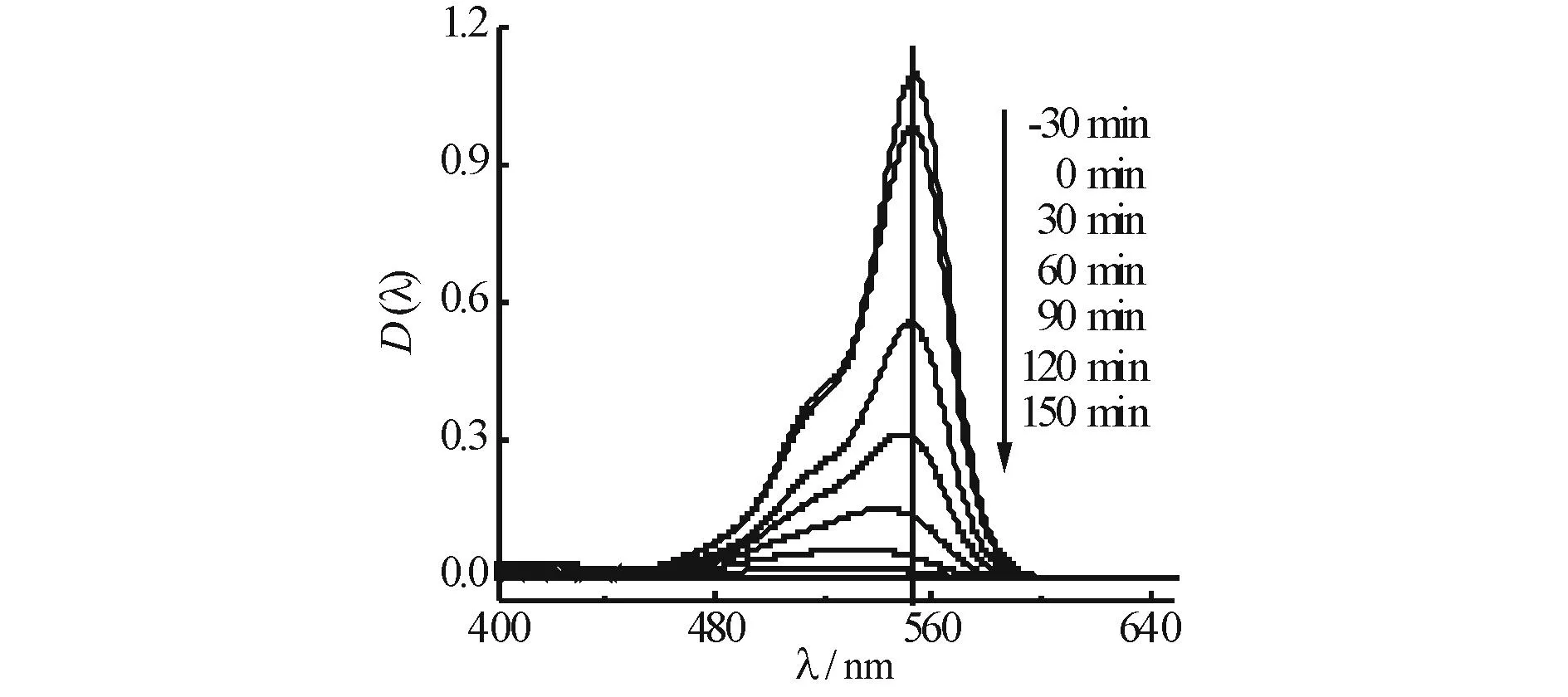
图7 α-Bi2O3/TiO2在不同时间降解RhB的吸收光谱图 Fig.7 UV-Vis absorption spectra during the photodegradation of RhB by α-Bi2O3/TiO2
2.2.3催化剂用量对降解RhB的影响
相同浓度的RhB溶液80 mL中,加入不同量的r(α-Bi2O3︰TiO2) = 1︰5的α-Bi2O3/TiO2催化剂对RhB的降解情况如图8所示,当催化剂的用量低于0.05 g时,光催化活性随着催化剂用量的增加而增强,继续增加催化剂的用量至0.08 g,RhB的降解率却下降,这是因为催化剂的用量较低时,催化活性位点数目也相对较少,增加催化剂的用量,溶液中催化活性位点数增加,可以吸收更多的光子.加入过量的催化剂使得催化剂颗粒聚集,溶液的浑浊度增加,引起光散射,光催化活性下降.

1 ) 0.25 mg/mL;2) 0.5 mg/mL;3) 0.625 mg/mL;4) 1.0 mg/mL图8 催化剂用量对降解RhB的影响Fig.8 Effects of the catalyst dose on degradation of RhB
2.2.4pH值对降解RhB的影响
相同初始浓度不同pH值的RhB溶液加入等量(0.05g)的r(α-Bi2O3︰TiO2) = 1︰5的α-Bi2O3/TiO2催化剂光催化效果不同,结果见图9,暗搅拌30 min后,不同pH值对RhB的吸附量不同,酸性条件下催化剂对RhB的最大吸附量可达81%,随着pH值增加,吸附量逐渐降低,光催化效果也明显减弱.在光催化降解反应中,溶液初始pH值对降解动力学的影响较复杂,溶液pH值改变将影响溶液中催化剂表面的电荷性质和电荷分布,进而影响RhB在催化剂表面的吸附行为.

1) pH=12.5;2) pH=9.8;3) pH=6.7;4) pH=4.2;5) pH=1.5图9 不同pH值对降解RhB的影响Fig.9 Effects of the pH on degradation of RhB
2.2.5催化剂的稳定性
对r(α-Bi2O3︰TiO2) = 1︰5的α-Bi2O3/TiO2进行回收利用,其对RhB的循环降解曲线见图10,图10可见,经3次循环利用后催化剂的光催化效率基本不变,RhB的降解率未见明显降低,合成的α-Bi2O3/ TiO2纳米粒子具有较高的稳定性.
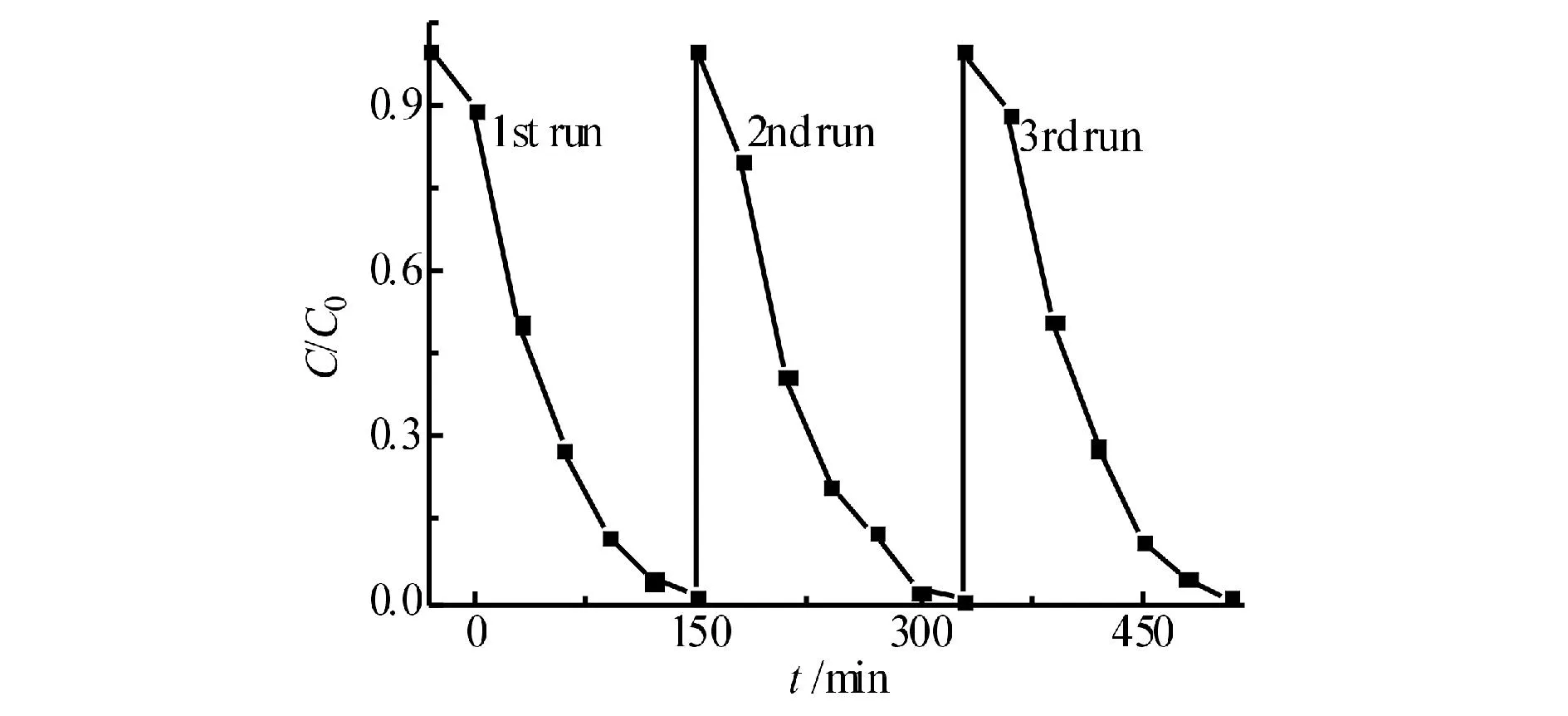
图10 α-Bi2O3/TiO2对RhB光催化降解的循环降解曲线Fig.10 Cyclic degradation curve of the photocatalytic degradation of RhB by α-Bi2O3/TiO2
2.3光催化降解RhB的机理研究
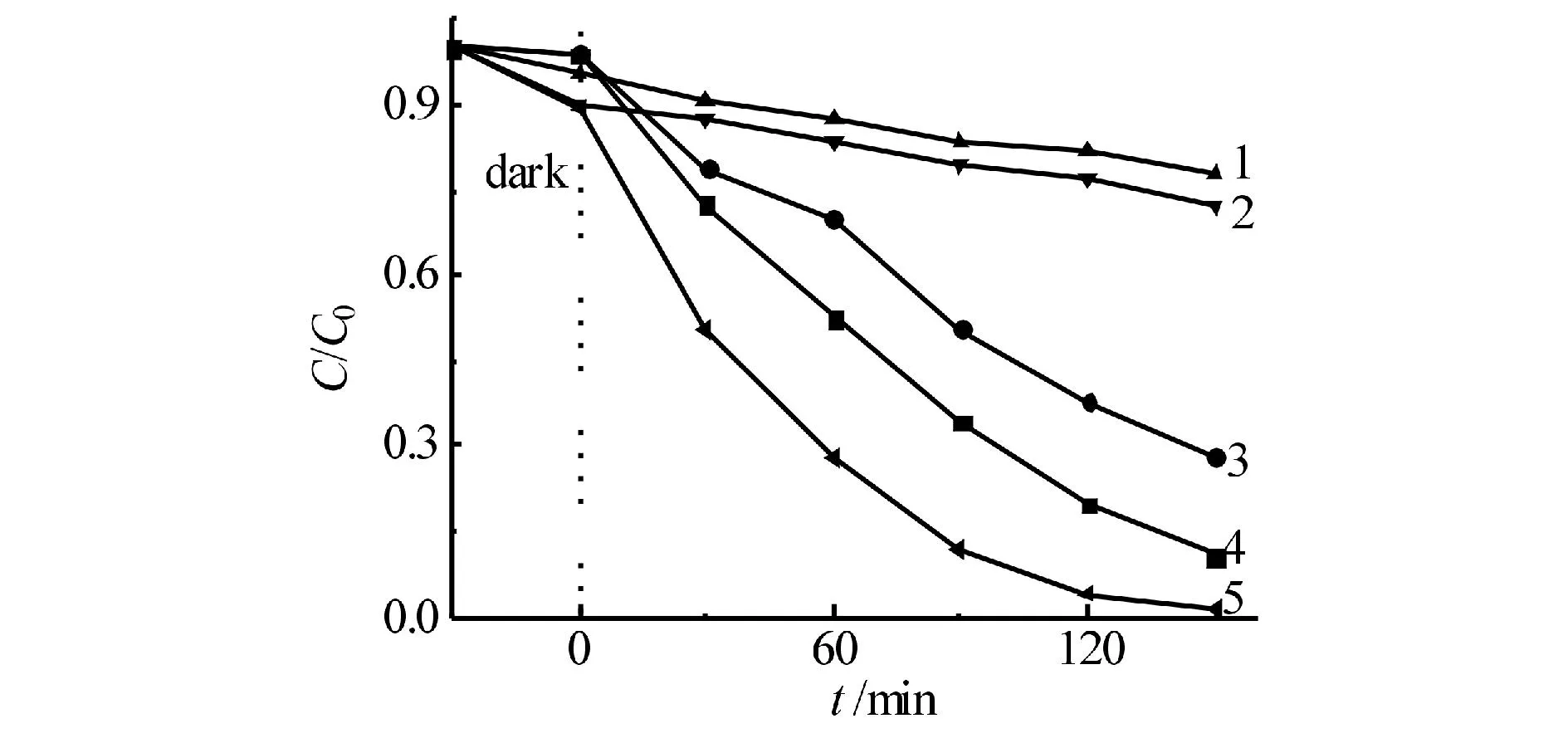
1) 0.01mol/L三乙醇胺;2) 0.001mol/L对苯醌;3) 0.1mol/L异丙醇;4) N2; 5)空白图11 加入不同捕获剂对降解RhB的影响Fig.11 Effects of different scavengers on degradation of RhB
α-Bi2O3/TiO2纳米粒子的光催化机理如图12所示,在α-Bi2O3/TiO2光催化降解RhB体系中,α-Bi2O3与TiO2之间形成异质结构[22],有效地促进了光生载流子的分离,扩展了其在可见光区域内的吸收范围,在可见光照射下,α-Bi2O3价带上电子被激发到导带位置,α-Bi2O3价带位置有部分空置,此时位于TiO2价带上的电子转移至α-Bi2O3的价带位置,空穴则留在TiO2价带上形成氧化-还原中心,溶液中的溶解氧捕获电子生成·O2-,进一步生成·OH参与了RhB的降解过程.
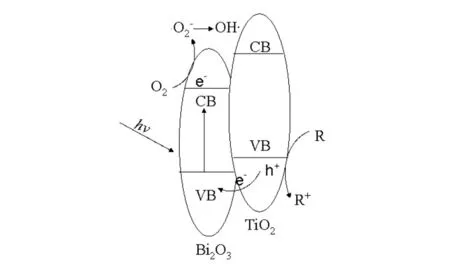
图12 α-Bi2O3/TiO2纳米粒子的光催化机理图Fig.12 Photocatalytic mechanism of α-Bi2O3/TiO2 nanoparticles
3结语
本文采用两步水热法成功地合成了α-Bi2O3/TiO2纳米粒子,复合催化剂较单一α-Bi2O3、TiO2光催化活性更佳,当α-Bi2O3与TiO2的摩尔比为1︰5时,催化剂用量为0.05g在酸性条件下对80 mL的10 mg/L 的RhB的降解效果最佳,复合催化剂具有较高的稳定性.h+和·O2-是在光催化降解过程中起主要的活性物种,α-Bi2O3与TiO2复合后形成异质结构,促使光生电子和空穴有效分离,故光催化活性更高.
参考文献
[1]Gao Y P, Wang L B, Zhou A G, et al. Hydrothermal synthesis of TiO2/Ti3C2nanocomposites with enhanced photocatalytic activity [J]. Mater Lett, 2015, 150(1):62-64.
[2]Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode [J]. Nature, 1972, 238(5358):37-38.
[3]Bai S L, Liu H Y, Sun J H, et al. Improvement of TiO2photocatalytic properties under visible light by WO3/TiO2and MoO3/TiO2composites [J]. Appl Surf Sci, 2015, 338(30):61-68.
[4]Janus M, Choina J, Morawski A W. Azo dyes decompo-
sition on new nitrogen-modified anatase TiO2with high adsorptivity [J]. J Hazard Mater, 2009, 166(1):1-5.
[5]Huang M N, Yu J H, Li B, et al. Intergrowth and coexistence effects of TiO2-SnO2nanocomposite with excellent photocatalytic activity [J]. J Alloys Compd, 2015, 629(25):55-61.
[6]Wang R J, Jiang G H, Ding Y W, et al. Photocatalytic activity of heterostructures based on the TiO2and halloysite nanotubes[J].ACS Appl Mater Interface,2011,3(10):4154-4158.
[7]Song G X, Xin F, Chen J S, et al. Photocatalytic reduction of CO2in cyclohexanol on CdS-TiO2heterostructures photocatalyst[J]. Appl Catal. A:2014,473(5):90-95
[8]袁誉洪, 王权. 球形ZnO/TiO2的颗粒的制备及其光催化研究[J]. 中南民族大学学报(自然科学版), 2014,33(3): 21-23.
[9]胡军成, 陈盛焕, 刘勇, 等. Au-Ag共掺杂TiO2纳米片的制备及其光催化性能[J]. 中南民族大学学报(自然科学版), 2010, 29(3): 1-5.
[10]Lv J, Gao H Z, Wang H, et al. Controlled deposition and enhanced visible light photocatalytic performance of Pt-modified TiO2nanotube arrays[J]. Appl Surf Sci,2015,351:225-231.
[11]Saharudin K A, Sreekantan S, Lai C W. Fabrication and photocatalysis of nanotubulai C-doped TiO2arrays: Impact of annealing atmosphere on the degradation efficiency of methyl orange[J]. Mater Sci Semicond Process,2014,20:1-6.
[12]Mu Y, Yu H Q, Zheng J C, et al. TiO2-mediated photocatalytic degradation of Orange II with the presence of Mn2+in solution[J]. J Photochem Photobiol A: Chem,2004,163(3): 311-316.
[13]Chen C Y, Weng J C, Chen J H, et al. Photocatalyst ZnO-doped Bi2O3prepared by spray pyrolysis[J]. Powder Technol,2015, 272:316-321.
[14]Wang T Y, Xiao G S, Li C Y, et al. One-step synthesis of a sulfur doped Bi2WO6/Bi2O3composite with enhanced visible-light photocatalytic activity[J].Mater. Lett.,2015,138(1):81-84.
[15]龙玉飞, 徐春花, 王俊鹏, 等. 溶胶-凝胶制备TiO2及晶型转变的研究[J].河南科技大学学报(自然科学版),2013,34(2):5-7.
[16]杨昕宇, 向卫东, 张希艳, 等. Bi2O3纳米晶玻璃三阶非线性光吸收性质的研究[J].无机材料学报,2012, 27(3):317-322.
[17]Wang T, Xiao G, Li C, et al. One-step synthesis of a sulfur doped Bi2WO6/Bi2O3composite with enhanced visible-light photocatalytic activity [J]. Mater Charact,2015,138:81-84.
[18]Kawai M T, Soma M, Onishi T, et al. The adsorption and the reaction of NH3and NOx on supported V2O5catalysts: effect of supporting materials[J]. Can J Chem.,1980,58 (20):2132-2137.
[19]Yu S J, Zhang G K, Gao Y Y, et al. Single-crystalline Bi5O7NO3nanofibers: Hydrothermal synthesis, characterization, growth mechanism, and photocatalytic properties[J]. J Colloid Interface Sci, 2011,354(1): 322-330.
[20]Saied S O,Sullivan J L,Choudhury T,et al. A comparison of ion and fast atom beam reduction in TiO2[J]. Vac,1988,38(8/10):917-922.
[21]Morgan W E,Stec W J,Wazer J R,et al. Inner-orbital binding-energy shifts of antimony and bismuth compounds[J]. Inorg Chem,1973,12(4):953-955.
[22]Chen J S,Qin S Y,Liu Y D,et al. Preparation of a visible light-driven Bi2O3-TiO2composite photocatalyst by an ethylene glycol-assisted sol-gel method,and its photocatalytic properties[J].Res Chem Intermed,2014,40(2):637-648.
中图分类号TQ032; O643
文献标识码A
文章编号1672-4321(2016)01-0017-06
基金项目国家民委科研基金资助项目(09ZN02);中南民族大学中央高校基本科研业务费专项资金项目(CZY15004)
作者简介黄正喜(1978-), 女, 副教授,博士,研究方向:纳米粒子的性能研究,E-mail:zxhuang2005@126.com
收稿日期2015-05-19
