细胞转染中单克隆与混克隆干扰基因效率的比较※
2016-04-19朱吉海
刘 燕,朱吉海,孙 伟,赵 珺
(1.青海大学医学院免疫学教研室;2.青海大学附属医院心胸外科)
细胞转染中单克隆与混克隆干扰基因效率的比较※
刘 燕1,朱吉海2,孙 伟1,赵 珺1
(1.青海大学医学院免疫学教研室;2.青海大学附属医院心胸外科)
目的 比较细胞转染中单克隆与混克隆干扰基因效率。方法 采用胃泌素特异干扰载体转染人胃癌原代细胞株L25,经G418抗性筛选获得混克隆和单克隆细胞,应用RT-PCR、Western blot和免疫荧光三种方法对混克隆细胞和单克隆细胞干扰胃泌素基因的效率进行比较。结果 RT-PCR结果显示混克隆细胞胃泌素mRNA表达水平被明显抑制。在挑取的10株单克隆细胞中,胃泌素的表达均受到干扰,其效果有差异,其中有2株单克隆细胞pshRNA-1、pshRNA-10胃泌素mRNA表达水平抑制率达到86%,抑制效率与混克隆细胞相同,其他8株单克隆细胞的平均抑制率为31%。Western blot和免疫荧光结果均显示单克隆细胞pshRNA-1、pshRNA-10与混克隆细胞在胃泌素蛋白水平的干扰效果相同。结论 采用混克隆细胞进行生物学特性鉴定和后续基因表达水平研究,实验信息量大、周期短、污染几率小、可重复性强,是一种省时、简便、高效的方法。
混克隆细胞 单克隆细胞 干扰效率
分子克隆实验中,经常需要把外源性的DNA通过载体导入细胞,以便进行基因功能、基因调控等方面的实验[1-3]。这些研究要求外源基因能够稳定整合到宿主染色体的细胞中,即我们所说的克隆化细胞[4-5]。以往常用的方法是选择性标记,将携带外源基因的载体加上neo抗性基因,用含G418的选择培养基筛选出有效表达外源基因的单克隆细胞[6-8]。但这种方法由于实验周期过长、不可控因素过多,往往鉴定不出有效的单克隆。本研究以干扰胃癌原代细胞株L25中胃泌素基因的表达为例,构建了带有neo抗性的胃泌素干扰载体(pshRNA-gast),将其转染入L25细胞中,经G418抗性筛选建立稳定整合外源基因的混克隆细胞株和单克隆细胞株,应用RT-PCR、Western blot和免疫荧光法比较干扰胃泌素表达的单克隆与混克隆细胞中靶基因表达水平的差异,以明确是否有必要通过获得单克隆细胞进行后续研究。
1 材料与方法
1.1 材料
胃泌素干扰质粒pshRNA-gast及人胃癌原代细胞株由实验室自己构建;细胞培养用DMEM培养基、胎牛血清及胰酶购自美国Gibco公司;Trizol及LipofectamineTM2000试剂购自美国Invitrogen公司;逆转录试剂盒及PCR 10×Mix试剂购自北京Transgen公司;Gastrin抗体购自英国Abcam公司;二抗购自美国Santa cruz公司。
1.2 方法
1.2.1 细胞培养
将细胞培养于含5%胎牛血清的DMEM培养液中(37 ℃,5% CO2)。用0.25%胰酶消化和传代。细胞常规培养至40%~60%汇合时转染。
1.2.2 细胞转染和筛选
1.2.2.1 细胞转染
混合待转染的质粒和脂质体稀释液,吹打混匀,室温静置20 min。把混合液逐滴加入待转染的细胞培养皿中,边加边晃动培养皿,使转染液均匀分布于培养皿。转染细胞继续培养24 h,除去双无培养液,换正常培养液培养。
其后传代到3~4个100 mm细胞培养皿中培养24 h。
1.2.2.2 混克隆筛选
细胞转染48 h后,用0.25%胰酶消化,传代至60 mm培养皿,使每个视野细胞密度在10个左右,加入含G418(400 μg/mL)的选择性培养液进行筛选,每日观察细胞形态,3~5 d换液,22 d左右混克隆形成。经RT-PCR法鉴定混克隆细胞中胃泌素的干扰效果。
1.2.2.3 分离单克隆细胞
用环套法从混克隆细胞培养皿中挑取10个单克隆细胞,接种至96孔板,用含G418(400 μg/mL)的培养液继续筛选培养,待细胞长满96孔板后,传至24孔板继续扩大培养,4 w后得到足量的细胞。
1.3 RT-PCR鉴定胃泌素mRNA水平的干扰效果
分别收集混克隆细胞和单克隆细胞,提取细胞的RNA,用RT-PCR法检测细胞胃泌素mRNA的表达水平。具体方法如下:用Trizol试剂提取细胞总RNA,取4 μg RNA,用随机引物逆转录合成第一链cDNA。以1 μL cDNA为模板,以25 μL反应体系进行常规PCR扩增。所用引物:Gastrin上游,5′GAC GAG ATG CAG CGA CTA TGT 3′;下游,5′ GGG TCT GCC ACG AGG TGT 3′,扩增片段221 bp。β-actin上游,5′CGG GAA ATC GT GCG TGA CAT T 3′,下游:5′CTA GAA GCA TTT GCG GTG GAC 3′,扩增片段510 bp。反应条件:95 ℃下5 min 1个循环;95 ℃下持续30 s,62 ℃下持续30 s,72 ℃下持续30 s,72 ℃下持续600 s,32个循环。产物用1.5%琼脂糖凝胶电泳分离后用凝胶成像仪照相分析。
1.4 蛋白表达水平鉴定结果
1.4.1 Western blot检测胃泌素的蛋白表达水平
收集单克隆细胞和混克隆细胞蛋白,进行SDS -PAGE电泳(5%浓缩胶,15%分离胶),湿转法100 V电压转膜75 min,将凝胶中的蛋白质转移至PVDF膜上。用5%脱脂奶粉封闭(1 h)。将兔抗人胃泌素抗体(1:800,4 ℃)孵育过夜;羊抗兔二抗(1:2000)室温孵育1 h,以 Actin为内参照。化学发光试剂盒显色。
1.4.2 免疫荧光法检测胃泌素的蛋白表达水平
接种适当浓度的细胞悬液至圆形玻片培养(37 ℃,5% CO2,24 h)。4%的多聚甲醛固定细胞(20 min)。将胃泌素多抗( 1:200,4 ℃)过夜孵育。将FITC标记的羊抗兔二抗(1:50 )避光孵育(37 ℃,1 h)。用DAPY(1 μg/mL)衬染细胞核,抗淬灭剂封片,在激光扫描共聚焦显微镜下观察照相。
2 结果
2.1 成功筛选出混克隆细胞和单克隆细胞
人胃癌原代细胞株转染了胃泌素基因干扰质粒后,经G418选择性培养基筛选培养22 d形成混克隆。在100 mm的培养皿中可见100个左右的单克隆细胞,每个克隆大小约200个细胞(图1)。为了进一步获得单克隆细胞,应用环套法从混克隆细胞中挑取10个单克隆,用G418选择性培养液继续筛选培养30 d,获得单克隆细胞。

G418筛选22 d后镜下可见单个分散的细胞克隆,图示一个视野内的细胞克隆形态(a、b×100,c×200)
2.2 胃泌素干扰载体显著抑制混克隆细胞和单克隆细胞中胃泌素mRNA的表达
收集混克隆细胞和挑选的10株单克隆细胞,应用RT-PCR法分别检测细胞内胃泌素的mRNA表达水平。结果显示混克隆细胞内胃泌素基因的表达被明显抑制(图2A、B)。10株单克隆细胞中,只有两株单克隆细胞胃泌素基因的表达有较明显的抑制效果,分别为pshRNA-1和pshRNA-10(图2C、D)。
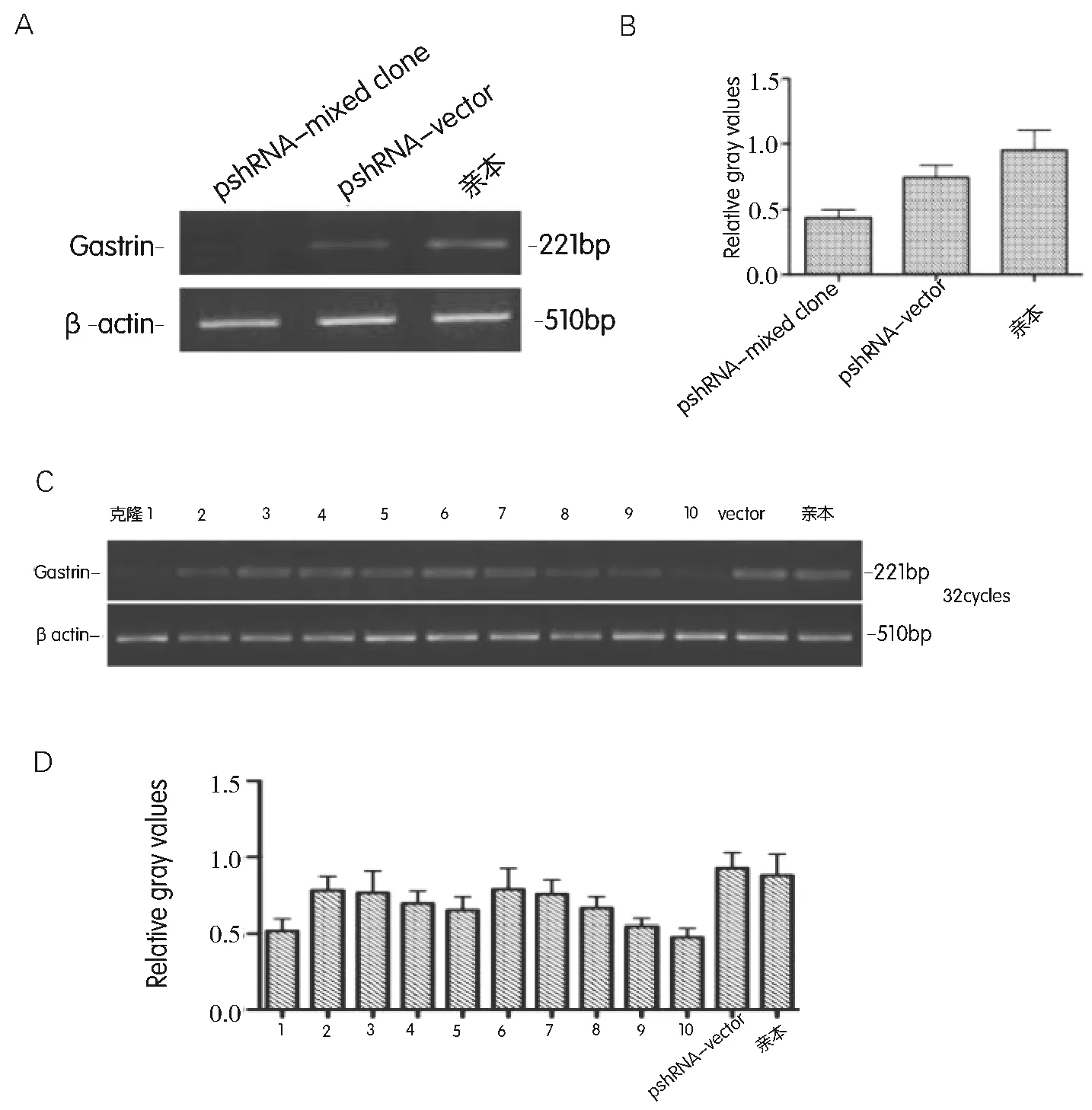
A:混克隆细胞内胃泌素mRNA的表达水平;B:混克隆细胞胃泌素PCR扩增电泳条带的灰度扫描值;C:筛选的10个单克隆细胞内胃泌素mRNA的表达水平;D:单克隆细胞胃泌素PCR扩增电泳条带的灰度扫描值
2.3 胃泌素干扰载体显著抑制混克隆细胞和单克隆细胞中胃泌素蛋白的表达
应用Western blot法分别检测混克隆细胞和单克隆细胞内胃泌素蛋白的表达。结果显示,在内参照一致的情况下,混克隆细胞胃泌素的蛋白表达明显减弱(图3A、B)。而两株mRNA水平干扰效果较好的单克隆细胞内胃泌素的蛋白表达也被明显抑制,pshRNA-1细胞的抑制程度与混克隆细胞相当(图3C、D)。为了进一步验证Western blot的结果,我们制作了混克隆和单克隆细胞的爬片,应用免疫荧光法检测两种细胞中胃泌素的干扰效果。如图所示(图3E),在对照组细胞的胞浆和胞膜可见强绿色荧光的表达(FITC染色),而混克隆细胞和两个单克隆细胞内绿色荧光的表达明显减弱,且减弱程度相当。说明两种细胞内胃泌素蛋白均被抑制,与Western Bolt的结果一致。
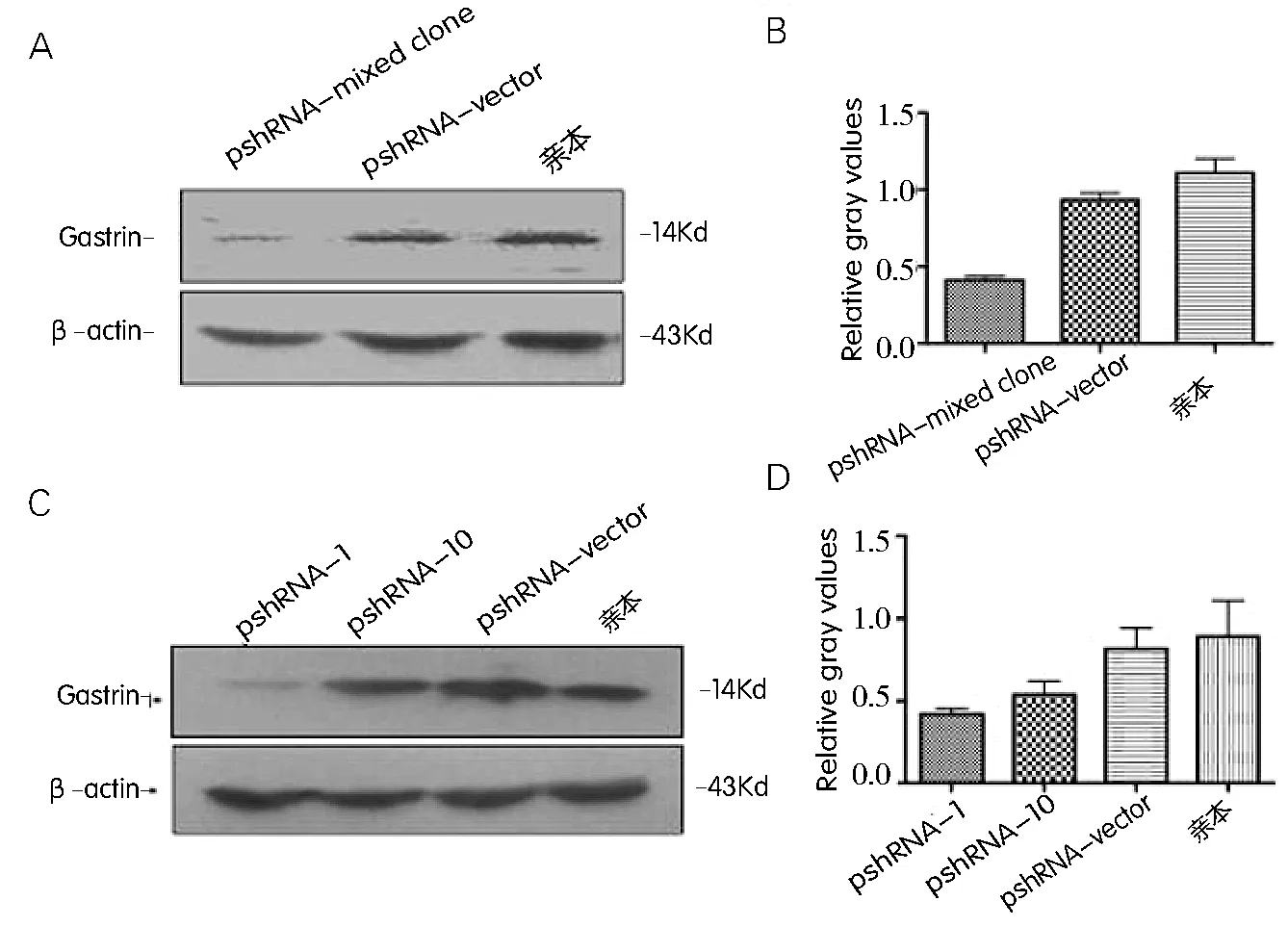
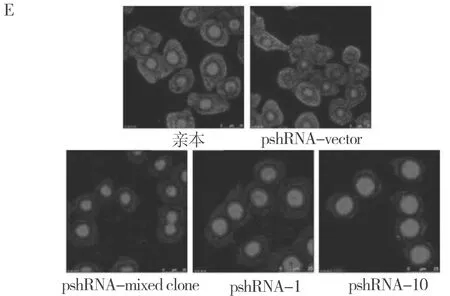
A:混克隆细胞内胃泌素蛋白的表达水平;B:混克隆细胞胃泌素Wb条带灰度扫描值;C:单克隆细胞内胃泌素蛋白的表达水平;D:单克隆细胞胃泌素Wb条带灰度扫描值;E:混克隆和单克隆细胞内胃泌素的表达水平
3 讨论
目前,获得稳定表达外源基因的细胞克隆大多是通过筛选单克隆细胞方法[9-10],但是该过程非常耗费时间和精力,至少需要一个月时间建立转染的混克隆细胞,再用一个月时间从混克隆中分离得到单克隆。由于单克隆没有混克隆保存的信息量大,在长期保存的过程中丢失信息的几率也大。而且在单克隆化的过程中存在不确定因素,经常挑选出十几个单克隆细胞,经过一个多月时间的单克隆筛选,最后只能得到一两株稳定转染较成功的细胞。如本实验中,挑取的10个单克隆细胞经鉴定,稳定沉默特定基因的细胞只有2株。筛选22 d得到的混克隆细胞与历经两个月筛选得到的单克隆细胞对胃泌素基因的干扰效率基本相同。而筛选混克隆与筛选单克隆比较,具有实验周期短、操作简单、结果可靠、细胞长期保存较稳定等特点,所以对一些细胞遗传背景要求不高的实验,我们可以直接用混克隆进行后续实验,而没有必要单克隆化,减少污染机会,实验结果也不受影响。
有人担心混克隆细胞对后续实验有影响。其实很多实验不需要真正的单克隆,只要求细胞能够表达转染的重组质粒、达到表达或者干扰目的蛋白的目的。即使我们得到的单克隆,在培养数代后由于细胞中整合的载体会脱落下来,干扰效果也会逐渐减退,所以单克隆并不一定能够稳定地表达外源基因。
应用混克隆细胞进行后续实验,需要优化筛选条件以得到高效表达目的基因的混克隆,包括优化抗生素的筛选条件,其中G418筛选的时间和剂量是至关重要的。筛选过程中当大量细胞死亡的同时有极少数的细胞在不断增殖,此时不要急于挑取克隆,要继续用选择性培养基筛选,此时已形成克隆的细胞还会有个别脱落死亡,因为早期没有被筛选掉的细胞DNA可能转染进细胞了,但没有整合到宿主的染色体上,又或者DNA整合进宿主的染色体了,但整合的位置不稳定,这些细胞只要继续筛选会陆续死亡。一般等到细胞不再发生脱落、克隆长到足够大、克隆间即将发生接触抑制的时候才能获得真正整合了外源DNA的细胞克隆。
[1]Sambrook J,Russell DW.Molecular cloning 3ed[M].New York:Cold spring harbor laboratory press,2001:611-627.
[2]鄂征.组织培养和分子细胞学技术[M].北京:北京出版社,1994:12.
[3]薛庆善.体外培养的原理和技术[M].北京:科学出版社,2001:2.
[4]D.L.斯佩克特,L.A.莱因万德,黄培堂,等.细胞实验指南[M].北京:科学出版社,2003:7.
[5]叶展,李劲松,赵涵芳,等.hVEGF_(165)单克隆工程细胞的筛选和鉴定[J].外科理论与实践,2006,11(1):49-52.
[6]BAO Wei,FU Hai-Jing,XIE Qiao-Sheng,et al.HER2 Interacts With CD44 to Up-regulate CXCR4 via Epigenetic Silencing of microRNA-139 in Gastric Cancer Cells[J],Astroenterology,2011,141:2076-87.
[7]DENG Hua,GUO Rui-Fang,LI Wen-Mei,et al.Matrix metalloproteinase 11 depletion inhibits cell proliferation in gastric cancer cells[J].Biochemical and Biophysical Research Communications,2005,326 :274-81.
[8]YANG Yan-Hong,DENG Hua,LI Wen-Mei,et al.Profiling Tumor Marker in Serum Based on Gene Expression Identification of Matrix Metalloproteinase 11 as a Predictive[J],Clin Cancer Res,2008,14:74-81.
[9]HE Shun,YANG Shang-bin,XU Ning-zhi,et al.Aurora kinase A induces miR-17-92 cluster through regulation of E2F1 transcription factor[J].Cell.Mol.Life Sci,2010,67:2069-76.
[10]Sebastian Krug,Johannes Huth,Friederike Göke,et al.Knock-down of Pdcd4 stimulates angiogenesis via up-regulation of angiopoietin-2[J],Biochim Biophys Acta,2012,1823(4):789-99.
Comparative study on the efficiency of gene interference between monoclonal and mixed clone cell during cell transfection
LIU Yan1,ZHU Ji-hai2,SUN Wei1,ZHAO Jun1
(1.Department of Immunology,Qinghai University Medical College;2.Department of Cardiothrocic Surgery,the Affiliated hospital of Qinghai University)
Objective To compare the efficiency of gene interference between monoclonal and mixed clone cell during cell transfection.Methods Gastrin specific short/small hairpin RNAs(shRNAs)vector was transfected into L25 cell.RT-PCR,Western blot and immunofluorescence analyses were used for detecting gastrin expression at the mRNA level and protein level in mixed clone and monoclone which obtained by G418 resistence screening.Results The RT-PCR results showed that the most dramatic decrease in gastrin mRNA level was appeared in mixed clone.The gastrin expression level in 10 monoclones were discrepancy.Among the total monoclones,only pshRNA-1 and pshRNA-10 clones showed the significant decrease in gastrin mRNA level,and there interference efficiency was the same as mixed clone.Consistent with this found,Western blot and immunofluorescence analyses showed that in gastrin interference cells,pshRNA-mixed clone,pshRNA-1 and pshRNA-10 monoclones had almost the same gastrin expression efficiency.Conclusion In cell transfection experiments,there are a lot of problems on the selection of monoclones,such as long cycle for screening,the easiness of losing targeted gene in long-term preservation.While,directly using mixed clone for subsequent research give many advantages such as high authenticity of the experiment,being time-saving and less pollution risk,this method is superior to choose monoclones.
Mixed clone cells Monoclonal cells Interference efficiency
※:国家自然科学基金(编号:81550043);青海省自然科学基金青年项目(编号:2015-ZJ-940Q) 刘燕(1981~),女,汉族,青海籍,副教授
R730
A
10.13452/j.cnki.jqmc.2016.04.009
2016-09-11
