青南高原多房棘球蚴myophilin基因的克隆和序列分析*
2016-04-19何顺伟张耀刚李超群魏晓星
何顺伟,张耀刚,李超群,彭 源,魏晓星,#
(1.青海大学生态环境工程学院;2.青海大学医学院基础医学部,青海 西宁 810016 )
青南高原多房棘球蚴myophilin基因的克隆和序列分析*
何顺伟1,张耀刚2,李超群2,彭 源2,魏晓星1,2#
(1.青海大学生态环境工程学院;2.青海大学医学院基础医学部,青海 西宁 810016 )
目的 克隆多房棘球绦虫(Em)的myophilin基因并对其序列进行分析与预测。方法 提取Em原头节总RNA,采用RT-PCR技术扩增myophilin基因,将PCR产物连接入pGM-T载体,转化入DH 5α感受态细胞,挑选阳性克隆送测序。采用生物信息学软件对测序结果进行序列比对分析,同时预测编码蛋白的理化性质、二级结构、三级结构、翻译后修饰位点、结构域和抗原表位。结果 扩增出长度为576 bp的cDNA片段,包含完整开放阅读框(ORF),编码190个氨基酸,与已知细粒棘球绦虫的序列同源性达99%。预测结果显示,编码蛋白分子式为C935H1519N255O285S11,理论分子质量为212 876,PI为8.66。α-螺旋、β-折叠和无规则卷曲在二级结构中所占的比例分别为51.58%、10.00%和38.42%。含有10个翻译后修饰位点,各1个Calponin结构域和CH结构域,8个B细胞抗原表位和6个T细胞抗原表位。结论 成功克隆出Em的myophilin基因并对其进行了有效分析和预测。
多房棘球蚴 亲肌肉抗原 基因 克隆 序列 分析
细粒棘球绦虫(Echinococcosis granulosa,Eg)和多房棘球绦虫(Echinococcus multilocularis,Em)的幼虫感染机体可分别引发囊型包虫病(Cystic echinococcosis,CE)和泡型包虫病(Alveolar echinococcosis,AE),是我国西北畜牧地区流行的人畜共患寄生虫病。近年来,免疫诊断和疫苗预防研究是包虫病防控研究的重点[1]。而寻找灵敏特异的抗原是包虫病免疫诊断和疫苗预防的基础和前提[2]。
研究发现,亲肌肉蛋白(myophilin)为棘球绦虫的一种具有特异免疫原性的天然抗原,在CE的免疫研究中已取得良好的效果[3-5],而目前在AE中的研究较少。因此,本研究拟从Em原头节中克隆出myophilin基因,分析其基因序列,预测编码蛋白属性,为进一步研究myophilin蛋白的免疫保护作用奠定基础。
1 材料与方法
1.1 材料选择
Em原头节来自青海西宁地区经Em感染的小鼠。TRIzol®LS Reagent购自上海索莱宝公司;TIANScript RT Kit、2×Taq PCR MasterMix、GeneGreen核酸染料、D2000 DNA Marker、普通琼脂糖凝胶DNA回收试剂盒、pGM-T连接试剂盒、DH 5α感受态细胞均购自北京天根公司。引物由上海生工公司合成,其中上游引物为5′-ATGGATCCATGTCGAACGTTCCACCTCC-3′,下游引物为5′-GCCTCGAGAATCTAATCCATGATCATGC-3′(下划线为BamHI/Xhol酶切位点)。
1.2 总RNA的提取与反转录
按TRIzol®LS Reagent的操作说明提取原头节总RNA,随后反转录成cDNA模板,置-20 ℃冰箱保存。
1.3 myophilin基因的扩增与测序
PCR扩增反应体系:cDNA 1 μL,2×Taq PCR MasterMix 10 μL,上、下游引物各1 μL,补水至20 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。将目的片段切胶回收,连接入pGM-T载体,转化入E.coli DH 5α感受态细胞,涂布于培养皿上过夜培养,挑取阳性克隆测序(上海生工公司)。
1.4 myophilin基因序列分析
利用BLAST软件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)将测序结果同已报道的Eg的myophilin核苷酸和氨基酸序列进行比对分析。
1.5 myophilin蛋白预测
1.5.1 理化性质预测
使用ProtParam软件(http://expasy.org/tools/protparam.html)推算蛋白质的基本理化性质。
1.5.2 二、三级结构预测
使用GOR4软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)预测蛋白质的二级结构。使用SWISS-MODEL服务器(https://swissmodel.expasy.org/)模拟蛋白质的三级结构。
1.5.3 翻译后修饰位点和结构域预测
使用MotifScan软件(http://myhits.isb-sib.ch/cgi-bin/motif_scan)预测酰胺化、糖基化等翻译后修饰位点和结构域。
1.5.4 抗原表位预测
使用DNAstar软件的Protean模块中不同分析方法预测蛋白抗原表位。选用Hopp-Woods亲水性、Emini表面可及性、Karplus-Schulz柔性、Jameson-wolf抗原性指数4种参数综合预测B细胞抗原表位。选用AMPHI和Rothbard-Taylor两种方法联合预测T细胞抗原表位。
2 结果
2.1 myophilin基因的扩增与测序
采用RT-PCR技术从Em原头节中扩增出约576 bp的目的条带(图1)。
2.2 基因序列分析
经测序后共得到576 bp的cDNA序列(图2)。Blast比对显示,该序列包含573 bp的开放阅读框,编码190个氨基酸。与Eg的myophilin核苷酸序列(GenBank:Z29075.1)和氨基酸序列(GenBank:CAA82316.1)同源性均为99%。编码区有6个碱基不同,分别是54位的C-T、123位的A-G、287位的T-G、324位的T-C、351位T-C和528位的T-C;一处氨基酸有差异,为第96位的V-G(缬氨酸-甘氨酸)。
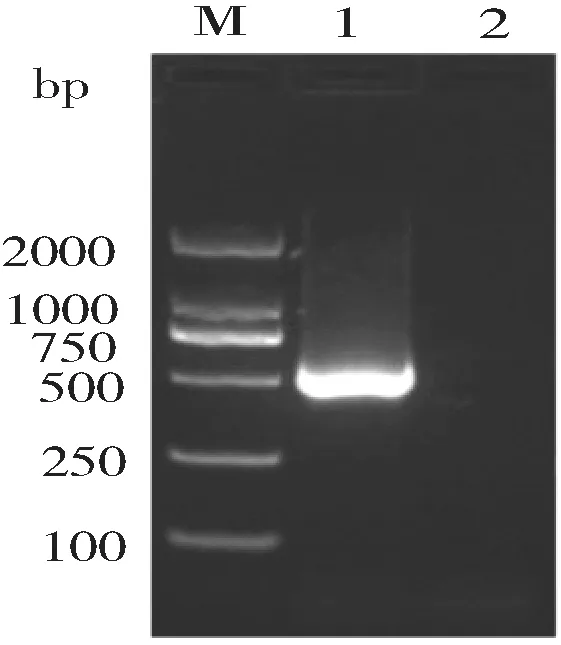
M:DNA标志物(D2000);1:目的基因,2:阴性对照

图2 myophilin基因的测序结果图
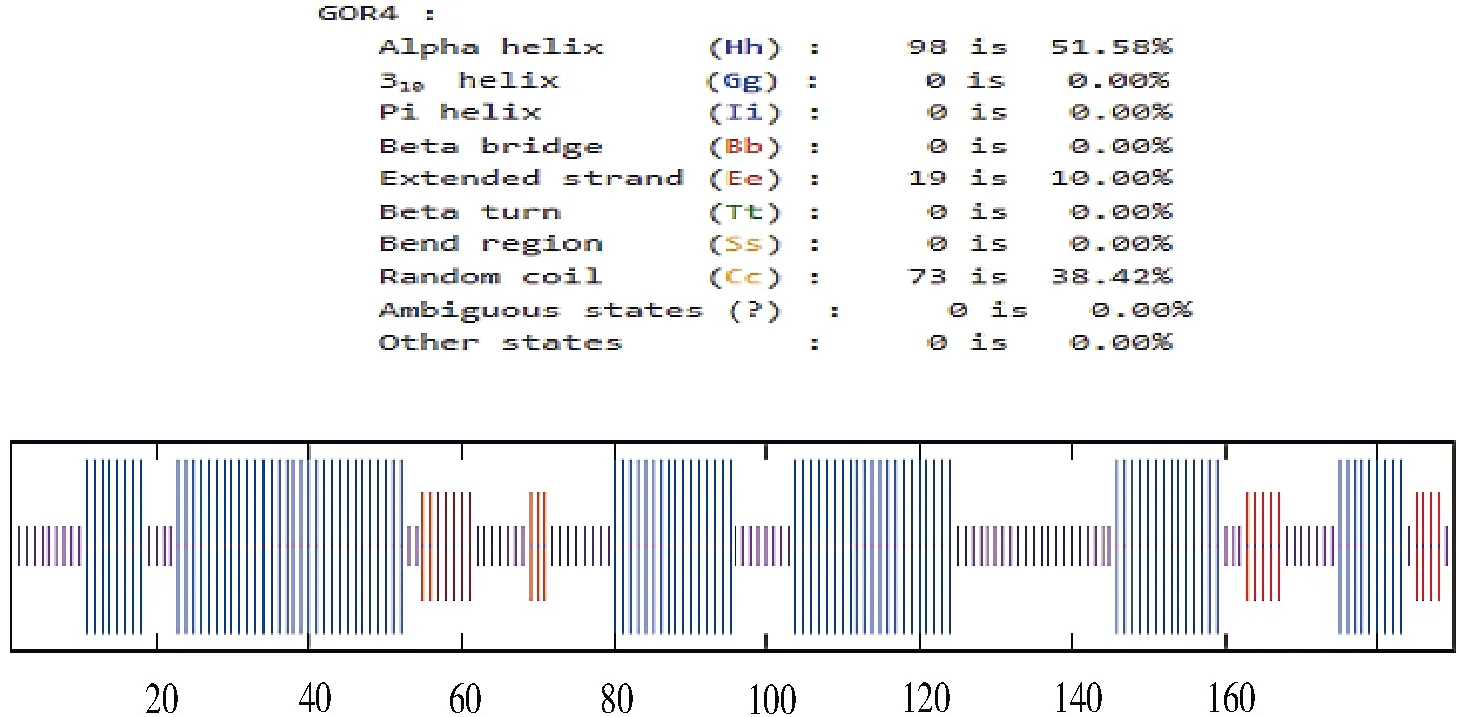
图3 二级结构预测结果图
2.3 蛋白预测
2.3.1 理化性质
经Protparam在线预测,myophilin蛋白Lys含量最多(10.5%),His和Trp含量最少(0.5%),理论分子量为212 876,pI为8.66,酸性氨基酸(D,E)为24个,碱性氨基酸(K,R)为27个。原子组成为C935H1519N255O285S11,不稳定指数为31.97,半衰期为30 h(mammalian reticulocytes,in vito)。脂肪族氨基酸指数为82.11,总平均亲水性为-0.473。
2.3.2 二、三级结构
GOR4软件预测结果显示(图3),α-螺旋占氨基酸总数的51.58%,β-折叠占10.00%,无规则卷曲占38.42%。运用SWISS-MODEL软件模拟蛋白的3D构象(图4),该模型主要由4个α螺旋和1个β折叠以及多个无规则卷曲组成。
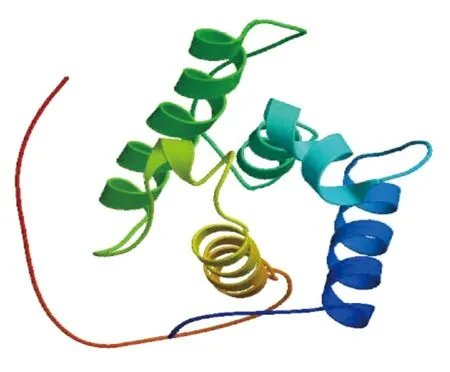
图4 三级结构模拟结果图
2.3.3 翻译后修饰位点和结构域
MotifScan特定位点分析结果显示,myophilin蛋白可能存在以下翻译后修饰位点:1处酰胺化位点(19-22位氨基酸),2处N-糖基化位点(76-79、86-89位氨基酸),1处酪蛋白激酶Ⅱ(CK2)磷酸化位点(132-135位氨基酸),4处N-肉豆蔻酰位点(55-60、98-103、170-175、179-184位氨基酸),2处蛋白激酶C(PKC)磷酸化位点(64-66、171-173位氨基酸)。可能存在2处典型的蛋白结构域:1处钙调理蛋白结构域(Calponin),位于165-189位氨基酸和1处钙调理蛋白同源结构域(CH),位于25-131位氨基酸。
2.3.4 抗原表位
用DNAstar软件分析各项指标结果(图5,表1)。结合Hopp-Woods亲水性、Emini表面可及性、Karplus-Schulz柔性和Jameson-wolf抗原性指数4种参数中分值较高的表位区域,预测出8个B细胞抗原表位,分别为15-29、41-48、72-77、110-115、130-136、145-161、169-177和181-188位氨基酸。结合AMPHI和Rothbard-Taylor两种分析结果预测出6个T细胞抗原表位,分别为46-53、59-75、82-96、100-108、117-123和155-163位氨基酸。
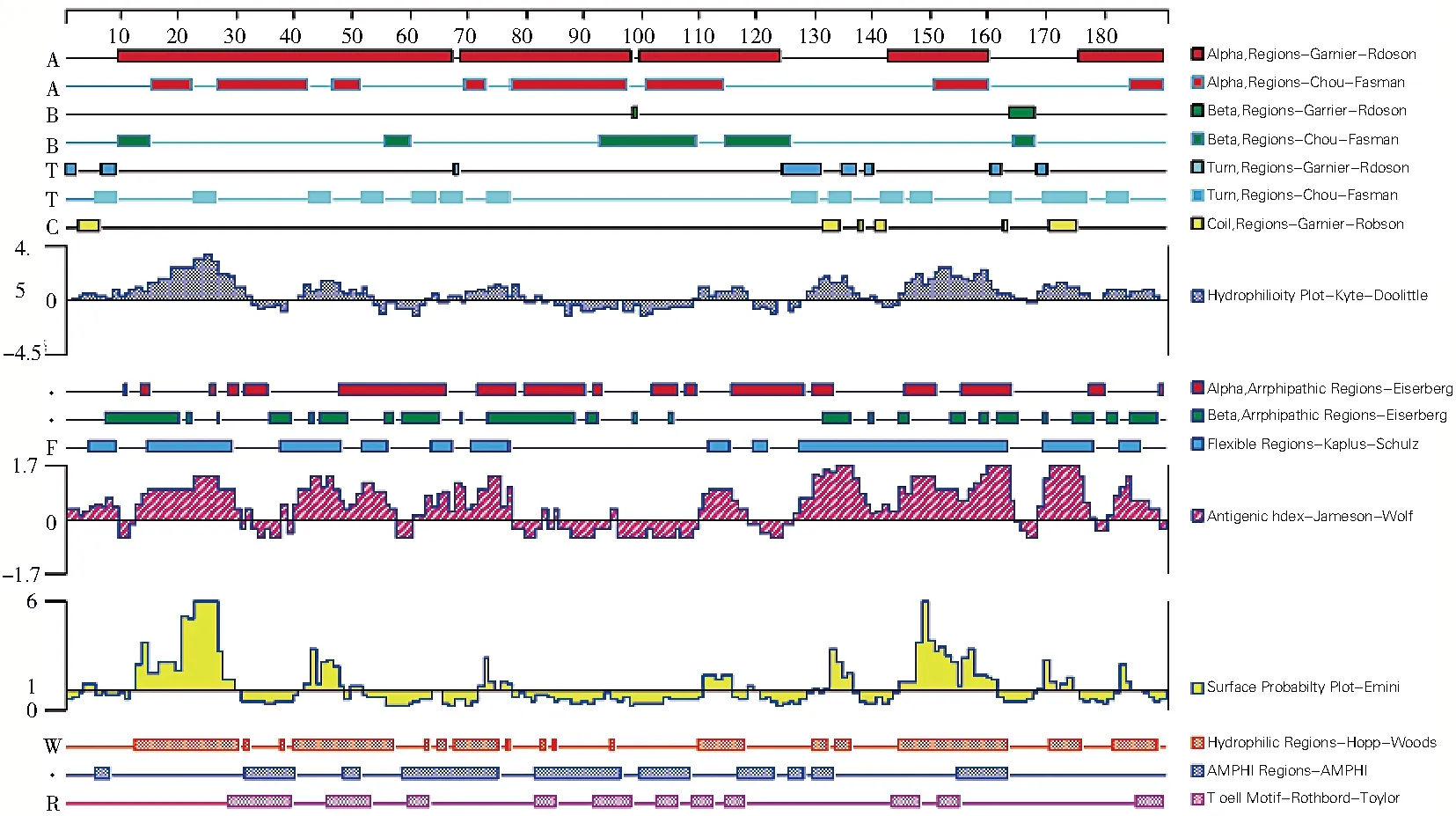
图5 DNAstar分析结果图

表1 不同分析方法所得预测结果
3 讨论
Myophilin基因编码区全长573 bp,编码190个氨基酸。Martin等[3]最早从Eg中克隆和鉴定出myophilin基因,因其编码蛋白特殊的分布位置及与其他肌肉蛋白高度同源故称之为亲肌肉基因。随后,他们克隆了397 bp Em的部分myophilin cDNA序列[6]。张静等[7]首次克隆了我国大陆株Eg的myophilin基因,序列与Martin等报道的相一致。本研究从青南高原Em原头节中成功扩增出了myophilin基因完整的开放阅读框,将测序结果与Eg的参考序列比对发现二者相似度达99%,仅有6个碱基和1个氨基酸不同,而与前述报道Em的myophilin序列相一致。
氨基酸的排列顺序决定了蛋白质的特殊功能和高级结构,蛋白的生物活性和天然构象很大程度上依赖于其氨基酸的编码区序列。随着分子生物学技术的不断发展和广泛应用,使用生物信息学软件分析和预测蛋白氨基酸序列,操作简便、迅速,不仅可以清楚地了解蛋白的基本性质,而且还可直观地得到该蛋白的特殊结构。本研究选用相应的在线网络软件对Em的myophilin蛋白的理化性质和二、三级结构进行预测。推测该蛋白理论分子质量为212 876,等电点为8.66,这与同源的Eg myophilin蛋白的研究结果相一致。预测的α-螺旋、β-折叠和无规则卷曲在二级结构中所占的比例分别为51.58%、10.00%和38.42%,由于α-螺旋和β-折叠有利于稳定蛋白质的二级结构,无规则卷曲处有利于形成抗原表位,因此myophilin蛋白具有良好的稳定性和较强的抗原性。通过对三维结构的模拟,可以加深我们对其线性和空间结构的了解。
甲基化、糖基化等常见的翻译后修饰是蛋白质成熟的必要程序,对蛋白的结构和功能至关重要[8]。Martin等[6]对Eg中myophilin蛋白的亚型和PKC磷酸化研究发现,该蛋白与钙结合蛋白不仅氨基酸序列高度同源,而且在组织定位、蛋白亚型、体外PKC磷酸化、相对保守区域等方面都十分相似,因此认为myophilin蛋白很可能参与平滑肌收缩,与棘球绦虫的肌肉运动有关。他们采用生物化学的方法体外证实myophilin蛋白含有两个PKC位点(Ser-64、Ser-171)。同时通过二维蛋白电泳分离Eg幼虫体内的蛋白,获得了4种myophilin蛋白亚型(α、β、γ、δ),推测这些亚型可能为翻译后修饰的结果。本研究预测myophilin蛋白可能含有10个翻译后修饰位点和2个典型的蛋白结构域,这同上述Eg中myophilin蛋白的生物学功能研究相一致。
Myophilin蛋白是一种保护性抗原。多项研究表明[9~11],使用myophilin重组蛋白免疫小鼠,可使小鼠获得较高的免疫保护力。此外,在旋毛虫[12]、日本血吸虫[13]和华支睾吸虫[14]等虫体中已相继发现亲肌肉蛋白或类似蛋白,并且实验证实这些蛋白都是特异性肌肉抗原。因此,myophilin蛋白是一个极具应用潜能的诊断和疫苗候选分子。目前,信息学技术已逐渐成为蛋白抗原表位筛选的重要工具,为判断蛋白是否具有疫苗分子潜力或者怎样设计才能具有更好的免疫效果提供了便利条件。本研究使用DNAstar软件中多个参数对myophilin蛋白的B、T细胞抗原表位进行预测与分析,共评估出8个B细胞抗原表位和6个T细胞抗原表位,为后续保护性抗原表位的筛选提供参考。但myophilin蛋白能否作为Em有效抗原的基本条件和诱导宿主产生特异性免疫应答,仍需要进一步实验证实。
本研究对Em的myophilin基因进行了分析研究,从分子水平了解了Em的生理代谢、致病机制和生物学功能,为后续基于myophilin蛋白的包虫病免疫诊断和疫苗研发提供了理论依据。
[1]Nunnari G,Pinzone MR,Gruttadauria S,et al.Hepatic echinococcosis:clinical and therapeutic aspects[J].World J Gastroenterol,2012,18(13):1448-1458.
[2]赵莉,张旭,张状志,等.包虫病诊断技术与预防疫苗的研究进展[J].疾病预防控制通报,2013,28(2):84-87.
[3]Martin RM,Gasser RB,Jones MK.et al.Identification and characterization of myophilin,a muscle-specific antigen of Echinococcus granulosus[J].Mol and Biochem Parasitol,1995,70:139-148.
[4]Martin RM,Colebrook AL,Gasser RB,et al.Antibody responses of patients with cystic hydatid disease to recombinant myophilin of Echinococcus granulosus[J].Acta Tropica,1996,61:307-314.
[5]马锐,师志云,李昭宇,等.细粒棘球绦虫(中国大陆株)亲肌肉抗原重组蛋白的免疫保护性研究[J].中国人畜共患病学报,2010,26(4):330-332.
[6]Martin RM,Csar XF,Gasser RB,et al.Myophilin of Echinococcus granulosus:isoforms and phosphorylation by protein kinase C[J].Parasitology,1997,115(Pt 2):205-211.
[7]张静,赵嘉庆,王娅娜,等.细粒棘球蚴中国大陆株亲肌肉基因分子克隆和序列分析[J].宁夏医学院学报,2006,28(3):185-192.
[8]Garavelli JS,The RESID Database of Protein Modifications as a resource and annotation tool[J].Proteomics,2004,4(6):1527-1533.
[9]马锐,师志云,于晶晶,等.细粒棘球蚴中国大陆株亲肌肉抗原重组蛋白的表达、纯化及免疫学鉴定[J].宁夏医学院学报,2008,30(1):1-3.
[10]于晶晶,王娅娜,赵巍,等.细粒棘球绦虫(中国大陆株)亲肌肉抗原重组蛋白诱导小鼠免疫应答的研究[J].中国病原生物学杂志,2012,7(12):909-911.
[11]Sun J,Wang Y,Li Z,et al.Echinococcus granulosus:immunoprotection accompanyied by humoral and cytokine response against secondary hydatidosis in mice immunized with rEg.myophilin[J].Vet Res Commun,2011,35(4):193-200.
[12]赵香菊,王丽娜,王晶,等.旋毛虫亲肌肉抗原的基因克隆和序列分析[J].中国病原生物学杂志,2014,9(2):168-171.
[13]Peng H,Song K,Huang C,et al.Expression,immunolocalization and serodiagnostic value of a myophilin-like protein from Schistosoma japonicum[J].Exp Parasitol,2008,119(1):117-124.
[14]Wang L,Wang ZQ,Hu DD,et al.Proteomic analysis of Trichinella spiralis muscle larval excretory-secretory proteins recognized by earlyinfection sera[J].Biomed Res Int,2013,2013:139745.
Cloning and sequence analysis of the myophilin gene in Echinococcus multilocularis from Southern Qinghai Plateau
HE Shun-wei,ZHANG Yao-gang,LI Chao-qun,PENG Yuan,WEI Xiao-xing*
(1.Department of Ecologically-environment Engineering,Qinghai University;2.Department of Medical College,Qinghai University,Qinghai 810016,China)
Objective Cloning the myophilin gene in Echinococcus multilocularis,analysis and forecast of its sequence.Methods Total RNA was exacted from the protoscoleces of Em and the myophilin gene was cloned by reverse transcription RCR(RT-PCR).The PCR products were connected into the pGM-T vectors and then transformed into DH 5α competent cells.Positive clone was sequenced.Bioinformatics softwares were used to analysis the sequencing results and predict the physical and chemical properties,secondary structure,tertiary structure,post-translated modification sites,domains and antigen epitopes of the encoded protein.Results The 576 bp cDNA fragment was cloned,containing the complete open reading frame(ORF)and encoding 190 amino acids.The homology was up to 99% with the known sequence of Eg.Prediction results showed that the molecular formula of the encoded protein was C935H1519N255O285S11.Its theoretical molecular weight was 212876 and isoelectric point was 8.66.Alpha helix,β-sheet,and random coil accounted for 51.58%,10.00% and 38.42% in the secondary structure,respectively.There were 10 post-translated modification sites,a calponin domain,a CH domain,8 potentail B cell antigen epitopes and 6 potential T cell antigen epitopes in the myophilin protein.Conclusions The myophilin gene was cloned from Em successfully,and effective analysised and predicted.
Echinococcus multilocularis Myophilin Gene Cloning Sequence Analysis
*青海省科技厅项目(N0.2016-ZJ-746);#:通讯作者,硕士生导师,Email:weixiaoxing@tsinghua.org.cn
R383.3
A
10.13452/j.cnki.jqmc.2016.04.002
2016-09-25
何顺伟(1988~),女,汉族,河南籍,在读硕士研究生
