血清中性粒细胞载脂蛋白检测对急性细菌感染性疾病的诊断价值
2016-04-18金宇亭张宇胡维邹墅魏实林黄晶
金宇亭,张宇,胡维,邹墅,魏实林,黄晶
(1吉林大学白求恩第一医院,吉林长春130021;2长春博德生物技术有限责任公司)
血清中性粒细胞载脂蛋白检测对急性细菌感染性疾病的诊断价值
金宇亭1,张宇2,胡维1,邹墅2,魏实林2,黄晶1
(1吉林大学白求恩第一医院,吉林长春130021;2长春博德生物技术有限责任公司)
摘要:目的探讨血清中性粒细胞载脂蛋白(HNL)检测对急性细菌感染性疾病诊断的价值。方法 选取急性细菌感染患者79例为细菌感染组(脓毒血症组24例、局部细菌感染组55例)、病毒感染患者39例(病毒感染组)、健康体检者45例(对照组),分别采用酶联免疫法、化学发光法、免疫比浊法检测抗生素使用前和使用后血清HNL、降钙素原(PCT)及C反应蛋白(CRP),采用受试者工作特征(ROC)曲线评价HNL、PCT、CRP水平变化对急性细菌感染性疾病的诊断效能。结果治疗前,血清HNL、PCT、CRP水平脓毒血症组>局部细菌感染组>病毒感染组>对照组(P均<0.05);随着治疗时间增加,局部细菌感染组HNL和PCT检测值在诊断界值以上患者的比例显著降低。分析ROC曲线,血清HNL诊断急性细菌感染性疾病的效能与PCT相仿(P>0.05),优于CRP(P<0.05);其cut-off值为141.43 μg/L时,灵敏度、特异度最高。结论 血清HNL(141.43 μg/L)可作为急性细菌感染早期诊断的指标,且其水平变化能反映患者细菌感染控制情况。
关键词:急性细菌感染性疾病;中性粒细胞载脂蛋白;脓毒血症;降钙素原;C反应蛋白
细菌感染在临床上十分常见,脓毒症等严重感染性疾病的发病率和病死率也呈上升趋势。实验室常用炎性指标WBC、C反应蛋白(CRP)等的敏感性或特异性欠佳,细菌培养耗时且阳性率低。中性粒细胞载脂蛋白(HNL)是在中性粒细胞二级颗粒中发现的一种新型分泌型蛋白[1]。研究发现,HNL是一重要的细菌感染指标,HNL水平升高可以用来鉴别诊断细菌感染和病毒感染,且有较高的敏感性、特异性[2~4]。本研究定量检测各类感染患者血清HNL,并与降钙素原(PCT)及CRP比较,以探讨HNL水平对急性细菌感染诊断的价值。
1资料与方法
1.1临床资料选取于2015年6~8月吉林大学白求恩第一医院感染科收治的细菌感染患者79例,经影像学或细菌培养并结合临床症状确诊,男43例、女36例,年龄(45±19)岁。根据文献[5]及相关临床症状,将细菌感染患者分为脓毒血症组(24例)、局部细菌感染组(55例)。局部细菌感染组中细菌性肺炎25例、泌尿系统感染14例、急性腹膜炎4例、化脓性胆管炎3例、盆腔炎2例、肝脓肿2例、细菌性脑膜炎2例、急性扁桃体炎2例、蜂窝织炎1例。同期选择病毒感染患者39例(病毒感染组),均经检测病毒特异性抗体阳性,男18例、女21例,年龄(39±12)岁,感染性腹泻15例、手足口病9例、传染性单核细胞增多症7例、病毒性脑炎5例、腮腺炎3例。体检中心健康体检者45例(对照组),男22例、女23例,年龄(43±20)岁。各组性别、年龄比较差异无统计学意义。
1.2血清HNL、PCT、CRP检测研究对象均于治疗前进行血清HNL、PCT、CRP水平测定,局部细菌感染组分别于应用抗菌药物治疗48、72 h再次测定血清HNL、PCT、CRP水平。血清中HNL水平采用长春博德生物技术有限公司提供的HNL检测试剂盒(酶联免疫法)检测,PCT采用罗氏Cobas E602全自动免疫分析仪及配套试剂进行定量检测,CRP采用SIEMENS BNⅡ全自动蛋白分析仪及配套试剂进行定量检测。
1.3统计学方法采用SPSS18.0统计软件。计量资料以中位数(M)表示,两组间比较采用Mann-WhitneyU检验;采用受试者工作特征(ROC)曲线评价HNL、PCT、CRP对急性细菌感染性疾病的诊断效能。P<0.05为差异有统计学意义。
2结果
2.1各组血清HNL、PCT、CRP水平比较治疗前, HNL、PCT、CRP水平脓毒血症组>局部细菌感染组>病毒感染组>对照组,比较差异有统计学意义(P均<0.05);局部细菌感染组治疗48、72 h后HNL、PCT、CRP水平逐渐下降(P均<0.05)。见表1。随着治疗时间增加,HNL和PCT检测值在诊断界值以上患者的比例显著降低,而治疗72 h后仍有76%的患者CRP检测值维持在诊断界值以上,见图1。
2.2HNL、PCT和CRP诊断细菌感染的效能比较血清HNL诊断细菌感染的ROC曲线下面积(0.973)与PCT(0.957)、联合检测(0.993)比较差异无统计学意义(P均>0.05),与CRP(0.882)比较差异有统计学意义(P<0.05)。根据ROC曲线,当血清HNL的cut-off值为141.43 μg/L时,灵敏度(94.50%)、特异度(97.40%)最高。见图2。
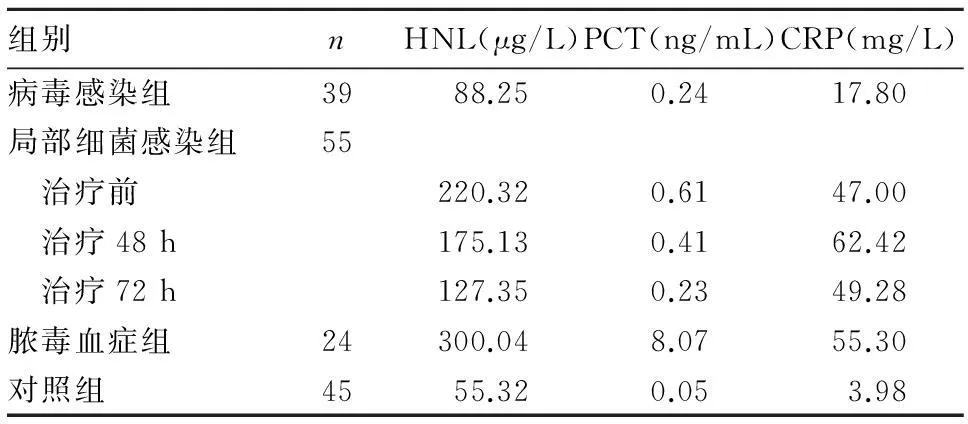
表1 各组血清HNL、PCT、CRP水平比较(M)
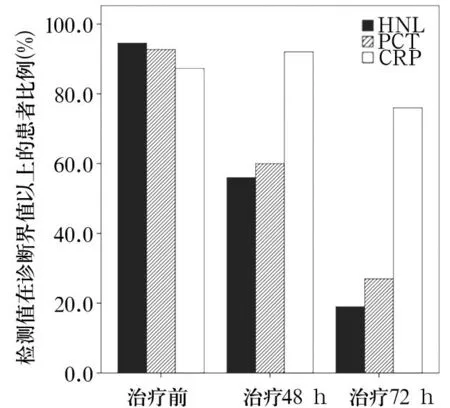
图1 局部细菌感染组治疗前后HNL、
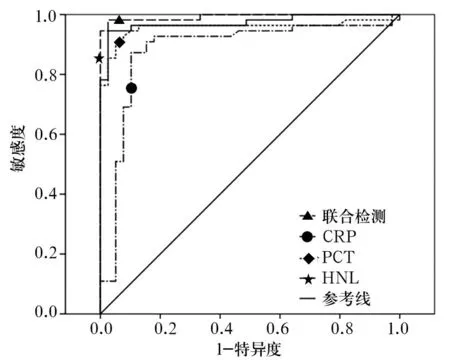
图2 各项指标单独及联合检测诊断细菌
3讨论
研究表明,HNL是中性粒细胞脱颗粒的产物,正常生理状态下,在肾脏、肺、胃、结肠及前列腺等组织中也低表达[6]。当炎症刺激中性粒细胞活化或上皮细胞受到损伤时,HNL大量表达[7]。本研究分别对对照组、病毒感染组和局部细菌感染组治疗前的血清HNL进行检测发现,当机体出现细菌感染时HNL水平显著升高,病毒感染时HNL水平轻度升高,对照组HNL水平不升高,表明HNL可作为急性细菌感染早期诊断和鉴别诊断的指标,与国内外研究[2,3,8]一致。另外,Fjaertoft等[9]认为HNL水平与循环的中性粒细胞绝对值(ANC)存在一定的相关性,血清中有16%~36%的HNL水平变化与ANC变化相关,且HNL较ANC、CRP和PCT检测更能反映细菌感染的进程。在细菌感染组中,脓毒血症患者HNL水平明显高于局部细菌感染患者,两组差异有统计学意义,表明HNL还可以反映细菌感染的严重程度及炎症活动情况。而CRP作为一个炎症指标对于病毒感染与局部细菌感染的鉴别诊断有一定价值,但对于区分脓毒血症和局部细菌感染意义不大。本研究局部细菌感染组和脓毒血症组CRP比较,差异无统计学意义。
Fjaertoft等[10]对HNL和CRP的血流动力学进行研究,结果表明HNL动态变化可反映细菌感染控制情况。本研究经抗生素治疗后,局部细菌感染患者临床症状均有不同程度减轻,同时HNL和PCT水平也相应下降;而多数患者在应用抗菌药物后CRP仍维持较高水平,这与国内学者的研究[8,11]结论一致。肝脏经IL-6刺激后产生CRP的速度很慢,通常需要12~24 h进入外周血,一般在感染性疾病患者急性期症状出现后开始升高,反映的是既往几天的感染。该部分患者会被误认为处于感染持续期而继续抗生素治疗。然而,Fjaertoft等[9]研究发现,机体发生细菌感染后HNL峰值比CRP早1 d出现,HNL在感染后6~8 h即开始升高,24~48 h达到峰值,可反映早期感染,能够及时指导临床医生调整用药方案,避免对已经消除细菌感染的患者进行不必要的治疗。因此,血清HNL的动态监测可对细菌感染患者用药后炎症活动情况作出评价。
临床通常需要初步判断患者的感染类型以及时给予治疗,通过ROC曲线的分析结果可见,对于鉴别细菌感染和病毒感染,HNL的诊断效能与PCT相仿,优于CRP。CRP作为急性时相蛋白,已成为临床上应用广泛的炎症指标,但除细菌感染外,病毒感染、急性排异反应、心血管系统疾病及手术等都可引起CRP升高,早期细菌感染的患者,CRP因受细胞因子的影响使其生成延迟,感染早期水平较低,因此CRP对早期感染敏感性和特异性相对偏低。由于HNL的产生依赖于活化的中性粒细胞,对于药物治疗等原因引起的中性粒细胞减少的患者,PCT和CRP可能更有优势,故本实验同时绘制了三项指标联合检测ROC曲线,结果显示,联合检测时ROC曲线下面积高于三项指标单独检测,同时提高了诊断的敏感度(98.20%)。因此,临床医生可结合患者病程及不同临床症状,同时检测HNL、CRP、PCT,更有助于临床感染患者的准确诊断和治疗。
综上所述,血清HNL水平可以准确反映早期细菌感染及其进程,可为早期诊断、合理用药及疗效评价提供可靠的参考依据。在感染证据确定前,应选择不同诊断指标联合检测,综合评价,为临床提供可靠依据。
参考文献:
[1] Xu SY, Carlson M, Engstrm A, et al. Purification and characterization of a human neutrophil lipocalin(HNL)from the secondary granules of human neutrophils[J]. Scand J Clin Lab Invest, 1994,54(5):365-376.
[2] Venge P, Douhan-Håkansson L, Garwicz D, et al. Human neutrophil lipocalin as a superior diagnostic means to distinguish between acute bacterial and viral infections[J]. Clin Vaccine Immunol, 2015,9(22):1025-1032.
[3] 贾芙蓉,张宇,王超,等.人中性粒细胞载脂蛋白在急性细菌与病毒感染鉴别诊断中的临床意义[J].中国生物制品学杂志,2012,25(1):87-90.
[4] 金宇亭,黄晶,高海翟,等.人中性粒细胞载脂蛋白的临床应用新进展[J].广东医学,2015,36(11): 1778-1781.
[5] Bone RC, Balk RA, Cerra FB,et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine[J]. Chest, 1992,101(6):1644-1655.
[6] Cowland JB, Sørensen OE, Sehested M, et al. Neutrophil gelatinase-associated lipocalin is up-regulated in human epithelial cells by IL-1β, but not by TNF-α[J]. J Immunol, 2003,171(12):6630-6639.
[7] Schmidt-Ott KM, Mori K, Li JY, et al. Dual action of neutrophil gelatinase-associated lipocalin[J]. J Am Soc Nephrol, 2007,189(2):407-413.
[8] 高文静,温国辉.HNL检测在老年急性呼吸道感染患者细菌和病毒感染鉴别诊断中的临床价值[J].国际检验医学杂志,2014,35(9):1105-1106.
[9] Fjaertoft G, Xu S, Venge P, et al. Human neutrophil lipocalin:normal levels and use as a marker for invasive infection in the newborn[J]. Acta Paediatr, 2004,3(4):534-539.
[10] Fjaertoft G, Foucard, XU S, et al. Human neutrophil lipocalin (HNL) as a diagnostic tool in children with acute infections: A study of the kinetics[J]. Acta Paediatrica, 2005,94(6):661-666.
[11] 杨泽平,聂国明,邹敏书.中性粒细胞脂钙素在儿童急性细菌感染中的临床意义[J].临床荟萃,2008,23(20):1491-1493.
(收稿日期:2015-11-23)
中图分类号:R515
文献标志码:B
文章编号:1002-266X(2016)09-0090-03
doi:10.3969/j.issn.1002-266X.2016.09.037
通信作者:黄晶(E-mail:jluhuangjing1@126.com)
