强精固肾汤对热应激雄性大鼠生殖功能的影响
2016-04-18张祁贺之英董佳琦王以东高俊涛
张祁,贺之英,董佳琦,王以东,高俊涛
(吉林医药学院,吉林吉林132013)
强精固肾汤对热应激雄性大鼠生殖功能的影响
张祁,贺之英,董佳琦,王以东,高俊涛
(吉林医药学院,吉林吉林132013)
摘要:目的观察强精固肾汤对热应激雄性大鼠生殖功能的保护作用,并探讨其可能的作用机制。方法 清洁级Wistar大鼠60只,随机均分为正常对照组、模型组、硫酸锌组及强精汤大、中、小剂量组,分别给予生理盐水、生理盐水、硫酸锌及强精固肾汤4 000、2 000、1 000 mg/kg灌胃,连续30 d,除正常对照组外,将其余各组大鼠置于42 ℃高温环境1 h/d,连续14 d。热应激第7、14天进行大鼠性行为能力的观察,包括扑捉潜伏期(CIP)、扑捉次数(CT)、精子相对计数、精子畸形率;检测血清与睾丸组织中超氧化物歧化酶(SOD)和丙二醛(MDA)。结果与模型组比较,热应激第7、14天强精汤大、中剂量组大鼠的CIP缩短、CT增加,精子相对计数增加、精子畸形指数降低,血清和睾丸组织中SOD的活性增强、MDA水平降低(P均<0.05);强精汤大剂量组上述指标与正常对照组比较差异无统计学意义(P均>0.05)。结论 强精固肾汤能够改善热应激雄性大鼠的生殖功能,该作用可能与减轻生殖细胞的氧化损伤有关。
关键词:热应激;强精固肾汤;生殖功能;氧化损伤;大鼠
高温环境对人类生殖功能危害较大,使男性生殖能力下降,甚至导致不孕不育症发病率逐年升高[1]。研究表明,高温引起的热应激与雄性生殖功能密切相关,可导致精子发育异常[2~4]。目前,对热应激引起的雄性生殖功能改变尚缺乏特效的治疗方法。强精固肾汤是本实验室自主研发的组方药,在以往的应用中发现其具有生精强精作用。本研究于2015年4 ~ 10月观察了强精固肾汤对热应激大鼠生殖功能的保护作用,并探讨其作用机制。
1材料与方法
1.1动物及分组清洁级Wistar大鼠120只(由吉林大学动物实验中心提供),雄性,体质量(180±20)g,适应性饲养1周,室温(22±2)℃,相对湿度40%~60%。将大鼠随机分为6个小组,即正常对照组、模型组、硫酸锌组及强精汤大、中、小剂量组各20只。
1.2仪器与试剂 DKB-501S型超级恒温水浴(上海精宏实验设备有限公司),Hitachi 7600生化分析仪(日本Tokyo公司),多通道生理记录仪(美国BiopacMP150);ZMN-7803型全自动组织包埋机(常州市华利电子有限公司),RM2126型轮转式切片机(上海徕卡仪器有限公司),BA300型数码生物显微镜(中国麦克奥迪实业集团有限公司),酶标仪(SUNRISE),TD5A 型台式低速离心机(湖南凯达科学仪器有限公司);超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒(南京建成生物技术研究所)。硫酸锌(神威药业有限公司生产);强精固肾汤,组成:熟地、首乌、枸杞、山萸肉、补骨脂、淫羊藿、锁严子、菟丝子、仙茅、巴戟、肉苁蓉、附子、黄芪等,药物购自吉林国药制药有限责任公司,将上述药物加水煎煮3次,滤汁去渣,合并滤液,加热浓缩成口服液,每毫升含生药0.8 g。
1.3大鼠热应激模型制备硫酸锌组以硫酸锌40 mg/kg灌胃,强精汤大、中、小剂量组大鼠分别以强精固肾汤1 000、2 000、4 000 mg/kg灌胃,正常对照组和模型组大鼠给予等体积生理盐水灌胃,均连续给药30 d。除正常对照组外其余各组均接受热暴露,使用超级恒温水浴,连接有机玻璃夹层水循环舱,保持室温为23.0~24.0 ℃,控制水温,保持热循环舱实测温度为42 ℃,相对湿度40%~60%,风速0~0.2 m/s,稳定1 h以上。将大鼠置于大小合适固定器中,放入热仓,1 h/d,连续14 d。
1.4性行为观察参照Agmo[5]的方法,在安静室内,各组于热应激第7天各取10只大鼠、第14天各取剩余10只大鼠放置于50 cm×35 cm×20 cm干净笼中适应5 min,随后投入同批饲养的正常雌性大鼠形成1对1配对,观察30 min。观察放置雌性大鼠后,雄性大鼠的第1次扑捉时间,即扑捉潜伏期(CIP),同时观察雄性大鼠在30 min内对雌性大鼠的扑捉次数(CT)。
1.5精子相对计数测定于热应激第7、14天,各组分别取10只大鼠处死,取双侧附睾,在盛有2 mL生理盐水(37 ℃)的洁净培养皿中行剥离术,游离附睾中的精子。剥离好的附睾放置37 ℃的恒温箱中孵育15~20 min,取出过滤(4层滤纸)至EP试管。用移液枪取出100 μL精液,加入3%的NaCl 溶液100 μL固定,轻轻混匀后取适量滴加至红细胞计数板中,在显微镜下计数精子数。计数原则:对于压线精子只计数精子头,数上不数下,数左不数右。视精子密度而定,若精子密度高,则取1滴精液涂片即可。涂好的涂片自然风干,待其干燥后,加入适量甲醇固定,待其干燥后,置于2%的伊红染液中染色1 h,染好后取出经细小流水轻轻冲洗,自然干燥后,于显微镜下观察。在低倍显微镜下找到背景清晰精子重叠较少的部位,用高倍显微镜顺序检查精子形态,用红细胞计数板计数1 mL精液中所含的精子数。每只大鼠检查完整的精子500条,计数其中畸形精子的个数,计算畸形指数。
1.6血清及睾丸组织SOD和MDA检测分别于热应激第7、14天大鼠处死前经腹主动脉取血,将血液置于肝素处理过的冰浴试管内,将睾丸组织切碎匀浆,以3 000 g的离心力离心30 min,分别取血清和上清液进行检测,采用ELISA法检测SOD和MDA,严格按照相应试剂盒说明进行操作。

2结果
2.1强精固肾汤对热应激雄性大鼠性行为的影响见表1。
2.2强精固肾汤对热应激雄性大鼠精子的影响见表2。
2.3强精固肾汤对热应激雄性大鼠血清及睾丸组织SOD、MDA水平的影响见表3、4。
3讨论
严重的高温环境,可导致内脏血管收缩、缺血缺氧、内毒素血症、炎性细胞因子过度产生或释放并产生过量的氧自由基,最终导致多器官功能障碍[6,7]。热应激导致微血管内皮细胞损伤,白细胞、血小板及单核巨噬细胞激活,白细胞释放IL-1β、IL-6等一系列炎性因子[8]。雄性生殖系统对温度变化敏感,由于睾丸血管相对缺乏,血流不畅,散热困难,易造成睾丸损伤。研究表明,短时间的热应激可引起雄性大鼠可逆性的睾丸损伤[9]。本研究表明,持续高温环境可引起大鼠精子活力下降、存活率降低、畸形指数升高等。
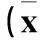
表1 各组热应激第7、14天大鼠CIP、CT比较±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
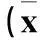
表2 各组热应激第7、14天大鼠精子相对计数、精子畸形指数比较±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
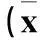
表3 各组热应激第7、14天大鼠血清SOD活性和MDA水平比较±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
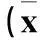
表4 各组热应激第7、14天大鼠睾丸组织SOD活性和MDA水平比较±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。
热应激过程中睾丸和生精细胞产生过氧化物、一氧化氮等[10]。研究表明,活性氧(ROS)在维持男性生殖生理功能如精子发育、细胞信号转导、激素的产生、精子获能、顶体反应以及精子活力等方面发挥重要作用。感染或炎症时ROS水平升高与精子发育、功能和生殖能力障碍有关。当ROS的产生超过生殖系统抗氧化系统的清除能力时,则会对精子产生毒性作用,引起精子膜脂质过氧化,导致其形态、功能及代谢异常,甚或导致雄性不育。男性生育能力障碍归因于环境因素,如接触某些化学物质、重金属、农药、热或电磁辐射、慢性压力、吸烟、酗酒、肥胖、泌尿生殖创伤,男性生殖系统炎症也与男性生育能力下降有关[11,12]。这些因素大部分是氧化应激的结果,导致氧化应激的原因是由于ROS和抗氧化系统失去平衡。过量的ROS引起病理反应导致细胞和组织的损伤。氧化应激影响精子活力,损害DNA结构,加速细胞凋亡,最终导致精子数量减少、运动障碍、形态异常以及功能损害。精子细胞膜含有大量的不饱和脂肪酸,可以发生脂质过氧化反应,而细胞质中只存在少量的能够中和ROS的酶类。脂质氧化过程会导致膜完整性丧失和其渗透率的增加,细胞酶失活,DNA结构损伤和细胞凋亡[13,14]。SOD是细胞中主要的抗氧化酶之一,其在机体清除ROS的过程中起关键作用,SOD、过氧化氢酶也能阻止精子染色质的伤害,显著增加精子运动性。MDA是过氧化脂质的分解产物,是减少精子生产的脂质过氧化作用的最终产物。MDA可作为细胞脂质过氧化反应强度的一个间接指标,通过对MDA的测定可反映体内自由基产生的程度。
《黄帝内经》认为“肾藏精”,主人体的生殖和发育。男性精子发育不良主要为肾精亏损,中医辨证以肾虚为主。强精固肾汤具有补肾助阳、益精血、强筋骨、固精气的作用。现代研究表明,微量元素锌在预防生殖系统氧化损伤,改善生殖功能中作用明显[15]。补肾壮阳药有类激素样作用,含锌量高,对大鼠垂体性腺轴的影响显著,能促进睾丸发育,促进精液分泌和精子质量,对改善睾丸曲细精管及间质细胞的损害均有一定效果。本研究结果表明,热应激可以随时间和强度聚集,导致精子的相对数量减少、畸形指数增加。与模型组比较,强精固肾汤能够提高精子的相对数量,降低精子的畸形指数,提高血清和睾丸组织SOD活性,降低MDA水平,说明强精固肾汤能改善热应激对雄性大鼠生殖系统的损伤,其作用机制可能与减轻生殖细胞的氧化损伤有关。
参考文献:
[1] Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002,346(25):1978-1988.
[2] Kurowicka B, Dietrich GJ, Kotwica G. Effect of neonatal or adult heat acclimation on testicular and epididymal morphometry and sperm production in rats[J]. Reprod Biol, 2015,15(1):1-8.
[3] Wang Y, Jin S, Li N, et al. Systematic study of stress-inducible protein 1 (Stip1) in male reproductive system and its expression during stress response[J]. Gene, 2015,554(1):58-63.
[4] Hou Y, Wang X, Lei Z, et al. Heat-stress-induced metabolic changes and altered male reproductive function[J]. J Proteome Res, 2015,14(3):1495-1503.
[5] Agmo A. Male rat sexual behavior[J]. Brain Res Brain Res Protoc, 1997,1(2):203-209.
[6] Chen SH, Lin MT, Chang CP. Ischemic and oxidative damage to the hypothalamus may be responsible for heatstroke[J]. Curr Neuropharmacol, 2013,11(2):129-140.
[7] Leon LR, Dineen S, Blaha MD, et al. Attenuated thermoregulatory, metabolic, and liver acute phase protein response to heat stroke in TNF receptor knockout mice[J]. Am J Physiol Regul Integr Comp Physiol, 2013,305(12):R1421-R1432.
[8] 李英华,刘淑红,郭素青,等.热射病血液系统损害的临床分析[J].山东医药,2011,51(44):89-90.
[9] Tenorio BM, Ferreira Filho MB, Jimenez GC, et al. Extremely low-frequency magnetic fields can impair spermatogenesis recovery after reversible testicular damage induced by heat[J]. Electromagn Biol Med, 2014,33(2):139-146.
[10] Pino JA, Osses N, Oyarzún D, et al. Differential effects of temperature on reactive oxygen/nitrogen species production in rat pachytene spermatocytes and round spermatids[J]. Reproduction, 2013,145(2):203-212.
[11] Tunc O, Bakos HW, Tremellen K. Impact of body mass index on seminal oxidative stress[J]. Andrologia, 2011,43(2):121-128.
[12] Agarwal A, Sharma RK, Desai NR, et al. Role of oxidative stress in pathogenesis of varicocele and infertility[J].Urology, 2009,73(3):461-469.
[13] Schuppe HC, Meinhardt A, Allam JP, et al. Chronic orchitis: a neglected cause of male infertility[J]. Andrologia, 2008,40(2):84-91.
[14] Fraczek M, Kurpisz M. Mechanisms of the harmful effects of bacterial semen infection on ejaculated human spermatozoa: potential inflammatory markers in semen[J]. Folia Histochem Cytobiol, 2015,53(3):201-217.
[15] Walczak-Jedrzejowska R, Wolski JK, Slowikowska-Hilczer J. The role of oxidative stress and antioxidants in male fertility[J]. Cent European J Urol, 2013,66(1):60-67.
2015年第55卷25期《不明原因复发性自然流产患者CCL17和CCR4水平的变化及意义》一文中的通信作者为谭玉洁。
本刊编辑部
Effect of Qiangjing Gushen decoction on male reproductive function of heat stress rats
ZHANGQi,HEZhiying,DONGJiaqi,WANGYidong,GAOJuntao
(JilinMedicalCollege,Jilin132013,China)
Abstract:ObjectiveTo observe the protective effect of Qiangjin Gushen decoction on the heat stress-induced altered male reproductive function in rats and to investigate its possible mechanism. MethodsSixty male clean degree Wistar rats were randomly divided into the control group, model group, zinc sulfate group, low-dose, medium-dose and high-dose Qiangjing Gushen decoction groups which were orally administered with normal saline, normal saline, zinc sulfate, Qiangjin Gushen decoction 1000 mg/kg, 2000 mg/kg and 4000 mg/kg respectively for 30 d followed by exposure to heat 42℃, 1 h/d for 14 days (except for the control group). Sex ability was observed including the capture incubation period (CIP) and the capture time (CT). On the 7th and 14th of heat stress, we detected the number of sperm count and sperm deformity rate. Meanwhile, the superoxide dismutase (SOD) and malondialdehyde (MDA) in the serum and testicular tissues were detected. Results Compared with the model group, on the 7th and 14th of heat stress, CIP of rats was shortened, CT was increased, the number of sperm count was increased and sperm deformity rate was decreased, the activity of SOD in the serum and testicular tissues was increased and the level of MDA in the serum and testicular tissues was decreased in the medium-dose and high-dose Qiangjing Gushen decoction groups (all P<0.05). All the above indexes had no significant statistical difference between the control group and the high-dose Qiangjing Gushen decoction group (all P>0.05). ConclusionQiangjing Gushen decoction can improve the male reproductive function of heat stress rats, and its mechanism may be related to the reduced oxidative damage of germ cells.
Key words:heat stress; Qiangjing Gushen decoction; reproductive function; oxidative damage; rats
(收稿日期:2015-11-04)
中图分类号:R285.5;R691.6
文献标志码:A
文章编号:1002-266X(2016)09-0016-04
doi:10.3969/j.issn.1002-266X.2016.09.006
通信作者简介:高俊涛(1976-),男,副教授,博士,主要研究方向为神经生理学、热损伤与防治。E-mail:15948628662@163.com
作者简介:第一张祁(1996-),男,本科,主要研究方向为热损伤及其防治。E-mail:15143223805@163.com
基金项目:国家自然科学基金资助项目(31071042);吉林省大学生创新创业训练计划项目(2015022)。
