肺癌肿瘤抑制因子1对膀胱癌裸鼠移植瘤的抑制作用及机制
2016-04-18王尚任陈业刚杨永姣刘莉刘晓强陈少峰孙光
王尚任,陈业刚,杨永姣,刘莉,刘晓强,陈少峰,孙光
(1天津医科大学第二医院,天津300211;2天津市泌尿外科研究所)
肺癌肿瘤抑制因子1对膀胱癌裸鼠移植瘤的抑制作用及机制
王尚任1,陈业刚1,杨永姣1,刘莉2,刘晓强1,陈少峰1,孙光1
(1天津医科大学第二医院,天津300211;2天津市泌尿外科研究所)
摘要:目的观察肺癌肿瘤抑制因子1(TSLC1)对膀胱癌裸鼠移植瘤的抑制作用,并探讨其作用机制。方法 将TSLC1过表达人膀胱癌T24细胞株(Ad-TSLC1-T24组)、空载体对照T24细胞株(Ad-T24组)及空白对照T24细胞株(T24组)种植于裸鼠皮下,绘制肿瘤生长曲线,种植细胞5周处死全部裸鼠留取肿瘤组织标本,测量肿瘤体积,称量瘤重,计算抑瘤率,光镜观察移植瘤组织病理变化,RT-PCR法检测移植瘤组织中TSLC1、B淋巴细胞瘤-2基因(Bcl-2)、半胱氨酸天冬氨酸蛋白水解酶3(Caspase-3)mRNA表达,Western blotting法检测移植瘤组织中TSLC1、Bcl-2、Caspase-3蛋白表达。结果肿瘤生长曲线显示Ad-TSLC1-T24组移植瘤生长明显慢于Ad-T24组及T24组,种植细胞5周Ad-TSLC1-T24组肿瘤体积及质量低于Ad-T24组及T24组(P均<0.05),抑瘤率高于Ad-T24组(P<0.05)。HE染色结果显示,Ad-TSLC1-T24组移植瘤细胞出现明显的核固缩、核碎裂等凋亡现象。与Ad-T24组、T24组比较,Ad-TSLC1-T24组移植瘤中TSLC1、Caspase-3 mRNA及蛋白相对表达量增加,Bcl-2 mRNA及蛋白相对表达量降低(P均<0.05)。结论 TSLC1过表达可抑制膀胱癌裸鼠移植瘤生长,其机制可能与上调Caspase-3表达和下调Bcl-2表达促进了肿瘤细胞凋亡有关。
关键词:膀胱肿瘤;肺癌肿瘤抑制因子1;移植瘤;B淋巴细胞瘤-2基因;半胱氨酸天冬氨酸蛋白水解酶3
肺癌肿瘤抑制因子1(TSLC1)是一种抑癌基因,是细胞黏附分子中免疫球蛋白超家族成员。TSLC1表达缺失与多种恶性肿瘤的发生发展及预后密切相关。我们的前期研究也发现,TSLC1表达的异常与膀胱癌的发生发展及预后存在密切关系。2014年11月~2015年1月本研究将过表达TSLC1基因的T24膀胱癌细胞系种植于裸鼠皮下,观察TSLC1在体内环境下对膀胱癌移植瘤生长的影响,探讨其作用机制。
1材料与方法
1.1材料人膀胱癌慢病毒介导的TSLC1过表达T24细胞株(Ad-TSLC1-T24)及空载体对照T24细胞株(Ad-T24)由上海汉恒生物公司构建。BALB/c雌性裸鼠18只(体质量15~20 g、5周龄)购买于中国食品药品检定研究所,所有动物饲养于中国医学科学院生物工程医学研究所。总RNA提取试剂盒、cDNA反转录试剂盒、RT-PCR试剂盒均购自美国GeneCopoeia公司。PCR引物由上海生工生物工程技术服务有限公司合成。鼠抗人TSLC1单克隆抗体、鼠抗人Bcl-2单克隆抗体及鼠抗人半胱氨酸天冬氨酸蛋白水解酶3(Caspase-3)单克隆抗体购自美国Abnova公司,二抗羊抗鼠IgG抗体、GAPDH内参抗体及BCA蛋白测定试剂盒购自中国康为世纪公司。
1.2细胞培养及动物模型建立将Ad-TSLC1-T24、Ad-T24、空白对照T24培养于含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2恒温培养箱下培养传代。取对数生长期的细胞,PBS洗涤后,调整细胞浓度至1×107/mL,用于接种裸鼠。18只裸鼠随机分为3组,每组6只,分别接种Ad-TSLC1-T24(Ad-TSLC1-T24组)、Ad-T24(Ad-T24组)、T24(T24组),各自取0.2 mL细胞悬液接种于裸鼠前肢肩胛部皮下。
1.3膀胱癌移植瘤生长情况观察肿瘤形成后每隔5天使用游标卡尺测量肿瘤长径与短径,记录数据并计算肿瘤体积,绘制肿瘤生长曲线。接种细胞5周,采用脱颈法处死全部裸鼠,迅速完整剥离肿瘤,测量肿瘤体积,并利用微量天枰称量瘤重,计算抑瘤率,抑瘤率(%)=(空白组肿瘤质量-实验组肿瘤质量)/空白组肿瘤质量×100%。
1.4移植瘤病理变化观察取各组部分移植瘤标本,使用10%甲醛固定,石蜡包埋后切片,制成5 μm切片,再经烤片、脱蜡、HE染色、脱水、封片等操作后完成病理制片,在光学显微镜下观察各组移植瘤病理改变。
1.5移植瘤组织TSLC1、Bcl-2及Caspase-3 mRNA表达检测采用RT-PCR法。取各组部分移植瘤标本,严格按照总RNA提取试剂盒、cDNA反转录试剂盒说明提取总RNA,进行反转录。RT-PCR反应采用10 μL体系,以管家基因GAPDH为标准化样品,严格按照RT-PCR试剂盒说明书进行操作,TSLC1上游引物为5′-CCCCAGCCTGTGATGGTA-3′、下游引物为5′-GGATAGTTGTGGGGGGATCGT-3′,Bcl-2上游引物为5′-GTATGATAACCGGGAGATCG-3′、下游引物为5′-AGCCAGGAGAAATCAAACAG-3′,Caspase-3上游引物为5′-CTGGACTGCGGTATTGAGAC-3′、下游引物为5′-CCGGGTGCGGTAGAGTAAGC-3′,GAPDH上游引物为5′-CGGAGTCAACGGATTTGGTCGTAT-3′、下游引物为5′-AGCCTTCTCC ATGGTGGTGAAGAC-3′,实验结果以Ct值表示,每组标本重复检测3次,待测样品目的基因的相对表达量为2-ΔΔCt。ΔCt=待测样品目的基因Ct值-待测样品GAPDH Ct值。
1.6移植瘤组织TSLC1、Bcl-2及Caspase-3蛋白表达检测采用Western blotting法。取各组移植瘤组织,在冰上裂解匀浆,4 ℃离心,提取总蛋白,采用BCA法测定蛋白浓度后将各组蛋白浓度调至同一水平,配制分离胶及浓缩胶,蛋白加热变性后每孔加入40 μg进行电泳,电泳后湿转至硝酸纤维素膜上,5%脱脂牛奶封闭过夜,室温孵育一抗(1∶1 000)2 h,洗膜,室温孵育二抗(1∶5 000)1.5 h,洗膜,以GAPDH作为内参,用新鲜配制的ECL发光液均匀覆盖于膜上,反应5 min,凝胶成像分析系统下显影、定影。使用Image-Pro Plus 5.0软件分析蛋白表达的灰度值,与内参基因比较计算蛋白相对表达量。
2结果
2.1TSLC1对人膀胱移植瘤生长的影响3组抑制瘤体积生长曲线见图1,Ad-TSLC1-T24组移植瘤生长速度明显慢于Ad-T24组、T24组,Ad-T24组、T24组肿瘤生长速度比较差异不明显。接种细胞5周,T24、Ad-TSLC1-T24、Ad-T24组肿瘤体积分别为(1 851±405)、(985±264)、(1 687±326)mm3,肿瘤质量分别为(2.1±0.9)、(1.1±0.4)、(1.8±0.5)g;Ad-TSLC1-T24组肿瘤体积、质量均低于T24、Ad-T24组,P均<0.05;T24组与Ad-T24组肿瘤体积、质量比较,P均>0.05。Ad-TSLC1-T24组抑瘤率为47.6%,Ad-T24组抑瘤率为14%,两组比较,P<0.05。
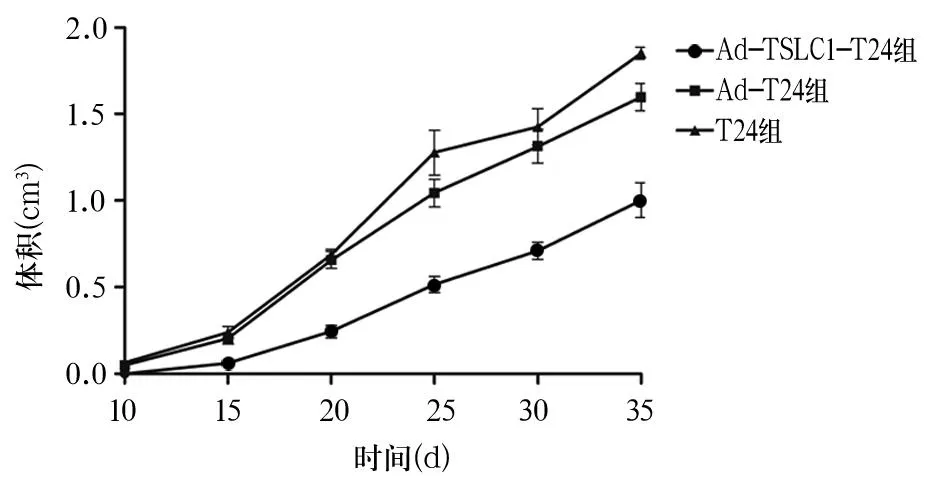
图1 3组移植瘤体积生长曲线
2.2各组移植瘤病理改变Ad-TSLC1-T24组移植瘤细胞生长较差,细胞大小不一,形态不整,细胞核出现核固缩及核碎裂等凋亡表现,T24组及Ad-T24组移植瘤细胞生长较好。
2.3各组裸鼠移植瘤组织中TSLC1、Bcl-2、Caspase-3 mRNA表达比较见表1。
表1 各组移植瘤组织中TSLC1、Bcl-2及Caspase-3
注:与Ad-TSLC1-T24组比较,*P<0.05。
2.4各组裸鼠移植瘤组织中TSLC1、Bcl-2、Caspase-3蛋白表达比较见表2。
表2 各组移植瘤组织中TSLC1、Bcl-2及Caspase-3 蛋白的
注:与Ad-TSLC1-T24组比较,*P<0.05。
3讨论
膀胱癌是泌尿外科临床常见的肿瘤之一,其发生发展是一个多因素、多步骤、多阶段、多环节的病理变化过程,在非肌层浸润性膀胱癌中有55%~60%的患者在治疗后复发或进展,严重影响患者预后,是膀胱癌临床治疗中面临的主要难题[1,2]。因此,对膀胱癌的发病机制进行深入研究,寻找能够用于膀胱癌早期诊断、复发监测或治疗的肿瘤分子标志物仍是目前研究的重点之一。
TSLC1是Gomyo等在1999年分析人染色体11q23.2区域发现的一种肿瘤抑制基因。TSLC1属于免疫球蛋白超家族,可转录4.4 kb或1.6 kb的前体mRNA,翻译成442个氨基酸组成的跨膜蛋白。TSLC1蛋白胞外区含有373个氨基酸,并由二硫键连接形成3个免疫球蛋白C2型结构域,跨膜区为一疏水性的α螺旋结构域,胞质区羧基端为PDZ和FERM结合模体,TSLC1通过PDZ模体与MPP3蛋白相互作用、通过FERM结合模体与DAL-1/4.1B蛋白发生作用,激活下游信号通路,参与细胞间黏附、细胞运动、免疫调节、信号转导等多种生物学效应[3~5]。TSLC1的失活或异常表达与多种肿瘤的发生发展密切相关[6~8],TSLC1通过抑制肿瘤细胞增殖和促进肿瘤细胞凋亡起到抑癌作用,并可介导细胞间黏附、改变肿瘤细胞生长特性、抑制上皮间转化,在抑制上皮来源的恶性肿瘤中起重要作用[9,10]。本课题组前期研究也发现,TSLC1基因在膀胱癌组织中低表达,并与膀胱癌的分级分期及侵袭能力密切相关[2],并证实TSLC1启动子甲基化与TSLC1的失活关系密切[11]。目前,TSLC1对膀胱癌细胞的抑制作用及机制尚不清楚。本研究结果显示,TSLC1过表达可明显抑制肿瘤的生长,TSLC1过表达组膀胱癌移植瘤体积和质量明显低于其他两组,抑瘤率为47.6%;光镜观察显示肿瘤细胞的增殖受到限制,并出现核固缩、核碎裂等细胞凋亡表现。说明TSLC1的过表达可引起膀胱癌肿瘤细胞凋亡,抑制肿瘤生长。
细胞凋亡受多种基因的调控,与Caspases家族和Bcl-2家族密切相关, Caspases-3在细胞凋亡通路中处于中心环节,其活化后能特异性切割蛋白底物的氨基酸序列,破坏细胞结构,导致细胞凋亡[5,8]。研究发现,Caspase-3参与了肿瘤细胞发生发展过程中细胞凋亡异常的变化[12]。Bcl-2是一种癌基因,具有阻断细胞凋亡的作用,Bcl-2的过度表达与肿瘤的发生发展关系密切,可使DNA受损的细胞持续生存,促进肿瘤的发生发展[13,14]。目前认为Bcl-2可作用于Caspase-3的上游通路,从而抑制Caspase-3作用的发挥[12,15]。本研究通过过表达TSLC1基因的T24细胞系构建裸鼠移植瘤模型,并利用RT-PCR和Western blotting法检测裸鼠移植瘤中Caspase-3、Bcl-2 mRNA及蛋白表达的变化,探究TSLC1促进肿瘤细胞凋亡的机制,结果显示,TSLC1过表达的同时伴随着Bcl-2表达量的降低及Caspase-3表达量的升高,因此我们推断,TSLC1过表达可以下调Bcl-2表达并上调Caspase-3表达,从而促进了膀胱癌细胞的凋亡,抑制了膀胱癌移植瘤生长。然而,TSLC1发挥抑癌作用的具体机制及其分子通路尚需进一步研究。
参考文献:
[1] van Roekel EH, Cheng KK, James ND, et al. Smoking is associated with lower age, higher grade, higher stage, and larger size of malignant bladder tumors at diagnosis[J]. Int J Cancer, 2013,133(2):446-454.
[2] Kiriluk KJ, Prasad SM, Patel AR, et al. Bladder cancer risk from occupational and environmental exposures[J]. Urol Oncol, 2012,30(2):199-211.
[3] You Y, Zhang J, Li Y, et al. CADM1/TSLC1 inhibits melanoma cell line A375 invasion through the suppression of matrix metalloproteinases[J]. Mol Med Rep, 2014,10(5):2621-2626.
[4] Pujari R, Hunte R, Thomas R, et al. Human T-cell leukemia virus type 1 (HTLV-1) tax requires CADM1/TSLC1 for inactivation of the NF-κB inhibitor A20 and constitutive NF-κB signaling[J]. PLoS Pathog, 2015,11(3):e1004721.
[5] Liu D, Feng X, Wu X, et al. Tumor suppressor in lung cancer 1 (TSLC1), a novel tumor suppressor gene, is implicated in the regulation of proliferation, invasion, cell cycle, apoptosis, and tumorigenicity in cutaneous squamous cell carcinoma[J]. Tumour Biol, 2013,34(6):3773-3783.
[6] 林称意,原野,罗卫民,等.TSLC1和CD105在食管癌组织中表达的临床意义[J].实用癌症杂志,2014,29(3):263-265,271.
[7] 朱冰,陈翔,马景华,等.TSLC1在食管鳞癌中的表达及临床意义[J].现代肿瘤医学,2012,20(4):746-749.
[8] Lu B, Di W, Wang H, et al. Tumor suppressor TSLC1 is implicated in cell proliferation, invasion and apoptosis in laryngeal squamous cell carcinoma by regulating Akt signaling pathway[J]. Tumour Biol, 2012,33(6):2007-2017.
[9] Lei W, Liu HB, Wang SB, et al. Tumor suppressor in lung cancer-1 (TSLC1) mediated by dual-regulated oncolytic adenovirus exerts specific antitumor actions in a mouse model[J]. Acta Pharmacol Sin, 2013,34(4):531-540.
[10] 李鸿文,彭云滔,于兰,等.RCCC组织中肺癌肿瘤抑制因子1的表达变化及意义[J].山东医药,2011,51(46):9-10.
[11] 杨永姣,刘莉,陈业刚,等.膀胱癌组织中肺癌肿瘤抑制物1基因启动子甲基化状态和蛋白表达及其临床意义[J].中国现代医学杂志,2015,25(23):35-39.
[12] Hu Q, Peng J, Liu W, et al. Elevated cleaved caspase-3 is associated with shortened overall survival in several cancer types[J]. Int J Clin Exp Pathol, 2014,7(8):5057-5070.
[13] 胡映秋,鲁雄兵,李里香,等.膀胱移行细胞癌组织中NF-κB p65、uPA、Bcl-2的表达变化及其意义[J].山东医药,2011,51(46):11-13.
[14] Luanpitpong S, Chanvorachote P, Stehlik C, et al. Regulation of apoptosis by Bcl-2 cysteine oxidation in human lung epithelial cells[J]. Mol Biol Cell, 2013,24(6):858-869.
[15] 黄海英,陈尚明,赵建美.新生大鼠缺血缺氧性脑损伤组织中 HAX-1、Caspase-3、bcl-2表达变化及意义[J].山东医药,2015,55(30):30-31.
(收稿日期:2015-10-22)
中图分类号:R737.14
文献标志码:A
文章编号:1002-266X(2016)09-0034-03
doi:10.3969/j.issn.1002-266X.2016.09.012
通信作者:刘晓强(E-mail:xiaoqiangliu1@163.com)
基金项目:天津市科委自然科学基金重点项目(12JCZDJC23700)。
