Th22细胞在卵巢癌恶性腹水中募集的机制
2016-04-18卢威顺覃山羽姜海行谭式辉杨显文罗薇卢东红
卢威顺,覃山羽,姜海行,谭式辉,杨显文,罗薇,卢东红
(广西医科大学第一附属医院,南宁530021)
Th22细胞在卵巢癌恶性腹水中募集的机制
卢威顺,覃山羽,姜海行,谭式辉,杨显文,罗薇,卢东红
(广西医科大学第一附属医院,南宁530021)
摘要:目的观察Tp2细胞在卵巢癌恶性腹水(MA)中的分布情况,探讨其向腹腔内募集的可能机制。方法 选择卵巢癌合并MA患者23例(观察组)、健康女性13例(对照组),用密度梯度离心法获得MA和外周血中单个核细胞,流式细胞仪检测MA和外周血中Tp2、Th17细胞构成比及Tp2细胞趋化因子表达水平,ELISA法检测腹水上清液和外周血中IL-17、IL-22的水平,用Spearman秩相关分析变量间关系。结果观察组MA中Tp2、Th17细胞构成比高于同组外周血和对照组外周血(P均<0.05);观察组MA中CCR4、CCR7、CD45RO型Tp2细胞构成比高于外周血,CD45RA、CD62L型低于外周血(P均<0.05);MA中IL-17、IL-22水平高于同组外周血及对照组外周血(P均<0.05);经Spearman秩相关分析,MA中Tp2细胞与Th17细胞构成比呈正相关(r=0.66,P<0.01),IL-22水平与Tp2细胞、Th17细胞构成比呈正相关(r分别为0.55、0.54,P均<0.05)。结论 Tp2细胞可能通过趋化因子与炎症细胞因子由外周血向卵巢癌MA中募集。
关键词:卵巢肿瘤;恶性腹水;辅助T细胞22;细胞分化;细胞募集
晚期卵巢癌患者常伴恶性腹水(MA),MA中含有大量淋巴细胞,是研究肿瘤免疫微环境的理想模型。辅助T细胞22(Tp2)表达趋化因子受体(CCR)6、CCR10和CCR4[1],主要产生白细胞介素(IL)22来发挥其免疫效用,是一个独立的细胞亚群。初始CD4+T细胞经IL-6和肿瘤坏死因子(TNF)诱导向Tp2细胞分化,而转化生长因子(TGF)β抑制Tp2的分化[2]。Tp2细胞在皮肤的自稳调节和病理状态、自身免疫性疾病、感染性疾病和肿瘤免疫中发挥重要作用。关于卵巢癌MA中Tp2细胞的研究尚未见报道。本研究旨在观察卵巢癌MA中Tp2细胞的分布情况,探讨Tp2细胞在腹腔内募集的可能机制。
1资料与方法
1.1临床资料选择2015年3月~2015年11月本院确诊为卵巢癌合并MA的患者23例作为观察组,均通过腹腔积液穿刺寻找恶性细胞和(或)腹腔镜取腹膜活检样本确定卵巢癌合并MA,均未接受抗肿瘤治疗,未使用糖皮质激素和甾体类抗炎药。患者年龄46~72岁,肿瘤临床分期:Ⅱ期8例、Ⅲ期11例、Ⅳ期4例,肿瘤病理类型:透明细胞癌3例、黏液性腺癌8例、浆液性腺癌12例。同期,选择健康女性13例作为对照组,均经检查排除卵巢疾病,年龄38~69岁。两组年龄比较差异无统计学意义。本研究通过本院伦理委员会批准,受试者均签署知情同意书。
1.2MA和外周血中Tp2细胞及其表型检测采用流式细胞术。观察组入院24 h内,使用标准腹腔穿刺术取得腹腔积液600 mL,并同时抽取空腹静脉血10 mL;对照组于查体日晨抽取空腹静脉血10 mL。离心(1 600 r/min,15 min)提取腹水上清液和外周血血清冻存于-80 ℃。HBSS重悬浮MA和外周血中的细胞,用密度梯度离心法获得单个核细胞。将分离的细胞重悬于含10%胎牛血清的RPMI 1640培养基,加入豆蔻酰佛波醇乙酯(PMA)(终浓度50 ng/mL)5 μL、离子霉素(终浓度1 μg/mL) 20 μL、莫能霉素(终浓度0.7 μg/mL)1 μL,在37 ℃、5% CO2条件下孵育刺激T细胞5 h。随后用抗CD4、抗CCR4、抗CCR6、抗CCR7、抗CCR10、抗CD45RO、抗CD45RA、抗CD62L单克隆抗体对细胞膜表面染色标记,置于室温孵育30 min,使用破膜剂破膜,加入抗IL-22、抗IL-17和IFN-γ单克隆抗体进行细胞内染色,4 ℃孵育30 min。并做同型对照组以确定抗体特异性及荧光补偿。单克隆抗体分别为PerCP-cy5.5、PE、FITC、APC、AF647、AF488等用荧光标记。在12 h内使用流式细胞仪检测Tp2、Th17细胞构成比和Tp2细胞表型,使用FCS ExpressV3软件分析数据。
1.3MA和外周血中IL-22、IL-17水平检测采用ELISA试剂盒检测MA和外周血中IL-17、IL-22,按照试剂盒说明进行操作。采用CurveExpert1.4软件绘制标准曲线,计算血清IL-22、IL-17水平。

2结果
2.1两组Th17、Tp2细胞构成比比较观察组MA中Tp2、Th17细胞构成比高于同组外周血和对照组外周血(P均<0.05),见表1。
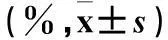
表1 两组Th17、Tp2细胞构成比比较
注:与对照组比较,*P<0.05;与同组外周血比较,#P<0.05。
2.2观察组MA、外周血Tp2细胞趋化因子表达水平比较MA中Tp2细胞中CCR4、CCR7、CD45RO表达水平高于外周血,CD45RA、CD62L表达水平低于外周血(P均<0.05),见表2。
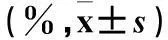
表2 观察组MA、外周血不同表型Tp2细胞构成比比较
注:与外周血比较,*P<0.05。2.3两组IL-17、IL-22水平比较观察组MA中IL-17、IL-22水平高于同组外周血及对照组外周血(P均<0.05),见表3。
2.4观察组MA中Tp2细胞、 IL-22与Th17细胞、Tp2细胞的相关性经Spearman秩相关分析,MA中Tp2细胞与Th17细胞构成比呈正相关(rs=0.66,P<0.01),IL-22水平与Tp2细胞、Th17细胞构成比呈正相关(rs分别为0.55、0.54,P均<0.05)。

表3 两组IL-17、IL-22水平变化
注:与对照组比较,*P<0.05;与同组外周血比较,#P<0.05。
3讨论
卵巢癌患者淋巴管易被癌细胞阻塞,且肿瘤细胞转移至腹腔及大网膜对其产生刺激作用,导致血浆蛋白渗漏和液体积聚形成MA。卵巢癌腹腔微环境内CD4+CD25+Treg具有免疫抑制功能,该功能与卵巢癌分期及复发相关[3]。卵巢癌晚期,肿瘤部位和腹水中有大量CD4+CD25+Treg细胞聚集,其作用机制与抑制性细胞因子TGF-β1和IL-10的分泌有关[4]。初始CD4+T细胞在IL-6 和TNF作用下向Tp2 细胞分化,目前,关于Tp2细胞在卵巢癌MA中的表达情况和募集机制国内外尚未见报道。
本研究结果显示,卵巢癌患者MA中Tp2细胞和Th17细胞构成比明显高于同组外周血和对照组外周血,所以MA微环境可能促进Tp2细胞的分化。初始Th细胞在TGF-β和IL-6的刺激下可分化成为Th17细胞,分泌IL-17和IL-22。Ye等[5]证实,Th17细胞在抗肿瘤免疫中具有保护作用, 且能促进肿瘤特异性细胞毒性T细胞的免疫应答。本研究发现,MA中Th17细胞构成比和IL-17水平明显高于同组外周血和对照组外周血,提示Th17细胞和IL-17在卵巢癌肿瘤微环境中很可能发挥免疫效应。而MA中Tp2细胞与Th17细胞构成比、IL-22水平呈正相关,因此Tp2细胞的分化机制可能与Th17相近。Tp2细胞与卵巢癌的发生发展有密切关系。IL-22是Tp2细胞的主要生物效应因子[6]。在肿瘤免疫方面,IL-22自身并不促进肿瘤形成,然而其通过上调下游基因Bcl-2、Bcl-XL、CyclinD1和血管内皮细胞生长因子促进肿瘤的生长和转移[7]。IL-22既能保护肝脏,另一方面也能使肝细胞增殖能力增强,使得肝癌易感性增加[8],在进展期原发性肝癌中IL-22表达水平明显高于早期。胃癌组织中Tp2细胞也表现出类似情况,且与胃癌进展和患者生存率相关[9]。本研究结果显示,IL-22在卵巢癌患者MA和外周血中浓度均高于健康对照组,提示IL-22在卵巢癌的发生发展过程中可能发挥同样的作用。
有研究表明,恶性胸腔积液中趋化因子CCL20、CCL22 和CCL27水平较高,而这3种趋化因子的受体CCR4、CCR6、CCR10在恶性胸腔积液患者体内的Tp2细胞上高表达[10]。本研究结果表明,卵巢癌患者MA中Tp2细胞同样高表达CCR4、CCR6、CCR10,因此可能是MA微环境中的趋化因子将Tp2细胞从外周血募集到腹腔积液内,使卵巢癌MA中Tp2细胞构成比明显高于同源外周血和对照组外周血。不表达CCR7的CD45RA-T细胞呈现效应T细胞的特征,可向感染灶迁徙;表达CCR7的CD45RA-T细胞在接触抗原后具有淋巴结归巢能力,即具有中央记忆性细胞特点。本研究结果表明,在外周血Tp2细胞中CCR7表达低于MA,因此Tp2细胞由外周血向腹腔募集;MA中Tp2细胞低表达CD62L和CD45RA,高表达CD45RO,显示中央记忆性细胞的特点。
综上所述,卵巢癌MA中的趋化因子与炎症细胞因子可能促进Tp2和Th17细胞由外周血向腹腔内迁移,Tp2细胞可能参与卵巢癌MA的发病过程并发挥一定的免疫调节作用。
参考文献:
[1] Duhen T, Geiger R, Jarrossay D, et al. Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells[J]. Nat Immunol, 2009,10(8):857-863.
[2] Eyerich S, Eyerich K, Pennino D, et al. Tp2 cells represent a distinct human T cell subset involved in epidermal immunity and remodeling[J]. J Clin Invest, 2009,119(12):3573.
[3] Wolf D, Wolf AM, Rumpold H, et al. The expression of the regulatory T cell-specific forkhead box transcription factor FoxP3 is associated with poor prognosis in ovarian cancer[J]. Clin Cancer Res, 2005,11(23):8326-8331.
[4] 姚海荣,田菁,李迎春,等.卵巢癌腹水 CD4+CD25+调节性T细胞免疫抑制功能及机制的研究[J].中国肿瘤临床,2014,41(9):560-565.
[5] Ye ZJ, Zhou Q, Gu YY, et al. Generation and differentiation of IL-17-producing CD4+T cells in malignant pleural effusion[J]. J Immunol, 2010,185(10):6348-6354.
[6] Zhang N, Pan HF, Ye DQ. Tp2 in inflammatory and autoimmune disease: prospects for therapeutic intervention[J]. Mol Cell Biochem, 2011,353(1-2):41-46.
[7] Jiang R, Tan Z, Deng L, et al. Interleukin-22 promotes human hepatocellular carcinoma by activation of STAT3[J]. Hepatology, 2011,54(3):900-909.
[8] Wang Z, Yang L, Jiang Y, et al. High fat diet induces formation of spontaneous liposarcoma in mouse adipose tissue with overexpression of interleukin 22[J]. PLoS One, 2011,6(8):e23737.
[9] Zhuang Y, Peng LS, Zhao YL, et al. Increased intratumoral IL-22-producing CD4+T cells and Tp2 cells correlate with gastric cancer progression and predict poor patient survival[J]. Cancer Immunol Immunother, 2012, 61(11):1965-1975.
[10] Ye ZJ, Zhou Q, Yin W, et al. Interleukin 22-producing CD4+T cells in malignant pleural effusion[J]. Cancer Lett, 2012,326(1):23-32.
Recruitment mechanism of Tp2 cells in malignant ascites of ovarian cancer
LUWeishun,QINShanyu,JIANGHaixing,TANShihui,YANGXianwen,LUOWei,LUDonghong
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Abstract:ObjectiveTo observe the distribution of Tp2 cells in malignant ascites (MA) of ovarian cancer and to investigate its recruitment mechanism in the abdominal cavity. MethodsTwenty-three cases of ovarian cancer patients with MA (observation group ) and 13 healthy women (control group) were selected. Density gradient centrifugation was used to collect the mononuclear cells from MA and peripheral blood. The proportion of Th17 and Tp2 cells from MA and peripheral blood, and the expression of chemokines in Tp2 cells were detected by flow cytometry. The levels of IL-17 and IL-22 in MA and supernatant were examined by ELISA, and the correlations between Tp2 cells and Th17 cells were determined by Spearman's rank correlation coefficients. ResultsThe proportion of Tp2 and Th17 cells in MA was significantly higher than that in peripheral blood from the observation group and control group (all P<0.05). In the observation group, the proportions of Tp2 cells in MA with CCR4, CCR7 and CD45RO were higher and the proportions of Tp2 cells in MA with CD45RA and CD62L were lower than those in the peripheral blood (all P<0.05). The levels of IL-17 and IL-22 in MA were higher than those from the peripheral blood in the observation group and control group (all P<0.05). Spearman's rank correlation coefficients showed that the proportion of Tp2 cells was positively correlated with the proportion of Th17 cells in MA (r=0.66, P<0.01), the level of IL-22 had a positive correlation with the proportion of Tp2 cells and Th17 cells in MA (r=0.55, 0.54; all P<0.05). ConclusionsTp2 cells may be recruited from peripheral blood to MA of ovarian cancer by chemokines and cytokines.
Key words:ovarian neoplasms; malignant ascites; helper T cells 22; cell differentiation; cell recruitment
(收稿日期:2015-12-04)
中图分类号:R737.31
文献标志码:A
文章编号:1002-266X(2016)09-0007-03
doi:10.3969/j.issn.1002-266X.2016.09.003
通信作者简介:覃山羽(1973-),女,教授,博士,主要研究方向为Th9在恶性腹腔积液中的作用机制。E-mail: qsy0511@163.com
作者简介:第一卢威顺(1987-),男,硕士,主要研究方向为Tp2细胞及其免疫微环境对恶性腹水的影响机制。E-mail:xw189@126.com
基金项目:国家自然科学基金资助项目(81260083;31360221)
