FRY蛋白在不同恶性程度乳腺肿瘤中的表达与意义*
2016-04-18费帆张辰子赵进明陈华军李海南杨林任雪峰卫秦芝唐小江南方医科大学公共卫生与热带医学学院广东广州5055广东省医学实验动物中心广东佛山588中山大学附属第六医院广东广州50655广东省韶关市第一人民医院广东韶关5000
费帆,张辰子,赵进明,陈华军,李海南,杨林,任雪峰,卫秦芝,唐小江(.南方医科大学公共卫生与热带医学学院,广东广州5055;.广东省医学实验动物中心,广东佛山588;.中山大学附属第六医院,广东广州50655;.广东省韶关市第一人民医院,广东韶关5000)
FRY蛋白在不同恶性程度乳腺肿瘤中的表达与意义*
费帆1,张辰子2,赵进明3,陈华军4,李海南4,杨林2,任雪峰2,卫秦芝1,唐小江2
(1.南方医科大学公共卫生与热带医学学院,广东广州510515;2.广东省医学实验动物中心,广东佛山528248;3.中山大学附属第六医院,广东广州510655;4.广东省韶关市第一人民医院,广东韶关512000)
摘要:目的研究不同恶性程度的乳腺肿瘤病例中FRY蛋白的表达情况及其与临床病理参数之间的关系。方法对收集的104例乳腺肿瘤病例(其中纤维囊性乳腺病11例,不同分级的乳腺浸润性导管癌93例)中FRY蛋白的表达情况进行免疫组织化学检测,比较FRY蛋白表达情况与乳腺肿瘤恶性程度及不同临床病理参数之间的关系。结果11例纤维囊性乳腺病与93例乳腺浸润性导管癌病例中FRY蛋白表达阳性率分别为90.9%和54.8%,差异有统计学意义(P<0.05);93例乳腺癌病例中,FRY蛋白在乳腺癌不同组织分级、不同TNM分期、肿瘤直径大小、PR水平间的表达均有显著性差异(P<0.05)。结论FRY蛋白的表达与乳腺肿瘤的恶性程度相关,恶性程度越高,FRY蛋白表达越少,同时FRY蛋白的表达与体内激素受体水平也存在一定联系。
关键词:FRY;抑癌蛋白;乳腺肿瘤;恶性程度;免疫组织化学
乳腺癌是世界上第二常见的癌症疾病,是女性最常见的癌症疾病,近年来其发生率以每年约3% ~4%的速度增长[1]。乳腺癌相关分子标志物的检测对于乳腺癌的诊断及预后和治疗都有着重要的指导意义,通常根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)等的表达选择不同方案进行系统性治疗[2]。同时钼靶X线及MRI检查等影像技术的发展也为乳腺癌的早期诊断提供了有力的手段[3]。但乳腺癌的病因尚不完全清楚,因此还没有确切从根本上预防乳腺癌的方法,加上其预后转归情况复杂,近年来寻找新的能对乳腺癌进行早期诊断和提示预后的分子标志物成为了研究热点。
FRY基因是果蝇的furry基因在哺乳动物中的同源基因,与果蝇的毛发生长有关[4]。FRY基因在细胞增殖和分裂[5]、上皮细胞极化[6]以及细胞形态[7]等方面起调节作用。有研究表明,人FRY基因有可能成为一种新的乳腺癌抑癌基因,它的表达水平与乳腺癌的发生发展及恶性程度密切相关[8],但目前FRY与乳腺肿瘤恶性程度的关系仍存在许多未知。故采用免疫组织化学方法对不同恶性程度乳腺肿瘤中FRY蛋白的表达进行检测,探究FRY蛋白的表达与乳腺癌恶性程度及临床病理参数之间的关系。
1 资料与方法
1.1样本收集
收集广东省韶关市第一人民医院及中山大学附属第六医院乳腺科2010年1月-2012年11月收治并经确诊的乳腺肿瘤石蜡组织标本104例。其中纤维囊性乳腺病11例,乳腺浸润性导管癌病例93例,所有患者术前均未进行放化疗,采用正电荷防脱玻片行常规4μm石蜡切片。
收集石蜡标本对应患者的基本信息及临床资料。在104例病例中,乳腺非癌病例主要为纤维囊性乳腺病,11例,年龄24~50岁,平均45.32岁;乳腺癌病例主要为乳腺浸润性导管癌,93例,年龄32~80岁,平均50.81岁;乳腺癌病例中,组织学分级参照病理报告信息,其中Ⅰ级7例,Ⅱ级47例,Ⅲ级39例;记录肿瘤直径、淋巴结转移、远处转移等情况,根据美国国立综合癌症网络(NCCN)指南TNM分期标准对各病例进行分期:I期27例,II期33例,III期22例,其中11例有部分信息缺失未能进行分期。记录ER、PR、HER2等免疫组织化学结果,对各病例进行分子病理分型,其中管腔上皮A型(Luminal A型)23例,管腔上皮B型(Luminal B型)47例,HER2过表达型13例,三阴型乳腺癌(triple negative breast cancer,TNBC型)10例。
1.2材料与试剂
FRY单克隆抗体为本课题组前期研究制备,经前期实验验证适用于免疫组织化学检测,磷酸盐缓冲溶液(phosphate buffer saline,PBS)、枸橼酸钠缓冲液购自武汉博士德公司,SP-9000免疫组织化学试剂盒、二氨基联苯胺(Diaminobenzidine,DAB)显色液、苏木素染液购自北京中杉金桥生物技术公司,乙醇、二甲苯购自广州中南化工试剂厂。
1.3方法步骤
SP法免疫组织化学检测:60℃烤片1 h,置于二甲苯及梯度乙醇中脱蜡至水,于3%过氧化氢H2O2内10 min灭活组织内源性过氧化物酶活性;枸橼酸钠缓冲液(pH6.0)中进行微波修复,室温自然冷却,1×PBS缓冲液洗3次,每次5 min;滴加山羊血清封闭,倾倒封闭液,不洗,滴加制备的FRY单克隆抗体,4℃孵育过夜,1×PBS缓冲液洗3次,每次5 min;滴加生物素化二抗,孵育15 min,1×PBS缓冲液洗3次,每次5 min;滴加辣根过氧化物酶标记的链酶卵白素工作液,孵育15 min,1×PBS缓冲液洗3次,每次5 min;DAB显色,蒸馏水冲洗,苏木素复染,脱水透明,并用中性树胶封片。阴性对照选用1×PBS缓冲液代替一抗。
1.4免疫组织化学染色结果判定
选取400倍镜下5个清晰视野进行观察拍照,细胞的染色强度分为4级,0分:无染色;1分:弱染色;2分:中度染色;3分:强染色。阳性细胞数也分4级,0分:染色阳性细胞<5%;1分:染色阳性细胞5%~25%;2分:染色阳性细胞26%~50%;3分:染色阳性细胞>50%。每张切片计分为染色阳性细胞数计分与染色强度计分之和,0分为阴性-,1、2分为+,3、4分为++,5、6分为+++,取5个视野的平均值,以1、2分为FRY蛋白阴性表达,3、6分为FRY阳性表达。
1.5统计学方法
采用SPSS 20.0统计软件对结果进行数据分析,采用χ2检验(或Fisher精确概率法)比较不同临床参数之间FRY蛋白的表达差异,P<0.05为差异有统计学意义。
2 结果
2.1不同恶性程度乳腺肿瘤中FRY蛋白的表达情况
免疫组织化学结果显示如附图,FRY蛋白的表达主要在细胞核,染色为浅黄色至棕黄色不等。在良性乳腺肿瘤细胞中可见细胞核呈深棕黄色,且染色细胞比例较大;在乳腺癌组织中,癌细胞棕黄色较浅或不明显,染色细胞较少;阴性对照全片无染色。
104例乳腺肿瘤中,11例纤维囊性乳腺病中FRY蛋白阳性表达为10例,阳性率90.9%;93例乳腺浸润性导管癌中为51例,阳性率54.8%,乳腺良性肿瘤中FRY蛋白的阳性率明显高于乳腺癌,差异有统计学意义(P<0.05)。见表1。
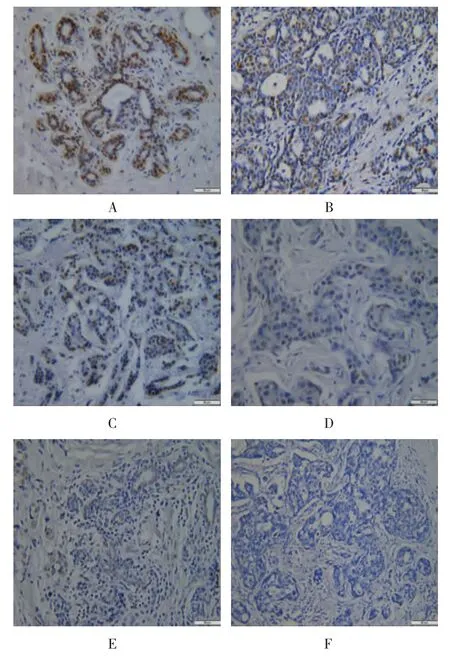
附图 不同组织学分级中FRY蛋白的表达情况(×400)

表1 良恶性乳腺肿瘤中FRY蛋白的表达情况
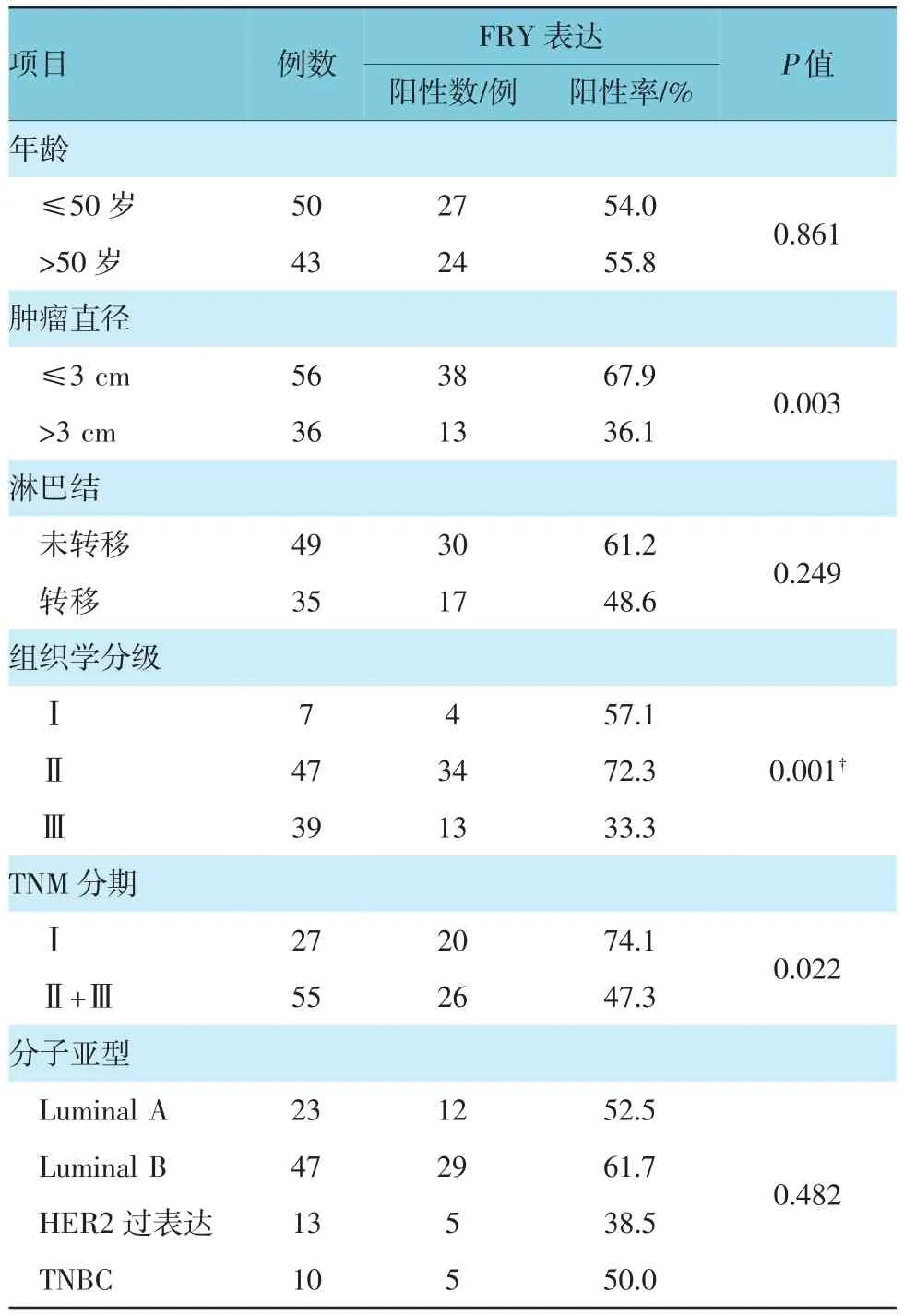
表2 FRY表达与乳腺癌临床病理参数的关系
2.2乳腺癌不同临床病理参数与FRY蛋白的表达情况
如表2所示,93例乳腺癌病例中,Ⅰ级、Ⅱ级、Ⅲ级FRY蛋白的阳性率分别为57.1%、72.3%及 33.3%,不同分级间FRY蛋白的表达水平差异有统计学差异(P<0.01)。在TNM分期中,分期较低的Ⅰ期与分期较高的Ⅱ期、Ⅲ期的FRY蛋白阳性率分别为74.1%和47.3%,不同分期间FRY蛋白的表达水平有显著性差异(χ2=5.282,P<0.01)。在分子亚型中,Luminal A型、Luminal B型、HER2过表达型、TNBC型的FRY蛋白阳性率分别为52.2%、61.7%、38.5%及50.0%,各组间差异无统计学意义(χ2= 2.462,P> 0.05)。肿瘤直径大小≤3 cm的组中FRY蛋白阳性率比直径大小>3 cm的组高,差异有统计学意义(χ2=8.939,P<0.01)。不同年龄段FRY蛋白的表达差异无统计学意义(χ2=0.031,P>0.05)。发生淋巴结转移的病例比未发生淋巴结转移的病例FRY蛋白表达水平要低,但无显著性差异(χ2= 1.326,P>0.05)。
2.3FRY蛋白表达与乳腺癌相关分子标志物水平的关系
在93例乳腺癌病例中,FRY蛋白表达在ER阳性组和ER阴性组的阳性率分别为58.0%和45.8%,阳性组表达高于阴性组(χ2=1.059,P>0.05);在PR阳性组和PR阴性组的阳性率分别为63.5%和35.7%,PR阳性组明显高于PR阴性组(χ2=5.905,P<0.05);在HER2阳性组和HER2阴性组的阳性率分别为56.7%和51.5%(χ2=0.228,P>0.05),在P53阳性组和阴性组的阳性率分别为62.8%和76.9% (P>0.05)。见表3。
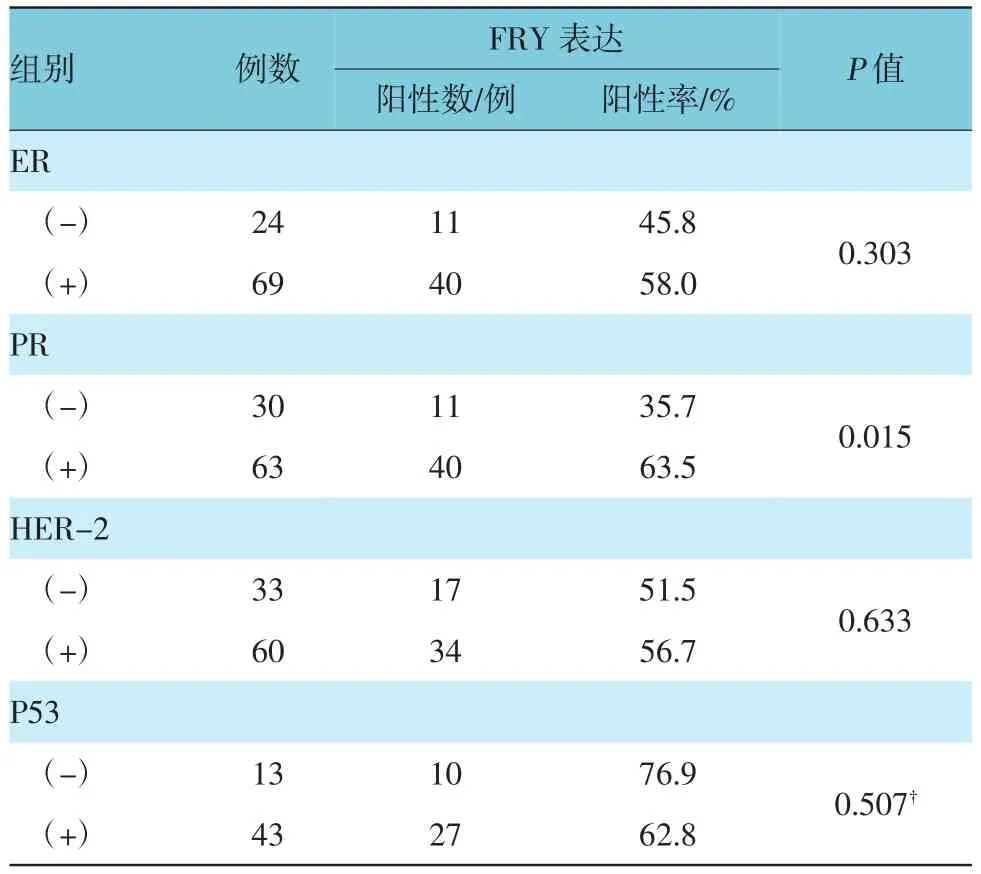
表3 FRY表达与乳腺癌相关蛋白水平的关系
3 讨论
乳腺癌的发生、发展是一个多因素参与和多阶段的复杂过程[9]。乳腺癌作为一种异质性肿瘤,主要体现在临床表现的多样性、治疗反应的不一致性及预后转归的差异性。通过对乳腺癌患者的临床表现、生物学特征等各种因素的分析,从差异中找出规律,为临床改进治疗手段、改善预后转归提供有力的支持。
在收集的病例中,纤维囊性乳腺病的FRY蛋白阳性率要低于乳腺浸润性导管癌,两者差异有统计学意义,表明在乳腺良性肿瘤中FRY蛋白的表达要高于乳腺恶性肿瘤,结合FRY基因在细胞增殖和分裂、细胞形态等方面的调节作用,提示FRY基因可能是正常乳腺细胞中不可缺少的,FRY蛋白的表达有助于乳腺细胞的正常分化和增殖,乳腺癌病例中癌细胞的形成和发生可能与FRY蛋白表达偏低有关。
乳腺癌的组织学分级具有重要的预后意义[10],分级越高肿瘤的分化越差,提示乳腺癌预后不良。各不同组织学分级间FRY蛋白的表达差异有统计学意义(P<0.05),但由于组织学Ⅰ级的病例仅有7例,在阳性表达率上并未高于Ⅱ级,考虑在后续工作中继续增加这一部分样本的收集和检测;在例数相当的Ⅱ、Ⅲ级病例中,分级越高,FRY表达明显降低。乳腺癌TNM分期也是临床上较成熟的评估指标[11]。在已分期的82例乳腺癌病例中,随着TNM分期的升高,FRY蛋白的阳性率均降低,差异有统计学意义(P<0.05),进一步验证了在不同恶性程度的乳腺癌中,FRY蛋白的表达存在规律性,分级高、分期晚的乳腺癌FRY蛋白表达低。
目前临床主要根据ER、PR及HER2的免疫组织化学检测结果将乳腺癌分为4种分子亚型,即Luminal A型(ER+/PR+、HER2-)、Luminal B型(ER+/PR+、HER2+)、HER2过表达型(ER-、PR-、HER2+)、三阴型乳腺癌(TNBC,ER-、PR-、HER2-)。其中,Luminal A型和Luminal B型的预后较好,而三阴型乳腺癌和HER-2过表达型则预后较差[12]。结果虽然显示FRY蛋白表达在各分子分型间的差异无统计学意义(P>0.05),考虑到样本收集的均衡性,样本来源于两个不同地区的医院,各医院的检测条件及评判程序可能存在差异性。但从FRY蛋白表达的阳性率可以看出Luminal A型和Luminal B型要高于三阴型乳腺癌和HER-2过表达型,仍可提示FRY蛋白表达在乳腺癌分子亚型中可能存在的趋势性。
雌激素受体(ER)和孕激素受体(PR)是评价乳腺癌预后和指导内分泌治疗的指标,ER、PR阴性者,属于非激素依赖型,一般分化较差;HER2表达与ER、PR表达呈负相关,表达越高,乳腺癌的复发率越高,预后越差[13]。结果显示PR阳性组中FRY蛋白表达率明显高于PR阴性组(P<0.05),ER阳性组也高于ER阴性组(P>0.05),HER2阴性组与HER2阳性组差异无统计学意义(P>0.05)。虽然ER的FRY表达差异无统计学意义,但从数据可以看出,纳入分析的病例中ER与PR均为93例,且ER、PR阴性组中FRY蛋白的阳性例数均为11例,ER、PR阳性组中FRY蛋白的阳性例数均为40例,具有高度的一致性,提示ER可能与PR跟FRY的关系一致。P53也是临床上与乳腺癌关系较大的分子标志物之一[14],收集的乳腺癌样本中有56例病例具有P53检查结果,但FRY表达情况在不同P53水平组见并未见显著差异(P>0.05)。
肿瘤大小和淋巴结转移情况是乳腺癌的重要预后指标[15],肿瘤越大出现转移的时间越短[16]。收集的乳腺癌样本中有1例肿瘤直径大小资料缺失,9例淋巴结转移资料缺失,在剩余的乳腺癌病例中,肿瘤直径小的FRY蛋白表达率高,差异有统计学意义(P<0.05);未发生淋巴结转移的表达率比发生淋巴结转移的高,但差异无统计学意义(P>0.05)。
综上,FRY蛋白在正常乳腺组织中的表达率比乳腺癌组织高,并且与乳腺癌组织学分级、TNM分期、肿瘤直径大小及激素受体水平相关,表明FRY蛋白与乳腺肿瘤恶性程度存在一定的关系,提示它在细胞内的表达可对乳腺癌起抑制作用。对于认识FRY蛋白在乳腺癌预后判断、指导临床治疗方面的作用提供了线索,为后续进一步研究FRY蛋白与乳腺肿瘤恶性程度的关系指明了方向。
参考文献:
[1] Youlden DR,Cramb SM,Yip CH,et al.Incidence and mortality of Female breast cancer in the Asia-Pacific region[J].Cancer Biol Med,2014,11(2):101-115.
[2] Ignatiadis M,Buyse M,Sotiriou C.Tailoring therapies—improving the management of early breast cancer:St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015[J].Ann Oncol,2015 Aug,26(8):1533-1546.
[3]余立君.乳腺癌早期诊断设备及其技术进展—超声、磁共振、核医学乳腺成像技术进展(二)[J].中国医疗设备,2010,25(8):51-53.
[4] Nagai T,Mizuno K.Multifaceted roles of furry proteins in invertebrates and vertebrates[J].J Biochem,2014,155(3):137-146.
[5] Ikeda M,Chiba S,Ohashi K,et al.Furry protein promotes aurora A-mediated Polo-like kinase 1 activation[J].J Biol Chem,2012,287(33):27670-27681.
[6] Chiba S,Ikeda M,Katsunuma K,et al.MST2- and Furry-mediated activation of NDR1 kinase is critical for precise alignment of mitotic chromosomes[J].Curr Biol,2009,19(8):675-681.
[7] Verde F,Wiley DJ,Nurse P.Fission yeast orb6,a ser/thr protein kinase related to mammalian rho kinase and myotonic dystrophy kinase,is required for maintenance of cell polarity and coordinates cell morphogenesis with the cell cycle[J].Proc Natl Acad Sci USA,1998,95(13):7526-7531.
[8] Ren X,Graham JC,Jing L,et al.Mapping of Mcs30,a new mammary carcinoma susceptibility quantitative trait locus (QTL30) on rat chromosome 12:identification of fry as a candidate Mcs gene[J].PLoS One,2013,8(9):e70930.
[9] Van-Ewijk RJ,Schwentner L,W觟ckel A,et al.Trends in patient characteristics,treatment and survival in breast cancer in a non-selected retrospective clinical cohort study of 2,600 patients[J].Arch Gynecol Obstet,2013 Jan,287(1):103-110.
[10] Page DL,Ellis IO,Elston CW.Histologic grading of breast cancer:Let' s do it (editorial)[J].Am J clin Pathol,1995,103 (1):123-124.
[11] Borges GS,Colchon PH,Staak MC J.et al.Analysis of disease-free survival and overall survival in patients with luminal a breast cancer stratified according to TNM[J].Klin Onkol,2014,27(3):178-182.
[12] Onitilo AA,Engel JM,Greenlee RT.Breast cancer subtypes based on ER/PR and Her2 expression:comparison of clinicopathologic features and survival[J].Clin Med Res.2009 Jun,7 (1-2):4-13.
[13] Joensuu K,Leidenius M,Kero M,et al.ER,PR,HER2,Ki-67 and CK5 in Early and Late Relapsing Breast Cancer-Reduced CK5 Expression in Metastases[J].Breast Cancer (Auckl),2013,(7):23-34.
[14] Peng Y.Potential prognostic tumor biomarkers in triple-negative breast carcinoma[J].Journal of Peking University,2012 Oct,44 (5):666-672.
[15]郭雅明,吴万敏,李艳杰.乳腺癌预后的相关因素研究进展[J].内蒙古医学杂志,2008,40(1):71-73.
[16] Fleming ST,Rastogi A,Dmitrienko A,et al.Acomprehensive prognostic index to predict survival based onmultiple comorbidities:a focous on breast cancer[J].Med Care,1999,37 (6):6012.
(张蕾编辑)
Expression of FRY and its significance in breast carcinomas with different degree of malignancy*
Fan Fei1,Chen-zi Zhang2,Jin-ming Zhao3,Hua-jun Chen4,Hai-nan Li4,Lin Yang2,Xue-feng Ren2,Qin-zhi Wei1,Xiao-jiang Tang2
(1.School of Public Health and Tropical Medicine,South Medical University,Guangzhou,Guangdong 510515,China; 2.Guangdong Medical Laboratory Animal Center,Foshan,Guangdong 528248,China; 3.The Sixth Affiliated Hospital,Sun Yat-sen University,Guangzhou,Guangdong 510655,China; 4.The First People's Hospital of Shaoguan,Shaoguan,Guangdong 512000,China)
Abstract:Objective To study the expression level of FRY protein in breast carcinomas of various degree of malignancy and its relationship with clinical pathological parameters.Methods One hundred and four cases of breast carcinomas were studied using immunohistochemical method,among which 11 cases had fibrocystic breast disease and 93 cases had invasive ductal carcinomas of breast.The expression level of FRY protein was determined,and the possible relationships between the FRY expression and a number of clinical pathological parameters were investigated.Results There was a significant difference in the positive rate of FRY expression between the fibrocystic breast disease cases and the breast invasive ductal carcinoma cases (90.9% vs 54.8%,P < 0.05).In the breast invasive ductal carcinomas,FRY expression was positively correlated with histological grades,TNM stages,tumor diameter and PR expression (P < 0.05).Conclusions The expression of FRY protein is strongly correlated with the malignant degree of breast carcinomas; the higher the malignancy of the carcinomas,the lower the expression level of FRY protein.Meanwhile,FRY expression is also related to progesterone receptor level in the body.
Keywords:FRY; tumor suppressor protein; breast neoplasm; malignant degree; immunohistochemistry
[通信作者]唐小江,E-mail:river-t@126.com,卫秦芝,E-mail:cnwei99@163.com
*基金项目:国家自然科学基金项目资助(No:81272904)
收稿日期:2015-11-17
文章编号:1005-8982(2016)06-0059-05
DOI:10.3969/j.issn.1005-8982.2016.06.013
中图分类号:R737.9
文献标识码:A
