Dickkopf1在骨关节炎中作用的初步研究
2016-04-18李强张志强尚雁峰天津市宁河县医院骨一科天津301500
李强,张志强,尚雁峰(天津市宁河县医院骨一科,天津301500)
Dickkopf1在骨关节炎中作用的初步研究
李强,张志强,尚雁峰
(天津市宁河县医院骨一科,天津301500)
摘要:目的探讨Dickkopf1(DKK1)在骨关节炎形成中的作用及临床意义。方法选取80例膝关节骨关节炎(OA)患者作为OA组;从无骨关节炎病史的人群中选取80例正常人作为正常对照组。按照要求将骨关节炎(OA)组与正常对照组取样后分别用酶联免疫吸附法测定其血清中DKK1的水平。构建兔膝关节炎模型,分为空白对照组、模型组和DKK1组。观察1个月后3组的病理学表现并进行对比,并进行Mankin评分,评估DKK1干预后的效果。结果OA组血清中DKK1的水平明显低于正常对照组,差异有统计学意义(P= 0.001);兔膝关节炎模型构建成功,同时,空白对照组Mankin评分为(1.08±0.35)分,模型组为(12.56±0.51)分,而DKK1组为(7.89±0.82)分。DKK1组的Mankin评分比模型组更低,但高于空白对照组,差异有统计学意义(P=0.003,P=0.001)。结论DKK1作为Wnt信号通路的抑制因子可以抑制成骨细胞分化,起到抑制OA病程的作用,其具体作用机制还需要进一步的基础及临床研究。
骨关节炎(osteoarthritis,OA)是一种常见的关节疾患之一。系由于增龄、肥胖、劳损、创伤等诸多因素引起的关节软骨及滑膜退变以及骨质增生为特征的退行性疾病,膝关节是临床上OA累及常见的部位之一[1]。关节炎病因非常复杂,主要与炎症、感染、自身免疫、退行性病变等因素有关[2],具体发病机制目前尚不完全清楚。
DKKs是一组含半胱氨酸的蛋白质,至少有4种形式(DKK1、2、3、4)。Wnt信号通路异常是参与新骨形成的最主要的机制。1998年首次在两栖动物非洲蟾蜍胚胎细胞中发现Dickkopf1,编码为DKK1。众多研究表明[3],Wnt/β-catenin信号通路在成骨细胞分化过程当中扮演非常重要的角色。它主要是在软骨细胞的损伤过程中起到非常重要的修复作用,从而有效的减缓了OA的发生、发展。DKK1是Wnt信号通路的主要抑制剂,有研究报道,DKK1可能参与到OA的发生发展中,但其具体机制尚不明确[4]。因此本研究试图通过构建兔膝OA模型以及检测人体血清中DKK1的水平,从临床标本和动物实验两个不同层次的研究明确DKK1是否参与了OA的发生、发展,为完善OA的发病机制提供进一步的依据。
1 材料与方法
1.1一般资料
选择天津市宁河县医院2014年5月-2015年3月间就诊并确诊为膝关节OA患者80例为OA组。其中,男性37例,女性43例;年龄为47~84岁,体重指数17.2~30.3 kg/m2。OA组患者选取标准:反复膝关节的疼痛、肿胀、蹲起困难而造成生活难以自理1个月以上,膝关节活动时有骨擦音、骨擦感。膝关节X线显示退行性改变:非对称性关节间隙变窄,软骨下骨硬化和(或)囊性变,关节缘骨赘形成[1]。排除标准:①排除近3个月内有严重感染病史或近6个月内有过机会感染;②妊娠及哺乳期妇女;③伴发有其他风湿性疾病如脊柱关节炎、弥漫性特发性骨质增生症及代谢性骨病如骨质疏松症患者等;④严重呼吸系统、心血管系统、消化系统、血液系统、内分泌系统疾病患者。选入OA组的患者均为手术后病灶组织经HE染色病理学确诊。同时选取本院的健康体检者(年龄、性别比例、体重指数相当)80例为正常对照组:男性35例,女性45例;年龄为48~83岁,体重指数17.4~30.4 kg/m2。一般资料比较见表1。两者差异无统计学意义(P>0.05)。
1.2人血清DKK1检测方法
抽取OA组与正常对照组研究对象的静脉血,真空离心处理(2 000 r/min,10 min)提取血清。将提取的血清存放于-80℃低温环境下保存。按生产厂商的使用说明,用酶联免疫吸附法(ELISA)试剂盒,测定血清DKK1水平。比较OA组与正常对照组人群血清中DKK1含量的差异。
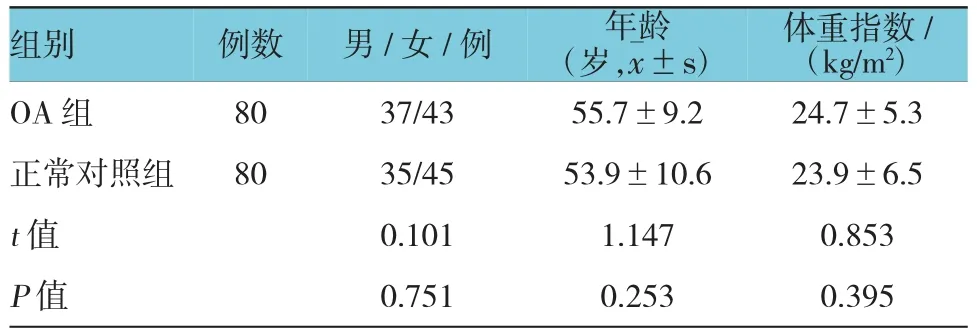
表1 两组患者一般资料比较
1.3兔膝OA模型的构建
本研究中兔膝OA模型的构建采用改良Hulth 法[5]。选用新西兰白兔常规全身麻醉、消毒、铺单后,暴露膝关节内侧,并行长约3 cm纵行切口,显露兔膝关节腔,然后用尖刀切断前后交叉韧带以及内侧副韧带,并切除内侧半月板的前1/3部分,保留关节软骨面(辅助检查抽屉试验阳性)。饲养1个月后取兔关节软骨组织。
1.4兔膝OA模型分组与处理
使用DKK1干预兔膝OA的研究,总共分为3组:空白对照组、模型组和DKK1组。其中,空白对照组的新西兰白兔不做任何处理只于膝关节腔内注射生理盐水,模型组用改良Hulth法构建兔膝OA模型,并于关节腔内注射生理盐水,DKK1组在构建膝OA的基础上,于关节腔内注射DKK1(150 ng/ml)[6]。从显微镜下根据Mankin评分体系评估兔膝软骨细胞的病理形态。
1.5组织病理评分标准
按照Mankin评分体系[7],对各组兔膝软骨组织的病理形态进行评分。
1.6统计学方法
采用SPSS 18.0统计软件进行数据分析,计量资料用均值±标准差(±s)表示,组间比较用t检验。计数资料以频数进行描述,组间比较用χ2检验,P< 0.05为差异有统计学意义。
2 结果
2.1OA组与正常对照组血清DKK1水平比较
OA组DKK1浓度为(4 356±1 275)pg/ml;正常对照组DKK1浓度为(5 421±1 085)pg/ml,正常对照组的DKK1浓度显著高于OA组,两组数据差异有统计学意义(P<0.05),见表2和图1。
2.2兔膝OA模型的成功构建
如图2所示空白对照组(A):软骨细胞数量多,细胞间排列整齐,HE染色非常均匀;模型组(B)示:软骨细胞非常少,且排列明显紊乱,HE染色弱,基质失染现象明显;DKK1组(C)示:软骨细胞较多,排列较为整齐,HE染色尚可。可见DKK1组相对于空白对照组的正常兔膝关节软骨细胞有一定程度的退变,但较模型组有较明显的好转。
2.3Mankin评分结果比较
HE染色Mankin评分结果:空白对照组(1.08± 0.35)分。模型组(12.56±0.51)分,而DKK1组(7.89 ±0.82)分,相比较而言,DKK1组评分高于空白对照组,但明显低于模型组评分。3组评分比较,差异有统计学意义(P<0.05),见表3和图3。
表2 两组人体血清DKK1浓度比较(±s)

表2 两组人体血清DKK1浓度比较(±s)
组别例数 DKK-1/(pg/ml) P值OA组 80 4 356±1 275 0.001正常对照组 80 5 421±1 085

图1 两组人体血清DKK1浓度比较

图2 兔关节软骨HE染色
表3 3组Mankin评分结果(±s)

表3 3组Mankin评分结果(±s)
注:1)空白对照组与模型组比较,P=0.001;2)空白对照组与DKK1组比较,P=0.003
组别例数 评分(分)空白对照组 15 1.08±0.35模型组 15 12.56±0.511)DKK1组 15 7.89±0.822)

图3 3组Mankin评分结果
3 讨论
OA是一种慢性进行性退行性病变[8],显著影响患者的生活质量,严重者可最终导致关节功能的丧失[9]。但目前尚无相关文献明确骨关节炎的发病机制,使得对骨关节炎的治疗常是无的放矢、事倍功半。众多研究表明:aggrecanases、MMPs等蛋白酶[10-12]以及蛋白多糖的降解在骨关节炎形成过程中发挥重要的作用。但是,针对这些蛋白酶及蛋白多糖的生物治疗方法来治疗骨关节炎的效果不尽人意。然而近来对软骨细胞中这些蛋白酶的上游信号通路Wnt信号通路的研究逐渐成为新的热点[13-14]。
近期研究发现,Wnt通路可以调节细胞的各个功能,诸如生长、分化和死亡,其产生的糖蛋白对于细胞生长和存活的调控极为关键[15]。在Wnt/β-catenin信号通路中,DKK1激活使β-catenin聚集并转位至核内,激活相应靶基因,从而调节成骨细胞和软骨细胞增殖活化[16]。OA软骨细胞培养的相关研究表明Wnt信号通路下调与关节疾病有一定的相关性。DKK是Wnt信号通路的主要抑制剂[17]。DKK1是DKK家族4大成员之一,是一种分泌性糖蛋白,也是Wnt信号通路传导的关键拮抗因子之一,DKK1在关节炎、骨质疏松症等疾病中都存在着异常表达[18-19]。
本研究结果显示,通过酶联免疫吸附法比较OA组与空白对照组血清中DKK1的浓度,发现OA组人体血清中DKK1的浓度显著低于空白对照组,差异有统计学意义,说明血清中DKK1水平越低,就越可能获得骨关节炎症。正常人血清的DKK1含量高于有骨关节炎症人群,提示DKK1有预防或者缓解骨关节炎症的作用。为了证实这一结论,本研究通过成功构建膝关节炎的兔动物模型,通过空白对照组、模型组、DKK1组3组结果互相比较,发现DKK1组兔膝软组织Mankin评分显著低于模型组,但高于空白对照组,差异有统计学意义,说明DKK1的干预使兔子的软骨细胞得到部分修复、凋亡及坏死减少,骨关节炎的进程到控制,表明其对骨关节炎有积极的缓解作用。这可能是DKK1通过作用于LRP5/6抑制Wnt/β-catenin信号通路,参与关节疾病的发生。DKK1作为Wnt通路的主要抑制蛋白,在骨代谢进程中起着抑制骨形成和促进骨破坏的作用,已被众多研究证实为骨代谢平衡的负向调节蛋白之一。本研究结果与相关文献报道一致[17,20]。
综上所述,DKK1作为Wnt信号通路的抑制因子可以抑制成骨细胞分化,从而起到抑制OA进展的作用。本研究为表明DKK1在抑制OA进程中的作用,提供了一定的参考依据。但这一结论还需要严谨完整、扩大样本量的研究来进一步验证本实验结果。其具体作用机制还需要进一步的基础及临床研究。
参考文献:
[1]中华医学会骨科学分会.骨关节炎诊治指南(2007年版)[J].中国矫形外科杂志,2014,22(3):287-288.
[2] Pereira D,Ramos E,Branco J.Osteoarthritis[J].Acta Medica Portuguesa,2014,28(1):99-106.
[3] Chen M,Qiao H,Su Z,et al.Emerging therapeutic targets for osteoporosis treatment[J].Expert Opinion on Therapeutic Targets,2014,18(7):817-831.
[4] Guanabens N,Gifre L,Peris P.The role of Wnt signaling and sclerostin in the pathogenesis of glucocorticoid-induced osteoporosis[J].Current Osteoporosis Reports,2014,12(1):90-97.
[5]熊元,赵振国,李传郡,等.兔膝骨关节炎模型的制备及鉴定[J].实验动物科学,2013,30(3):31-34.
[6]李书琴,杨珊,任嫒姝,等.张应力刺激下Wnt/β-catenin信号通路对成牙骨质细胞Runx2表达调控的体外研究[J].华西口腔医学杂志,2015,1:35-39.
[7] Van Der Sluijs JA,Geesink RG,Van Der Linden AJ,et al.The reliability of the Mankin score for osteoarthritis[J].Journal of Orthopaedic Research:Official Publication of the Orthopaedic Research Society,1992,10(1):58-61.
[8] Howell R,Kumar N S,Patel N,et al.Degenerative meniscus:pathogenesis,diagnosis,and treatment options[J].World Journal of Orthopedics,2014,5(5):597-602.
[9] Hunter DJ.Viscosupplementation for osteoarthritis of the knee[J].The New England Journal of Medicine,2015,372 (11):1040-1047.
[10] Zhang D,Huang B,Xiong C,et al.Pinocembrin inhibits matrix metalloproteinase expression in chondrocytes[J].IUBMB Life,2015,67(1):36-41.
[11] El-Bakali J,Gras-Masse H,Maingot L,et al.Inhibition of aggrecanases as a therapeutic strategy in osteoarthritis[J].Future Medicinal Chemistry,2014,6(12):1399-1412.
[12] Mladenovic Z,Saurel AS,Berenbaum F,et al.Potential role of hyaluronic acid on bone in osteoarthritis:matrix metalloproteinases,aggrecanases,and RANKL expression are partially prevented by hyaluronic acid in interleukin 1-stimulated osteoblasts[J].The Journal of Rheumatology,2014,41(5):945-954.
[13] Weng X,Lin P,Liu F,et al.Achyranthes bidentata polysaccharides activate the Wnt/beta-catenin signaling pathway to promote chondrocyte proliferation[J].International Journal of Molecular Medicine,2014,34(4):1045-1050.
[14] Li J,Zhou XD,Yang KH,et al.Hinokitiol reduces matrix metalloproteinase expression by inhibiting Wnt/beta-Catenin signaling in vitro and in vivo[J].International Immuno-pharmacology,2014,23(1):85-91.
[15] Peng X,Yang L,Chang H,et al.Wnt/beta-catenin signaling regulates the proliferation and differentiation of mesenchymal progenitor cells through the p53 pathway[J].PloS One,2014,9(5):e97283.
[16] Sassi N,Laadhar L,Allouche M,et al.WNT signaling and chondrocytes:from cell fate determination to osteoarthritis physiopathology[J].Journal of Receptor and Signal Transduction Research,2014,34(2):73-80.
[17] Funck-Brentano T,Bouaziz W,Marty C,et al.Dkk-1-mediated inhibition of Wnt signaling in bone ameliorates osteoarthritis in mice[J].Arthritis & Rheumatology (Hoboken,NJ),2014,66(11):3028-3039.
[18] Lin CH,Ji T,Chen CF,et al.Wnt signaling in osteosarcoma[J].Advances in Experimental Medicine and Biology,2014,804:33-45.
[19] Daoussis D,Andonopoulos AP.The emerging role of Dickkopf-1 in bone biology:is it the main switch controlling bone and joint remodeling[J].Seminars in Arthritis and Rheumatism,2011,41(2):170-177.
[20] Oh H,Chun CH,Chun JS.Dkk-1 expression in chondrocytes inhibits experimental osteoarthritic cartilage destruction in mice[J].Arthritis and Rheumatism,2012,64(8):2568-2578.
(张蕾编辑)
临床论著
Role of Dickkopf1 in osteoarthritis
Qiang Li,Zhi-qiang Zhang,Yan-feng Shang
(The First Department of Orthopedics,Ninghe Hospital of Tianjin,Tianjin 301500,China)
Abstract:Objective To study the effect and clinical significance of DKK1 on osteoarthritis (OA).Methods In this study,80 OA cases were selected as OA group,80 patients without history of OA as normal control group.The serum level of DKK1 was measured by sandwich enzyme linked immunosorbent assay (ELISA) in both groups.The rabbit model of knee osteoarthritis was built.The pathological characteristics of control,model and DKK1 groups were contrasted and the Manikin score was assessed as well.The therapeutic effect of DKK1 was evaluated.Results The serum level of DKK1 in the OA group was significantly lower than that in the control group (P = 0.001).The rabbit model of knee osteoarthritis was built successfully.The Manikin score in the DKK1 group (7.89±0.82) was significantly lower than that in the model group[(12.56±0.51),P = 0.003],but was significantly higher than that in the control group[(1.08±0.35),P = 0.001].Conclusions As the Wnt signaling pathway inhibitor,DKK1 can inhibit osteoblast differentiation,restrain the course of OA; but its mechanism in the human body still needs further research.
Keywords:osteoarthritis; DKK1; Wnt pathway
收稿日期:2015-10-21
文章编号:1005-8982(2016)06-0019-04
DOI:10.3969/j.issn.1005-8982.2016.06.005
中图分类号:R684.3
文献标识码:A
关键字:骨关节炎;DKK1;Wnt信号通路
