染料木黄酮通过抑制VEGF表达抑制人口腔癌TCA8113细胞增殖*
2016-04-15戴红良葛树卿楚明会梁春光贾桂枝
戴红良, 葛树卿, 楚明会, 梁春光, 王 玥, 贾桂枝
(辽宁医学院 1护理学院, 2附属第一医院口腔科, 3生物化学与分子生物学教研室,辽宁 锦州 121001)
染料木黄酮通过抑制VEGF表达抑制人口腔癌TCA8113细胞增殖*
戴红良1△,葛树卿2,楚明会1,梁春光1,王玥1,贾桂枝3
(辽宁医学院1护理学院,2附属第一医院口腔科,3生物化学与分子生物学教研室,辽宁 锦州 121001)
[摘要]目的: 观察染料木黄酮对人口腔癌TCA8113细胞增殖的影响,并探讨其作用机制。方法: MTT法、细胞计数法及集落形成实验检测细胞增殖;蛋白质免疫印迹检测血管内皮生长因子(VEGF)、细胞外信号调节激酶(ERK)及p-ERK的蛋白水平。结果: 染料木黄酮能显著抑制TCA8113细胞的增殖,其抗增殖活性具有浓度依赖性;染料木黄酮还可剂量依赖性地降低VEGF、ERK及p-ERK的蛋白水平;VEGF的表达可被ERK特异性抑制剂U0126所抑制;VEGF受体拮抗剂阿西替尼及U0126均显著抑制TCA8113细胞的增殖。结论: 染料木黄酮可抑制人口腔癌TCA8113细胞的增殖,其机制可能与其抑制ERK表达及活化,进而抑制VEGF的表达有关。
[关键词]染料木黄酮; TCA8113细胞; 细胞增殖; 血管内皮生长因子; 细胞外信号调节激酶
口腔鳞状细胞癌是最常见的口腔恶性肿瘤,占头颈部肿瘤的80%以上[1]。在过去的十年间,口腔癌的发生率增加了50%。尽管治疗手段不断改善,患者的5年生存率也只有约50%[2]。而且即使通过手术切除,口腔癌仍存在着较高的局部复发率[3],患者预后较差。因此,发掘新的治疗口腔癌的药物和方式具有重要的临床价值和意义。
目前,天然药物因其低毒高效的特点引起了科研人员的关注[4-5]。染料木黄酮(4’,5,7-三羟基异黄酮)是大豆及其制品中一种含量丰富的植物雌激素。除了其弱雌激素活性外,染料木黄酮还是一种强效的蛋白酪氨酸激酶(protein tyrosine kinase,PTK)抑制剂, 能够通过对细胞内多种信号分子的调节影响结肠直肠癌[6]、肝癌[7]、肺癌[8]及乳腺癌[9]等各种肿瘤细胞的恶性增殖。除此之外,最近的研究还显示染料木黄酮对体外培养的人口腔癌TCA8113细胞亦具有显著的抗增殖活性[10],但对于其抗口腔癌机理仍需进一步研究。本研究拟从血管内皮生长因子(vascular endothelial growth factor,VEGF)调控角度,探讨染料木黄酮对口腔癌的增殖作用及其作用机理。
材料和方法
1材料
人口腔癌TCA8113细胞购自中国科学院上海细胞库;胎牛血清购自HyClone;RPMI-1640培养基购自Coring;染料木黄酮(genistein)、胰蛋白酶、二甲基亚砜(dimethyl sulfoxide,DMSO)、噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]和阿西替尼(axitinib)购于Sigma;RIPA裂解液购自南京诺维赞生物科技有限公司;BCA蛋白定量试剂盒购自北京索莱宝科技有限公司;细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、磷酸化ERK(p-ERK)的 I 抗及辣根过氧化酶标记的 II 抗购自Santa Cruz;VEGF的I 抗购自武汉博士德生物工程有限公司。
2方法
2.1细胞培养人口腔癌TCA8113细胞株以含10%胎牛血清的RPMI-1640培养基培养,置于37 ℃、5% CO2培养箱中。用含0.25%乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化细胞,每3 d传代 1 次,取对数生长期细胞用于实验。
2.2细胞计数检测细胞增殖取对数生长期的TCA8113细胞以每孔1×105的密度接种于6孔板中。待细胞贴壁后,在37℃、5% CO2培养箱中以不同处理因素在作用TCA8113细胞48 h,0.25% EDTA胰酶消化后进行细胞计数。
2.3集落形成实验TCA8113细胞以每孔1 000 个的密度接种于6孔培养板,待细胞贴壁后,以0.1% DMSO(对照组)及不同浓度的染料木黄酮作用TCA8113细胞10 d。PBS清洗后,以4%多聚甲醛于室温固定20 min,再用PBS洗3遍,以结晶紫染色,按下式计算:集落形成率(colony-forming efficiency, CFE)=(集落数/接种细胞数)×100%。
2.4细胞活力检测取对数生长期的细胞接种于96孔板。待细胞贴壁并实施各种处理后,加入MTT(终浓度为5 g/L),置于37 ℃、5% CO2培养箱中孵育4 h。弃去MTT, 加入150 μL DMSO在37 ℃ 作用10 min并充分振摇直到结晶充分溶解。用酶标仪(Bio-Rad)在波长490 nm时检测吸光度值。
2.5Western blotting实验细胞以预冷PBS洗3遍,加入RIPA细胞裂解液 [临用前加入0.1%苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)] 提取细胞总蛋白, BCA法测定蛋白浓度。取30 μg总蛋白,行SDS-聚丙烯酰胺凝胶电泳。待电泳完成后电转移至聚偏氟乙烯(polyvinylidene difluoride,PVDF)膜。用1%BSA封闭1 h,接着加待检测蛋白的I抗4 ℃孵育过夜。TBST充分洗膜后,以HRP标记的II抗室温孵育2 h。TBST洗膜后,化学发光法显色。采用Quantity One软件对条带灰度进行分析。
3统计学处理
数据采用SPSS 17.0统计软件进行分析。数值以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析及两两比较的SNK法。以P<0.05为差异有统计学意义。
结果
1染料木黄酮对TCA8113细胞活力及计数的影响
与对照组相比,不同浓度染料木黄酮处理TCA8113细胞48 h后,随着染料木黄酮浓度的增加,TCA8113细胞活力逐渐降低,细胞数逐渐减少,见图1。
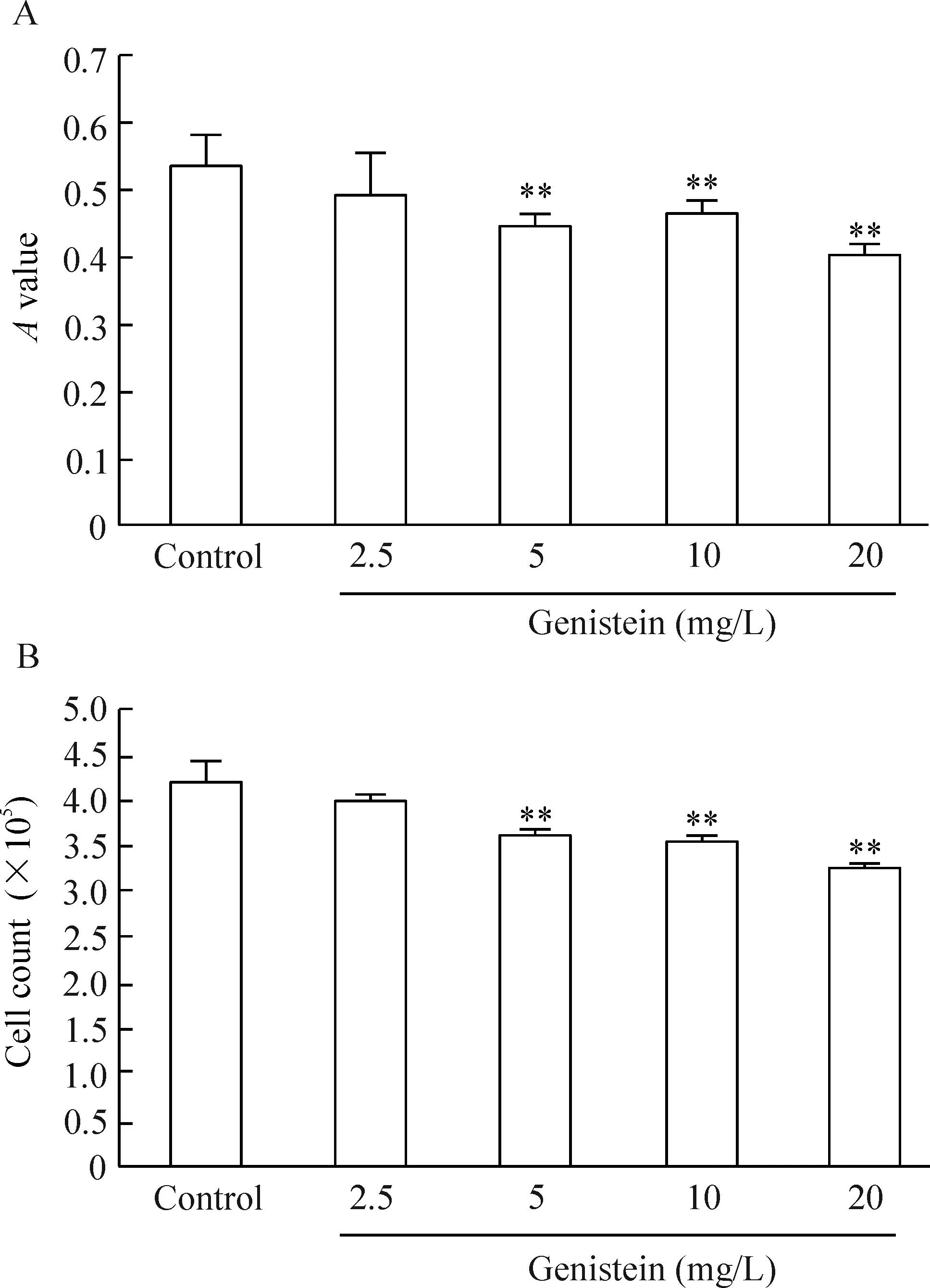
Figure 1.Proliferation inhibitory effect of different concentrations (0~20 mg/L) of genistein on TCA8113 cells detected by MTT assay (A) and cell counting (B).Mean±SD.n=5.**P<0.01vscontrol group.
图1不同浓度染料木黄酮对TCA8113细胞增殖的抑制作用
2染料木黄酮对TCA8113细胞集落形成的影响
与对照组相比,不同浓度染料木黄酮处理TCA8113细胞10 d后,随着染料木黄酮浓度的增加,TCA8113细胞集落形成率逐渐降低,当药物浓度达到20 mg/L时,几乎没有集落形成。而且,集落的面积也随着药物浓度的增加而减少,见图2。

Figure 2.The colony-forming efficiency (CFE) of TCA8113 cells after treatment with genistein at different concentrations (0~20 mg/L) for 10 d. Mean±SD.n=3.**P<0.01vscontrol group.
图2不同浓度染料木黄酮处理TCA8113细胞10 d后的细胞集落形成率
3染料木黄酮对TCA8113细胞VEGF表达的影响
与对照组相比,不同浓度染料木黄酮处理TCA8113细胞24 h后,TCA8113细胞VEGF的表达水平均随着药物浓度的增加而逐渐减弱,表明染料木黄酮具有抑制口腔癌细胞VEGF表达的生物活性,见图3。
4染料木黄酮对TCA8113细胞ERK表达及活化的影响
与对照组相比,不同浓度染料木黄酮处理TCA8113细胞24 h后,TCA8113细胞总ERK及磷酸化ERK(ERK的活化形式)的水平均随着药物浓度的增加而逐渐减弱,表明染料木黄酮可显著抑制TCA8113细胞ERK的表达及活化,见图4。
5U0126对TCA8113细胞VEGF表达的影响
如图5所示,ERK特异性阻断剂U0126可显著抑制VEGF的表达,表明基础状态下,口腔癌VEGF的表达受到ERK的调控,而染料木黄酮对VEGF表达的抑制作用可能与该物质对ERK的活化抑制有关。
6U0126及阿西替尼对TCA8113细胞增殖的影响
ERK特异性阻断剂U0126及VEGF受体(VEGFR)拮抗剂阿西替尼均可显著抑制TCA8113细胞的增殖,表明ERK及VEGF的确参与了TCA8113细胞的增殖,而且VEGF的促增殖活性至少部分是由其受体(VEGFR)介导的。而上述染料木黄酮抗TCA8113细胞增殖的活性很有可能与其对ERK/VEGF信号级联的抑制有关,见图6。
讨论
口腔癌是世界上第六种最常见的恶性肿瘤之一[11]。据估计,口腔癌的年发病率约为27.5万[12]。而且,近年来其发病率有逐年增高的趋势,并具有年轻化发展的趋势[13-14]。尽管目前口腔癌的诊疗手段不断进步,但目前对于其治疗仍极为困难,患者预后较差[11]。近些年,人们在以手术和放疗的基础上,逐步引入化学治疗,取得了不错的效果。但与此同时,化疗药物严重的毒副作用又大大限制了临床上对口腔癌的治疗[3]。因此,极有必要开发毒副作用小、疗效高的抗口腔癌药物。

Figure 3.The effect of genistein at different concentrations (0~20 mg/L) on the expression of VEGF in the TCA8113 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图3不同浓度染料木黄酮对TCA8113细胞VEGF表达的影响
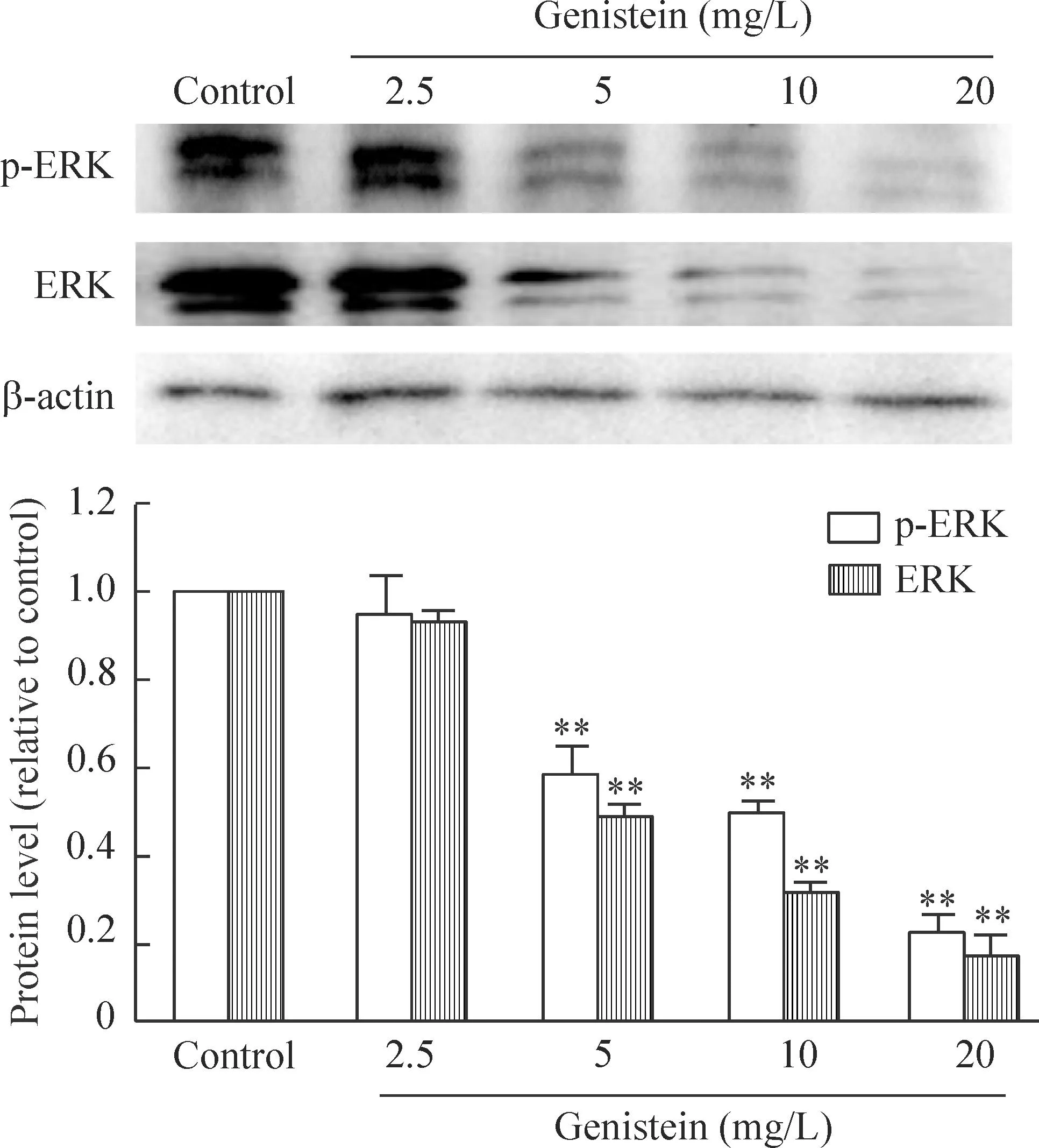
Figure 4.The effect of genistein at different concentrations (0~20 mg/L) on the expression and activation of ERK in TCA8113 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图4不同浓度染料木黄酮对TCA8113细胞ERK的表达及活化的影响
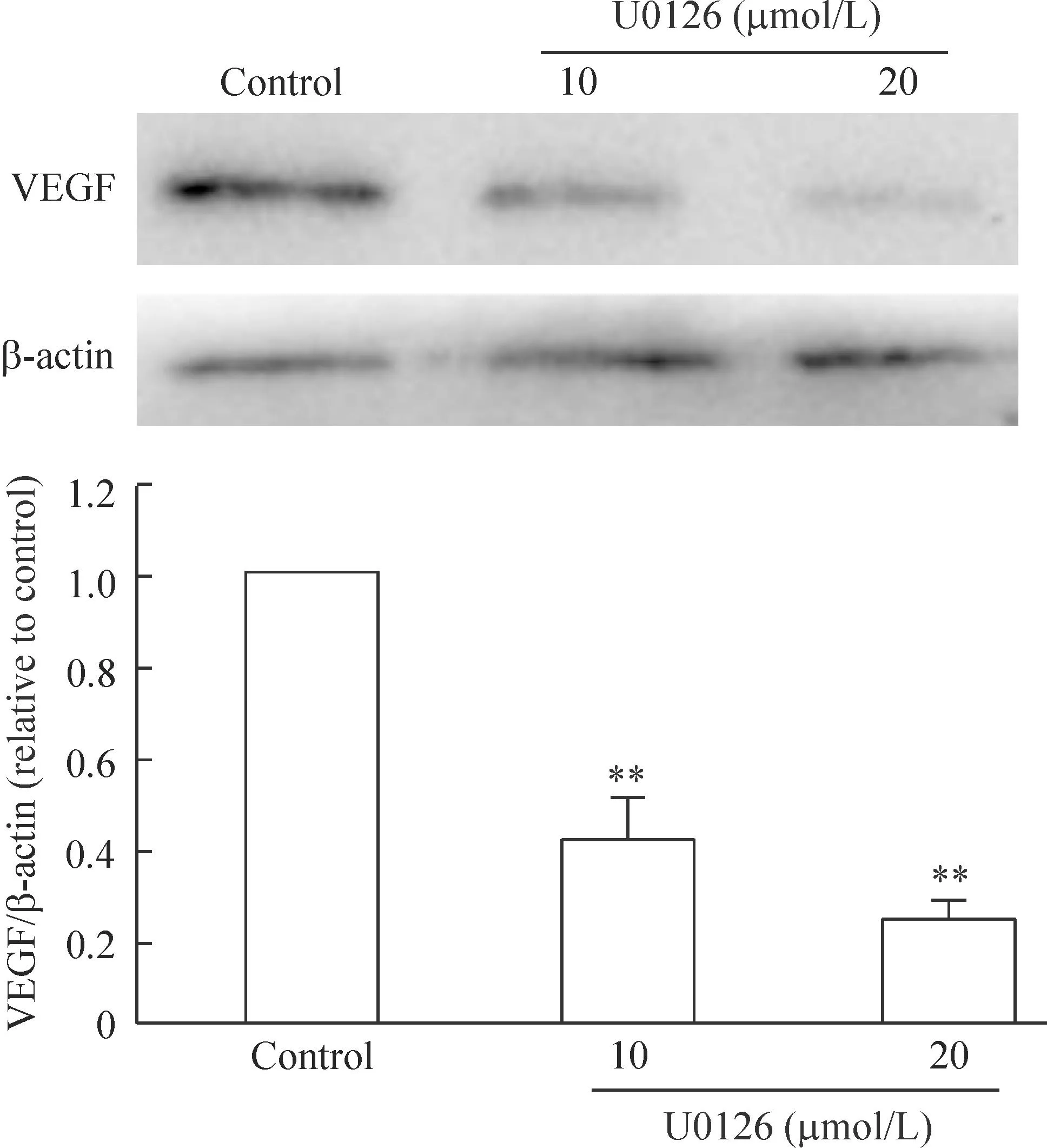
Figure 5.The effect of U0126 on the expression of VEGF in the TCA8113 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图5U0126对TCA8113细胞VEGF表达的影响

Figure 6.Proliferation inhibitory effect of U0126 (10 μmol/L) and axitinib (5 μmol/L) on TCA8113 cells detected by MTT assay (A) and cell counting (B).Mean±SD.n=5.**P<0.01vscontrol group.
图6U0126及阿西替尼对TCA8113细胞增殖的抑制作用
近年来天然物质因其高效低毒的特性受到了越来越多的关注[5,15]。染料木黄酮化学名为4’,5,7-三羟基异黄酮,是在大豆等植物中形成的天然异黄酮类物质,广泛存在于人们的日常饮食之中[16]。研究证实染料木黄酮具有抑制平滑肌源性泡沫细胞的形成[17]、缓解糖尿病心肌病心肌炎症和氧化应激[18]及抗肿瘤[7]等多种生物活性。尤其是其抗肿瘤活性更是得到了普遍认同。许多研究证实染料木黄酮对乳腺癌、胃癌、肺癌、肝癌、结直肠癌等多种肿瘤均显示出强大的抗癌活性[19]。本研究发现染料木黄酮能够剂量依赖性地抑制口腔癌细胞的活力、细胞计数、集落形成率及其集落形成的面积,显示出染料木黄酮强大的口腔癌增殖抑制活性,这与张群[10]之前的研究报道一致。
血管生成是促进肿瘤细胞生长增殖的重要机制。目前已发现多种参与血管生成的基因,其中VEGF作为强大的血管生成因子,广泛地表达于包括口腔癌细胞在内的各种癌症细胞上[20-21]。研究显示VEGF能促进舌癌中血管的生成,促进舌癌的生长转移;VEGF靶向干扰则可明显抑制口腔癌细胞的增殖,促进其凋亡[20]。本研究则进一步证实VEGF的促口腔癌增殖活性可能是由其受体介导的。之前研究报道显示染料木黄酮可通过抑制肿瘤细胞VEGF的表达抑制各种肿瘤的增殖生长[22],但尚不清楚该天然物质对口腔癌细胞的抑制作用是否与其对VEGF表达的抑制有关。在本研究中,我们发现不同浓度的染料木黄酮可剂量依赖性地抑制人口腔癌TCA8113细胞VEGF的表达,从而提示染料木黄酮对VEGF的表达的抑制作用可能是其抗口腔癌进展的重要机理。
ERK是丝裂原活化蛋白激酶信号转导家族的关键分子。ERK在许多恶性肿瘤中被异常激活,从而参与细胞的癌变、恶性增殖、侵袭和转移等[23]。最近研究发现ERK的激活与口腔癌细胞的增殖、迁移和侵袭密切相关[24-25]。而且,MEK的特异性抑制剂PD184352可剂量依赖性地抑制TCA8113细胞的增殖[26]。上述研究均提示ERK可能是口腔癌化学治疗的重要靶点。研究显示染料木黄酮可通过抑制ERK的活化抑制宫颈癌及肝癌的增殖[7,27],而对于口腔癌SCC15细胞,染料木黄酮不仅可抑制ERK活化(磷酸化),还可抑制总ERK的表达[28]。在本实验中我们利用Western blot发现,与SCC15细胞类似,染料木黄酮对TCA8113细胞ERK的表达及活化均呈现剂量依赖性的抑制作用。ERK促进癌症进展的关键机制之一即是促进VEGF的表达及肿瘤血管化[20]。在本研究中我们发现,ERK特异性阻断剂U0126亦可显著抑制TCA8113细胞VEGF的表达。表明口腔癌VEGF的表达及其血管化也是ERK依赖性的。综上所述,我们推测染料木黄酮可能通过抑制ERK的表达及活化,进而抑制VEGF的表达,从而抑制口腔癌TCA8113细胞的增殖。
口腔癌是世界上常见的恶性肿瘤之一,患者一般预后较差。而化学合成药物因其严重的毒副作用限制了其疗效的发挥。而本研究证实价格低廉、毒副作用小的天然物质染料木黄酮具有显著的抗口腔癌增殖活性,其抗癌机理可能与其抑制ERK/VEGF信号通路的活化有关。该研究为临床上尝试使用该物质进行口腔癌治疗提供了实验和理论依据。
[参考文献]
[1]Ren A, Qiu Y, Cui H, et al. Inhibition of H3K9 methyltransferase G9a induces autophagy and apoptosis in oral squamous cell carcinoma [J]. Biochem Biophys Res Commun, 2015, 459(1):10-17.
[2]Shao Y, Sha XY, Bai YX, et al. Effect of a disintegrin and metalloproteinase 10 gene silencing on the proliferation, invasion and migration of the human tongue squamous cell carcinoma cell line TCA8113[J]. Mol Med Rep, 2015, 11(1): 212-218.
[3]Wang CQ, Li YJ, Wei ZM, et al. Stable gene-silence of Kif2a synergistic with 5-fluorouracil suppresses oral tongue squamous cell carcinoma growthinvitroandinvivo[J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2013, 116(1): 49-54.
[4]戴红良,贾桂枝,赵颂,等. 黄芪多糖对异丙肾上腺素诱发的SERCA2a表达及活性降低的影响[J]. 中国药理学通报, 2015, 31(3):388-391.
[5]Dai HL, Jia GZ, Zhao S. Total glycosides of Ranunculus japonius prevent hypertrophy in cardiomyocytes via alleviating chronic Ca2+overload[J]. Chin Med Sci J, 2015, 30(1):37-43.
[6]Qin J, Chen JX, Zhu Z, et al. Genistein inhibits human colorectal cancer growth and suppresses miR-95, Akt and SGK1 [J]. Cell Physiol Biochem, 2015, 35(5):2069-2077.
[7]戴红良,贾桂枝,赵艳,等. 染料木黄酮通过抑制EGFR/ERK通路抗肝癌SMMC7721细胞增殖[J]. 辽宁医学院学报, 2015, 36(1):1-3, 21, 105.
[8]Tian T, Li J, Li B, et al. Genistein exhibits anti-cancer effects via down-regulating FoxM1 in H446 small-cell lung cancer cells[J]. Tumour Biol, 2014, 35(5):4137-4145.
[9]Chen J, Duan Y, Zhang X, et al. Genistein induces apoptosis by the inactivation of the IGF-1R/p-Akt signaling pathway in MCF-7 human breast cancer cells[J]. Food Funct, 2015, 6(3):995-1000.
[10]张群. Genistein对Tca8113舌癌细胞株增殖、侵袭影响的初步研究[D]. 南京: 南京医科大学, 2009.
[11]Shao Y, Zhang SQ, Quan F, et al. MicroRNA-145 inhi-bits the proliferation, migration and invasion of the human TCA8113 oral cancer line[J]. Oncol Lett, 2013, 6(6):1636-1640.
[12]Warnakulasuriya S. Global epidemiology of oral and oropharyngeal cancer[J]. Oral Oncol, 2009, 45(4-5):309-316.
[13]Hernandez-Guerrero JC, Jacinto-Aleman LF, Jimenez-Farfan MD, et al. Prevalence trends of oral squamous cell carcinoma. Mexico City’s General Hospital experience [J]. Med Oral Patol Oral Cir Bucal, 2013, 18(2): e306-e311.
[14]于四海,严晓峰. 牛蒡苷通过激活p38 MAPK抑制舌癌Tca8113细胞增殖的实验研究[J]. 西部医学, 2015, 27(5):645-647,651.
[15]戴红良,黄雷,贾桂枝,等. 左卡尼汀抑制过氧化氢介导的NFATc3核转位[J]. 中国病理生理杂志, 2014, 30(10):1902-1904, 1909.
[16]Choi EJ, Jung JY, Kim GH. Genistein inhibits the proli-feration and differentiation of MCF-7 and 3T3-L1 cells via the regulation of ERalpha expression and induction of apoptosis[J]. Exp Ther Med, 2014, 8(2):454-458.
[17]Lin J, Xu Y, Zhao T, et al. Genistein suppresses smooth muscle cell-derived foam cell formation through tyrosine kinase pathway[J]. Biochem Biophys Res Commun, 2015, 463(4):1297-1304.
[18]Gupta SK, Dongare S, Mathur R, et al. Genistein ameliorates cardiac inflammation and oxidative stress in streptozotocin-induced diabetic cardiomyopathy in rats[J]. Mol Cell Biochem, 2015, 408(1-2):63-72.
[19]Spagnuolo C, Russo GL, Orhan IE, et al. Genistein and cancer: current status, challenges, and future directions[J]. Adv Nutr, 2015, 6(4):408-419.
[20]曹莹. 载体携带小干扰RNA抑制人舌癌Tca8113细胞VEGF的表达以及肿瘤生长的体内外研究[D]. 南宁: 广西医科大学, 2008.
[21]王华川,温剑虎. siRNA介导的nestin基因沉默对人食管癌ECA109细胞侵袭和迁移的影响及机制[J]. 中国病理生理杂志, 2015, 31(8):1432-1436.
[22]邢扬帆,刘旭杰,王智彪,等. 染料木黄酮对MKN45胃癌细胞及其皮下移植瘤抗血管生成作用的研究 [J]. 重庆医科大学学报, 2014, 39(12): 1686-1691.
[23]Liu Z, Dai H, Jia G, et al. Insufficient radiofrequency ablation promotes human hepatoma SMMC7721 cell proliferation by stimulating vascular endothelial growth factor overexpression[J]. Oncol Lett, 2015, 9(4): 1893-1896.
[24]Sun Y, Zhu D, Wang G, et al. Pro-inflammatory cytokine IL-1β up-regulates CXC chemokine receptor 4 via Notch and ERK signaling pathways in tongue squamous cell carcinoma[J]. PLoS One, 2015, 10(7):e0132677.
[25]Yu T, Wu Y, Helman JI, et al. CXCR4 promotes oral squamous cell carcinoma migration and invasion through inducing expression of MMP-9 and MMP-13 via the ERK signaling pathway[J]. Mol Cancer Res, 2011, 9(2):161-172.
[26]王芳. PD184352对舌鳞状细胞癌细胞增殖及ERK蛋白表达的影响[J]. 口腔医学研究, 2007, 23(6):628-630.
[27]Kim SH, Kim SH, Kim YB, et al. Genistein inhibits cell growth by modulating various mitogen-activated protein kinases and AKT in cervical cancer cells[J]. Ann N Y Acad Sci, 2009, 1171:495-500.
[28]Johnson TL, Lai MB, Lai JC, et al. Inhibition of cell proliferation and MAP kinase and Akt pathways in oral squamous cell carcinoma by genistein and biochanin A [J].Evid Based Complement Alternat Med, 2010, 7(3):351-358.
(责任编辑: 卢萍, 罗森)
Genistein inhibits proliferation of human oral cancer TCA8113 cells through suppression of VEGF expression
DAI Hong-liang1, GE Shu-qing2, CHU Ming-hui1, LIANG Chun-guang1, WANG Yue1, JIA Gui-zhi3
(1SchoolofNursing,2DepartmentofStomatology,TheFirstAffiliatedHospital,3DepartmentofBiochemistryandMolecularBiology,LiaoningMedicalUniversity,Jinzhou121001,China.E-mail:jy2006hldai@sohu.com)
[ABSTRACT]AIM: To investigate the effect of genistein on the proliferation of human oral cancer TCA8113 cells and to explore the underlying mechanisms.METHODS: The cell proliferation was examined by MTT assay, cell counting and colony formation assay. Western blotting was employed to examine the protein levels of vascular endothelial growth factor (VEGF), extracellular signal-regulated kinase (ERK) and p-ERK. RESULTS: Genistein significantly inhibited the proliferation of TCA8113 cells in a concentration-dependent fashion. Moreover, genistein dose-dependently decreased the protein levels of VEGF, ERK and p-ERK. The expression of VEGF was also blunted by U0126, a specific inhibitor of ERK. U0126 and axitinib, a VEGF receptor antagonist, both significantly inhibited the proliferation of TCA8113 cells. CONCLUSION: Genistein inhibits the proliferation of TCA8113 cells, which may be related to its inhibitory effect on ERK expression and activation, thus subsequently decreasing the expression of VEGF.
[KEY WORDS]Genistein; TCA8113 cell; Cell proliferation; Vascular endothelial growth factor; Extracellular signal-regulated kinase
doi:10.3969/j.issn.1000- 4718.2016.03.013
[中图分类号]R730.23
[文献标志码]A
通讯作者△Tel: 0416-4673688; E-mail: jy2006hldai@sohu.com
*[基金项目]辽宁省自然科学基金(联合基金)资助项目(No. 2013022037);辽宁医学院校长基金-奥鸿博泽大学生科技创新基金资助项目(No. 2015D20)
[收稿日期]2015- 10- 10[修回日期] 2015- 12- 09
[文章编号]1000- 4718(2016)03- 0464- 06
杂志网址: http://www.cjpp.net
