SphK1和FAK对人结肠癌HCT116细胞上皮间质转化的影响*
2016-04-15诸葛春凤刘诗权覃蒙斌梁梦紫黄杰安
诸葛春凤, 刘诗权, 谭 林, 覃蒙斌, 梁梦紫, 黄杰安
(广西医科大学第一附属医院消化内科,广西 南宁 530021)
SphK1和FAK对人结肠癌HCT116细胞上皮间质转化的影响*
诸葛春凤,刘诗权△,谭林,覃蒙斌,梁梦紫,黄杰安
(广西医科大学第一附属医院消化内科,广西 南宁 530021)
[摘要]目的: 研究鞘氨醇激酶1(sphingosine kinase l,SphK1)和黏着斑激酶(focal adhesion kinase,FAK)对人结肠癌HCT116细胞上皮间质转化(epithelial-mesenchymal transition,EMT)的影响。方法: 将人结肠癌HCT116细胞分成3组:采用SphK1抑制剂N, N-二甲基鞘胺醇(N,N-dimethylsphingosine,DMS)、FAK抑制剂PF573228和相同体积的培养基分别处理细胞。MTT法检测细胞活力,Western blot方法检测SphK1、FAK、E-cadherin、N-cadherin、vimentin和基质金属蛋白酶 2(MMP2)蛋白的表达,real-time PCR检测SphK1、鞘氨醇1-磷酸(S1P)、FAK、E-cadherin 和vimentin mRNA的表达,并应用细胞划痕实验检测肿瘤细胞的迁移能力。结果: PF573228和DMS均明显抑制人结肠癌HCT116细胞的活力, 并呈时间剂量依赖性。DMS抑制SphK1的表达,同时下调FAK、N-cadherin、vimentin和MMP2蛋白的表达,而上调E-cadherin蛋白表达上调。PF573228明显抑制FAK的表达,同时抑制SphK1、N-cadherin、vimentin和MMP2的表达,上调E-cadherin蛋白的表达(P<0.01)。划痕实验显示PF573228和DMS显著抑制HCT116细胞的迁移能力(P<0.01)。与对照组比较,PF573228组和DMS组FAK、SphK1、S1P以及vimentin mRNA的表达明显下调,而E-cadherin mRNA的表达则明显上调(P<0.05)。结论: SphK1和FAK信号通路可能在结肠癌HTC116细胞上皮间质转化过程中发挥重要作用。
[关键词]鞘氨醇激酶1; 黏着斑激酶; 上皮间质转化; 人结肠癌细胞
结肠癌发生侵袭、转移是影响结肠癌预后的关键因素,是导致患者死亡的主要的原因[1],越来越多的研究发现上皮间质转化(epithelial-mesenchymal transition,EMT)在肿瘤发生、发展及转移过程中扮演了至关重要的角色[2]。然而,EMT在结肠癌中的作用及其机制尚不明确。
黏着斑激酶(focal adhesion kinase,FAK)是一种非受体分子量为125 kD的蛋白酪氨酸激酶,在结构上分为4个功能域:在N端附近的FERM区域、中央催化激酶域、3个富含脯氨酸的区域PRⅠ、PRⅡ、PRⅢ和在C末端附近的黏着斑目标域,FAK的羧基端存在多个位点,可与细胞骨架蛋白和信号转导蛋白结合,其功能可能是将多种蛋白聚集在一起而发挥其生物学功能。研究发现FAK在包括结肠癌在内的肿瘤细胞的黏附、侵袭、转移及EMT中均发挥了重要的作用[3-4]。对结肠癌的研究发现下调FAK或使用FAK抑制剂,可增强E-cadherin的表达并增加细胞的黏附性,同时抑制肿瘤细胞扩散转移[5]。表明FAK可能参与了结肠癌细胞EMT的发生,但其机制目前尚不明确。我们以前的研究发现鞘氨醇激酶1(sphingosine kinase 1,SphK1)可调控FAK在结肠癌细胞中的表达而参与肿瘤细胞的侵袭和转移[6]。因此,SphK1和FAK可能在结肠癌EMT发生过程中发挥重要作用。
本研究中,我们采用SphK1抑制剂DMS和FAK抑制剂PF573228调控结肠癌HCT-116细胞SphK1和FAK的表达,观察细胞的增殖、迁移以及对EMT相关标志物表达的影响,了解SphK1和FAK对结肠癌细胞EMT的影响及其机制。
材料和方法
1主要材料和试剂
结肠癌HCT116细胞购自中国科学院细胞库;四氮唑蓝(methyl thiazolyl tetrazolium,MTT)、SphK1抑制剂N,N-二甲基鞘胺醇(N,N-dimethylsphingosine,DMS)购自Sigma;FAK抑制剂PF573228(Selleck);兔抗人GAPDH、E-cadherin、N-cadherin和FAK单克隆抗体购自CST;兔抗人vimentin和基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)单克隆抗体购自Proteintech;RNAsio、逆转录聚合酶链反应试剂和SYBR® Premix Ex TaqTMⅡ (Tli RNaseH Plus)购自Roche;IRDye800标记的羊抗兔 II 抗(LiCor);胎牛血清(fetal bovine serum,FBS)购自ExCell;DMEM高糖培养基购自Gibco。
2方法
2.1细胞培养人结肠癌HCT116细胞株用含10%胎牛血清的培养液培养于5%CO2、37℃的细胞培养箱中,细胞在培养瓶中长满约90%时传代。传代时常规吸去培养液,PBS润洗3遍后用0.25%的胰蛋白酶消化,按所需细胞密度接种,取对数生长期细胞用于实验。
2.2MTT法测定HCT116细胞的细胞活力取对数生长期细胞制成细胞悬液, 细胞密度调整为1.5×107/L, 接种至96孔板,每孔200 μL(3 000个细胞),实验分control组、FAK抑制组和Sphk1抑制组,每组重复3孔。置于恒温培养箱培养,培养12 h,细胞贴壁后,药物处理。FAK抑制剂PF573228浓度分别为1、10、20和30 μmol/L,处理0 h、24 h、48 h和72 h;Sphk1抑制剂DMS浓度分别为1、5、10和15 μmol/L, 处理0 h、6 h、12 h、24 h、48 h,每孔加入MTT 20 μL(5 g/L), 继续避光培养4 h,检测时弃上清,加入二甲基亚砜(DMSO)150 μL,避光振荡 10 min,上酶标仪,在490 nm波长处测定吸光度(A)值, 以空白试剂组为对照,计算细胞生存率,细胞生存率(%)=(加药孔A值/对照孔A值)×100%,重复实验3次。
2.3Real-time PCR检测mRNA的表达药物处理细胞48 h后,用 RNAsio提取细胞总RNA,并采用分光光度计检测RNA浓度及纯度。取1μg总RNA按逆转录说明书合成cDNA备用。以GAPDH作为内参照,每组设3个复孔。GAPDH的上游引物序列为5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物序列为5’-TGGTGAAGACGCCAGTGGA-3’;SphK1的上游引物序列为5’-GGCTTCATTGCTGATGTGGA-3’,下游引物序列为5’-AGGAAGGTGCCCAGAGTGAA-3’;鞘氨醇1-磷酸(sphingosine-1-phosphate)(S1P)的上游引物序列为5’-GGACTTCATGGATCATCCGTTTG-3’,下游引物序列为5’-CCATTTGATCAGCAGGGTTATTCAG-3’;FAK的上游引物序列为5’-CAACCACCTGGGCCAGTATTATC-3’,下游引物序列为5’-CCATAGCAGGCCACATGCTTTA-3’;E-cadherin的上游引物序列为5’-GAGTGCCAACTGGACCATTCAGTA-3’,下游引物序列为5’-AGTCACCCACCTCTAAGGCCATC-3’。数据采用相对双ΔCt法,按公式2-ΔΔCt行定量分析。
2.4Western blot法检测蛋白的表达分组处理细胞继续培养48 h后提取总蛋白,BCA法测蛋白含量。各组取200 μg蛋白上样,聚丙烯酰胺凝胶电泳后转移至PVDF膜,用含50 g/L脱脂奶粉配置的牛奶封闭1 h后4 ℃下 I 抗孵育过夜,次日室温孵育荧光 II 抗1 h,应用Odyssey 3.0仪器扫膜显影,使用Quantity-one软件分析灰度值。以GAPDH为内参照,蛋白相对表达强度=目的蛋白A值/内参照A值。
2.5划痕实验检测细胞迁移能力分组处理细胞分别制备成单细胞悬液,以每孔5×104个分别接种到6孔板,每组细胞设3个复孔。5% CO2、37 ℃孵育24 h,用高压消毒过的200 μL移液器枪头于6孔板底部划“一”字痕,PBS冲洗3遍,彻底洗脱划下细胞。加入新鲜无血清培养液分别培养至0 h、24 h和48 h后,在倒置相差显微镜观察划痕边缘细胞迁移情况并拍照,应用Photoshop图像处理软件分析细胞迁移程度。
3统计学处理
应用 SPSS 16.0统计学软件进行数据分析,以上实验均重复3次,计量资料以均数±标准差(mean±SD)表示,组间比较采用t检验或是单因素方差分析(one-way ANOVA),各组间均数差异采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1PF573228和DMS对HCT-116细胞mRNA表达的影响
与对照组比较,PF573228组和DMS组FAK、 SphK1、S1P和vimentin的mRNA表达显著下降(P<0.05),而E-cadherin的mRNA表达则显著上调(P<0.05),见表1。
表1各组mRNA的相对表达量
Table 1.The relative mRNA expression in human colon cancer HCT116 cells (Mean±SD.n=3)

NameControlPF573228DMSSphK11.000.21±0.08**0.55±0.10**FAK1.000.16±0.01**0.38±0.03**S1P1.000.08±0.01**0.30±0.06**E-cadherin1.001.56±0.21*2.39±0.30**Vimentin1.000.24±0.08**0.30±0.06**
*P<0.05,**P<0.01vscontrol group.
2PF573228和DMS对HCT-116细胞存活率的影响
PF573228和DMS对HCT-116细胞存活率均具有抑制作用, 并呈时间剂量依赖性,见图1。
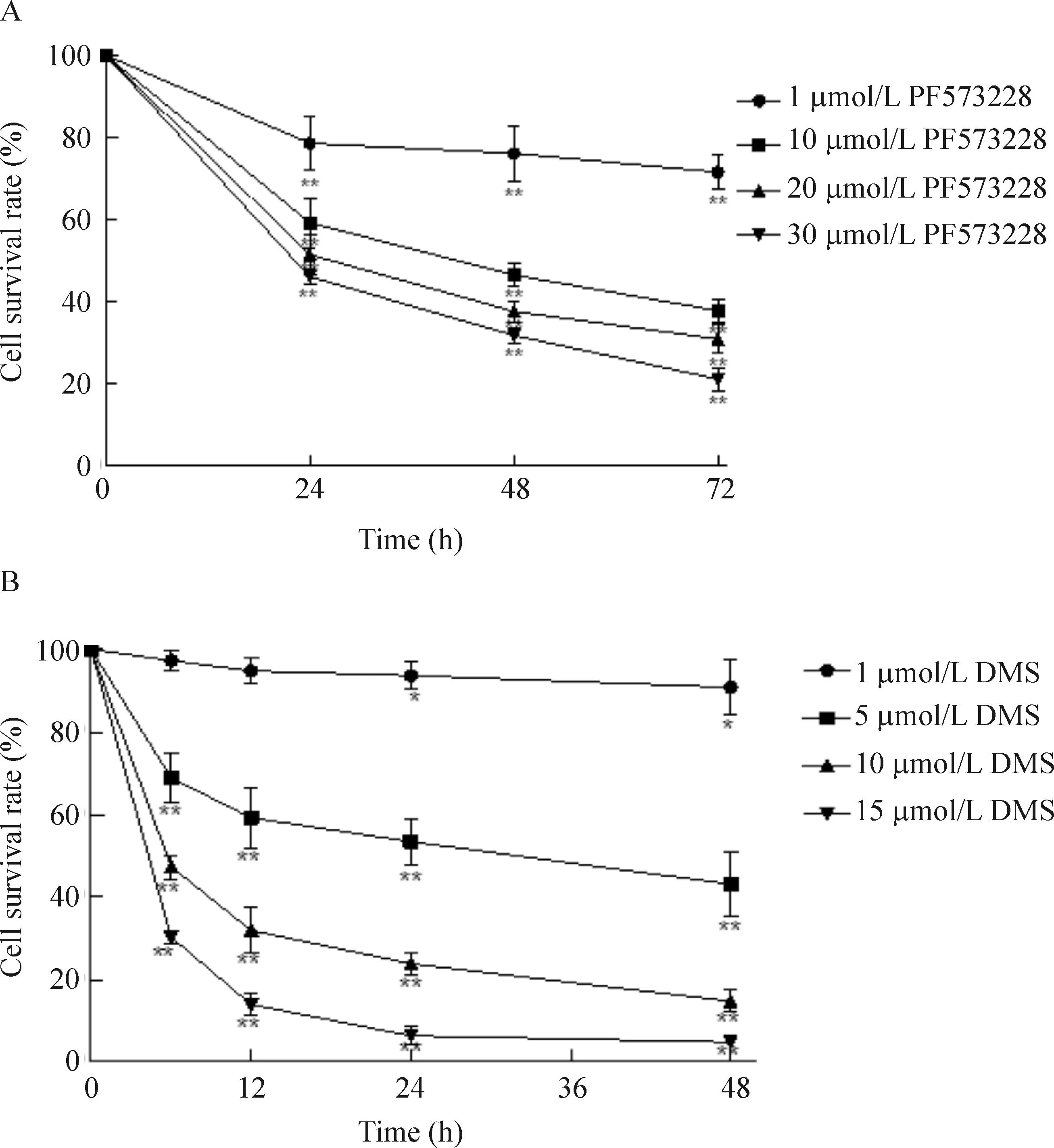
Figure 1.The effects of PF573228 (A) and DMS (B) on the cell viability. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图1PF573228和DMS对HCT-116细胞生存率的影响
3FAK、SphK1、MMP2以及EMT相关蛋白的表达
Western blot结果显示HCT-116细胞中存在FAK、SphK1、侵袭相关蛋白MMP2以及EMT相关指标(N-cadherin、E-cadherin、vimentin)的蛋白表达基础,与control组比较,DMS抑制SphK1、FAK、N-cadherin、vimentin和MMP2蛋白的表达,而上调E-cadherin蛋白表达。PF573228明显抑制FAK、SphK1、N-cadherin、vimentin和MMP2的表达,但上调E-cadherin蛋白的表达(P<0.01),见图2。
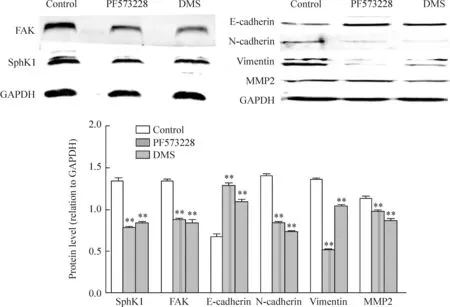
Figure 2.The effects of PF573228 and DMS on the protein expression of SphK1, FAK, E-cadherin, N-cadherin, vimentin and MMP2 in colon cancer HCT116 cells. Mean±SD.n=3.**P<0.01vscontrol group.
图2PF573228和DMS对FAK、SphK1、N-cadherin、E-cadherin、vimentin和MMP2蛋白表达的影响
4细胞迁移能力的比较
如图3所示,在3组细胞内划出相同宽度的痕迹,0 h、24 h、48 h后观察细胞划痕处的迁移情况,48 h时control组细胞迁移距离为(139.95±13.40)μm,PF573228组为(42.95±12.18)μm,DMS组为(50.09±9.70)μm,可见PF573228和DMS组较对照组的细胞迁移速度慢,提示PF573228和DMS能抑制细胞的迁移能力(P<0.01)。
讨论
我国大肠癌发病率和死亡率位居全部恶性肿瘤的第4位[7]。我国结肠癌发病率呈现逐渐上升趋势,治疗结肠癌的关键环节之一是找到触发其发生发展的始动因素,随着分子靶向治疗研究的逐渐深入,越来越多与肿瘤有关通路的分子靶向治疗的出现使结肠癌有了新的治疗手段。目前,阻断结肠癌转移是治疗结肠癌的的关键。而大量的研究显示,上皮间质转化在肿瘤发生、侵袭和转移中扮演了至关重要的角色[2]。 EMT是指在生理和病理情况下具有极性的上皮细胞失去极性,黏附能力下降,从而极易脱离周围细胞而发生迁移和转移,并转化为具有间质表型的细胞过程[8]。EMT不仅包括细胞形态学的改变,还包括以下标志物表达的改变:上皮细胞标志性蛋白E-cadherin 表达减少或失表达,间质标志性物(如N-cadherin、vimentin、fibronectin等)和某些转录因子(如Twist、Slug、Snail等)表达上调[9]。同时,研究显示发生EMT的肿瘤细胞中基质金属蛋白酶分泌可增高[10]。研究显示EMT在促进乳腺癌、卵巢癌、结肠癌、肺癌和肝癌等多种细胞株的侵袭迁移中发挥重要作用[11-15]。
FAK是细胞胞质中一种重要的非受体蛋白酪氨酸激酶,在细胞骨架重组和调节肿瘤侵袭转移中扮演重要的角色。FAK分子氨基端含有同整合素β亚单位、细胞骨架蛋白和信号传导蛋白结合的位点,与整合素等介导的信号传导物质结合从而发挥调节一系列包括细胞黏附、迁移、骨架重组、增殖等作用。本研究也证实 PF573228抑制FAK的表达并明显抑制结肠癌细胞的活力。此外,Lark等[16]研究发现,FAK在已发生转移的结肠癌组织表达明显升高,我们实验组研究也发现 FAK在结肠癌组织表达相比癌旁组织表达升高,且FAK和p-FAK在癌组织的蛋白水平增高与肿瘤的分化程度、Dukes’分期、淋巴结及远处转移密切相关[17]。Chen等[5]研究表明姜黄素能抑制S1P、FAK和CD24,上调E-cadherin的表达而抑制EMT的发生。在大肠癌SW480的研究中,敲除FAK基因,并将细胞移植到裸鼠体内成瘤,结果显示瘤体明显减小[18]。本研究使用FAK抑制剂PF573228特异性地抑制FAK活性,而引起间质标志物N-cadherin 、vimentin的下调,而在侵袭转移中起关键作用的上皮标志物E-cadherin表达增加,表明FAK在调控结肠癌细胞EMT中可能发挥重要作用。

Figure 3.The effects of PF573228 and DMS on the migration of colon cancer HCT116 cells (×100). Mean±SD.n=3.**P<0.01vscontrol group.
图3各实验组细胞的迁移情况
此外,研究表明FAK信号通路在促进MMPs的分泌,尤其是调节MMP2和MMP9的分泌中发挥重要的作用,MMPs是EMT间质性标志分子,能破坏细胞外基质,诱导血管生成,从而引起肿瘤细胞的增殖和浸润[19]。本研究显示抑制FAK的表达,MMP2的表达也明显减弱,表明FAK调控MMP2可能与结肠癌EMT密切相关。
SphK1是鞘脂代谢平衡的关键酶,通过激活催S1P,降低神经酰胺和鞘氨醇,从而促进细胞存活和增殖。研究发现,过表达SphK1能引起非小细胞肺癌A549细胞侵袭转移能力明显增强,并且下调E-cadherin, 而上调fibronectin和vimentin表达,从而促进EMT的发生[20]。而在肝癌细胞的研究中发现,HepG2细胞中的SphK1高表达,使用SphK1的抑制剂抑制SphK1时发现FAK的表达减少,肿瘤细胞的侵袭转移能力减弱,说明SphK1可能通过作用于FAK信号通路增强了肿瘤远处转移的能力[21]。但在结肠癌中,有关SphK1信号通路是否参与了EMT发生的研究甚少。此外,有研究发现激活SphK1活性可上调FAK及其磷酸化水平,表明SphK1可能通过调控FAK通路而引起结肠癌发生侵袭转移[22]。本研究发现抑制SphK1可致EMT相关上皮标志物E-cadherin表达增加,FAK及间质标志物N-cadherin、vimentin等表达减少或缺失,同时肿瘤细胞的迁移能力明显受到抑制,结果表明SphK1可能参与了HCT16结肠癌细胞EMT的发生,并可能通过作用于FAK的羧基端而调控FAK的表达。然而,研究还发现抑制FAK同时SphK1的表达也受到抑制,表明FAK与SphK1之间可能存在负反馈调节。综上所述,SphK1和FAK通路可能相互作用共同参与结肠癌细胞上皮间质转化。
[参考文献]
[1]Zhao H,Xu Z,Qin H, et al.miR-30b regulates migration and invasion of human colorectal cancer via SIX1[J]. Biochem J, 2014, 460(1):117-125.
[2]Wang L,Wu Y,Lin L, et al.Metastasis-associated in colon cancer-1 upregulation predicts a poor prognosis of gastric cancer, and promotes tumor cell proliferation and invasion[J]. Int J Cancer, 2013, 133(6):1419-1430.
[3]Golubovskaya VM.Targeting FAK in human cancer: from finding to first clinical trials[J]. Front Biosci (Landmark Ed), 2014, 19:687-706.
[4]Garouniatis A,Zizi-Sermpetzoglou A,Rizos S, et al.FAK, CD44v6, c-Met and EGFR in colorectal cancer parameters: tumour progression, metastasis, patient survival and receptor crosstalk[J]. Int J Colorectal Dis, 2013, 28(1):9-18.
[5]Chen CC,Sureshbabul M,Chen HW, et al.Curcumin suppresses metastasis via Sp-1, FAK inhibition, and E-cadherin upregulation in colorectal cancer[J]. Evid Based Complement Alternat Med, 2013, 2013:541695.
[6]刘诗权,苏颖洁,黄杰安,等.鞘氨醇激酶1通过调控黏着斑激酶和黏附分子的表达促进结肠癌细胞的增殖和侵袭[J]. 中华肿瘤杂志, 2013, 35(5):331-336.
[7]Li M, Gu J.Changing patterns of colorectal cancer in China over a period of 20 years[J]. World J Gastroenterol, 2005, 11(30):4685-4688.
[8]Creighton CJ,Chang JC, Rosen JM.Epithelial-mesenchymal transition (EMT) in tumor-initiating cells and its clinical implications in breast cancer[J]. J Mammary Gland Biol Neoplasia, 2010, 15(2):253-260.
[9]Lander R,Nasr T,Ochoa SD, et al.Interactions between Twist and other core epithelial-mesenchymal transition factors are controlled by GSK3-mediated phosphorylation[J]. Nat Commun, 2013, 4:1542.
[10]Orlichenko LS, Radisky DC.Matrix metalloproteinases stimulate epithelial-mesenchymal transition during tumor development[J]. Clin Exp Metastasis, 2008, 25(6):593-600.
[11]屈洪波,吴诚义,范原铭,等. 沉默FOXC2对TGF-β1诱导的MCF-7细胞上皮-间质转化的逆转作用[J]. 中国病理生理杂志, 2013, 29(5):850-856.
[12]Chen D,Wang J,Zhang Y, et al.Effect of down-regulated transcriptional repressor ZEB1 on the epithelial-mesenchymal transition of ovarian cancer cells[J]. Int J Gynecol Cancer, 2013, 23(8):1357-1366.
[13]Wang H,Wang HS,Zhou BH, et al.Epithelial-mesenchymal transition (EMT) induced by TNF-alpha requires AKT/GSK-3beta-mediated stabilization of snail in colorectal cancer[J]. PLoS One, 2013, 8(2):e56664.
[14]Rhodes LV,Martin EC,Segar HC, et al.Dual regulation by microRNA-200b-3p and microRNA-200b-5p in the inhibition of epithelial-to-mesenchymal transition in triple-negative breast cancer[J]. Oncotarget, 2015,6(18):16638-16652.
[15]李航宇,李岩,刘丹,等. 细胞外HSP70/HSP70-PCs对人肝癌HepG2细胞上皮-间充质转化的影响及机制研究[J]. 中国病理生理杂志, 2013, 29(9):1631-1636.
[16]Lark AL,Livasy CA,Calvo B, et al.Overexpression of focal adhesion kinase in primary colorectal carcinomas and colorectal liver metastases: immunohistochemistry and real-time PCR analyses[J]. Clin Cancer Res, 2003, 9(1):215-222.
[17]Liu SQ,Su YJ,Qin MB, et al.Sphingosine kinase 1 promotes tumor progression and confers malignancy phenotypes of colon cancer by regulating the focal adhesion kinase pathway and adhesion molecules[J]. Int J Oncol, 2013, 42(2):617-626.
[18]Lei K,Ye L,Yang Y, et al.RNA interference-mediated silencing of focal adhesion kinase inhibits growth of human colon carcinoma xenograft in nude mice[J]. J Biomed Nanotechnol, 2010, 6(3):272-278.
[19]Sein TT,Thant AA,Hiraiwa Y, et al.A role for FAK in the Concanavalin A-dependent secretion of matrix metalloproteinase-2 and -9[J]. Oncogene, 2000, 19(48):5539-5542.
[20]Ni M,Shi XL,Qu ZG, et al.Epithelial mesenchymal transition of non-small-cell lung cancer cells A549 induced by SPHK1[J]. Asian Pac J Trop Med, 2015, 8(2):142-146.
[21]Zhang C,He H,Zhang H, et al.The blockage of Ras/ERK pathway augments the sensitivity of SphK1 inhibitor SKI II in human hepatoma HepG2 cells[J]. Biochem Biophys Res Commun, 2013, 434(1):35-41.
[22]苏颖洁,黄杰安,刘诗权,等.SphK1对结肠癌lovo细胞的增殖、迁移和凋亡的影响[J]. 世界华人消化杂志, 2012, 20(4):276-281.
(责任编辑: 林白霜, 余小慧)
Effects of SphK1 and FAK on epithelial-mesenchymal transition in colon cancer HCT116 cells
ZHUGE Chun-feng, LIU Shi-quan, TAN Lin, QIN Meng-bin, LIANG Meng-zi, HUANG Jie-an
(DepartmentofGastroenterology,FirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China.E-mail:poempower@163.com)
[ABSTRACT]AIM: To investigate the effects of sphingosine kinase l (SphK1) and focal adhesion kinase (FAK) on the epithelial-mesenchymal transition (EMT) of human colon cancer HCT116 cells. METHODS: Human colon cancer HCT116 cells were divided into 3 groups. N, N-dimethylsphingosine (DMS) was used to suppress the activity of SphK1. PF573228 was used to suppress the activation of FAK. The cells treated with equal volume of culture medium severed as control group. The cell viability was measured by MTT assay. The protein expression of SphK1, FAK and the EMT relative protein E-cadherin, N-cadherin, vimentin and matrix metalloproteinase (MMP) 2 was analyzed by Western blot. The mRNA expression of SphK1, sphingosine-1-phosphate (S1P), FAK, E-cadherin and vimentin was detected by real-time PCR. The ability of tumor cell migration was measured by wound-healing assay. RESULTS: The cell viability of HCT116 cells was suppressed by DMS and PF573228 in dose and time dependent manners. DMS significantly suppressed the expression of SphK1, FAK, N-cadherin, vimentin and MMP2, meanwhile enhanced the expression of E-cadherin. PF573228 reduced the expression of FAK , SphK1, N-cadherin, vimentin and MMP2, meanwhile increased the expression of E-cadherin (P<0.01). In addition, the migration ability of HCT116 cells was significantly decreased by treating with DMS and PF573228 (P<0.01). Compared with control group, the mRNA expression of FAK, SphK1, S1P and vimentin was decreased, while the expression of E-cadherin was increased significantly in PF573228 group and DMS group (P<0.05). CONCLUSION: SphK1 and FAK signaling pathways may play an important role in the occurrence of EMT in the colon cancer HCT116 cells.
[KEY WORDS]Sphingosine kinase 1; Focal adhesion kinase; Epithelial-mesenchymal transition; Human colon cancer cells
doi:10.3969/j.issn.1000- 4718.2016.03.009
[中图分类号]R730.23
[文献标志码]A
通讯作者△Tel: 0771-5356501;E-mail: poempower@163.com
*[基金项目]国家自然科学基金资助项目(No.81460380);广西自然科学基金资助项目(No. 2011GXNSFA018182);广西卫生厅基金资助项目(No. GZKZ10-107)
[收稿日期]2015- 08- 10[修回日期] 2015- 12- 24
[文章编号]1000- 4718(2016)03- 0439- 06
杂志网址: http://www.cjpp.net
