上皮性卵巢癌中PARP-1的表达及其与EMT的关系*
2016-04-15张灿灿林雪艳田永杰
张灿灿, 尉 蔚, 林雪艳, 田永杰
(山东大学附属省立医院妇产科,山东 济南 250021)
上皮性卵巢癌中PARP-1的表达及其与EMT的关系*
张灿灿,尉蔚,林雪艳,田永杰△
(山东大学附属省立医院妇产科,山东 济南 250021)
[摘要]目的: 探讨上皮性卵巢癌(epithelial ovarian cancer,EOC)中聚腺苷二磷酸核糖聚合酶-1[poly(ADP-ribose) polymerase-1,PARP-1]的表达及其与上皮-间质转化(epithelial-mesenchymal transition,EMT)的关系。方法: 免疫组化、实时荧光定量PCR法检测EOC和良性卵巢肿瘤组织中PARP-1、E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)和转录调控因子Snail的表达;Western blotting法检测高效PARP-1抑制剂PJ34处理SKOV3细胞后PARP-1、E-cadherin、vimentin和Snail蛋白的表达。结果: PARP-1、vimentin和Snail在EOC中阳性表达率高于良性卵巢肿瘤组织,而E-cadherin则相反,差异均有统计学显著性(P<0.05)。PARP-1、E-cadherin、vimentin和Snail与EOC的病理分级、临床分期和有无淋巴结转移有关(P<0.05),与年龄和病理类型无关。E-cadherin表达与PARP-1表达呈负相关(P<0.05),vimentin、Snail表达与PARP-1表达呈正相关(P<0.05)。EOC中PARP-1、vimentin和Snail mRNA的相对表达量高于良性卵巢肿瘤组织,E-cadherin mRNA的相对表达量低于良性卵巢肿瘤组织,差异均具有统计学显著性(P<0.05)。PJ34处理SKOV3细胞后,PARP-1、vimentin和Snail的蛋白水平明显下降,E-cadherin的蛋白水平显著提高,差异有统计学显著性(P<0.05)。结论: PARP-1通过调控E-cadherin、vimentin和Snail的表达促进EOC上皮间质转化。PARP-1及其参与的上皮-间质转化在EOC进展中发挥重要作用。
[关键词]卵巢癌; 聚腺苷二磷酸核糖聚合酶-1; E-钙黏蛋白; 波形蛋白; Snail; 上皮-间质转化
卵巢癌是女性生殖系统常见恶性肿瘤之一,其死亡率高居妇科恶性肿瘤首位。卵巢癌有多种病理类型,但上皮性卵巢癌(epithelial ovarian cancer,EOC)占绝大部分(约90%),研究表明,上皮-间质转化(epithelial-mesenchymal transition,EMT)在上皮源性肿瘤细胞侵袭转移中发挥重要作用。EMT是指上皮细胞转化为间质细胞并获得侵袭迁移能力的过程[1]。聚腺苷二磷酸核糖聚合酶-1(poly ADP-ribose polymerase-1,PARP-1)是存在于多数真核细胞中的蛋白翻译后修饰酶, 在DNA损伤修复,调控细胞增殖、凋亡等方面发挥重要作用[2]。研究发现,PARP-1可能通过调控转录调控因子Snail参与细胞EMT[3]。但关于PARP-1在EOC上皮间质转化及恶性进展中的作用目前尚无深入研究,本论文从组织、细胞两个层面研究PARP-1及EMT标志物——E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)和转录调控因子Snail在EOC中的表达水平并探讨其相关性,进而探究PARP-1在EOC上皮间质转化及恶性进展中的作用。
材料和方法
1组织标本
收集山东大学附属省立医院病理科2012年1月至2014年12月EOC组织标本60例、良性卵巢肿瘤组织标本40例制作病理切片,相关石蜡切片由山东大学附属省立医院病理科提供并完成病理鉴定。另取山东大学附属省立医院妇科2014年1月至2015年5月手术切除并经病理检查确诊的EOC组织54例,良性卵巢肿瘤组织36例,迅速液氮冻存,新鲜病理组织供real-time PCR用。
患者的纳入标准:EOC组选择病理确诊为EOC的手术患者,患者均为第1次手术,且术前未接受放、化疗及免疫治疗;良性卵巢肿瘤组(对照组)选择行良性卵巢肿瘤或囊肿切除术患者,近6个月未服用过激素类药物;所有标本征得患者同意及山东大学附属省立医院伦理委员会许可。排除标准:同时合并有其它恶性肿瘤者。
2细胞株及培养
细胞株SKOV3由山东大学附属省立医院中心实验室提供,用含10%胎牛血清RPMI-1640培养基于37 °C、5% CO2饱和湿度条件下常规培养,取对数生长期细胞进行实验。
3主要试剂
兔抗人PARP-1多克隆抗体和兔抗人E-cadherin多克隆抗体购自CST;兔抗人vimentin单克隆抗体和兔抗人Snail多克隆抗体购自Abcam;免疫组化试剂盒和DAB购自北京中杉金桥生物科技有限公司;TRIzol、反转录试剂盒PrimeScript RT reagent Kit和real-time PCR 试剂盒购自TaKaRa,PCR引物由TaKaRa合成;胎牛血清和RPMI-1640培养基购自HyClone;PJ34购自Merck。
4主要方法
4.1免疫组化法检测PARP-1及EMT标志物(E-cadherin、vimentin和Snail)的表达手术切除标本经固定、石蜡包埋并切成4 μm备用。采用链霉素抗生素蛋白-过氧化酶免疫组化染色法(S-P),分别滴加PARP-1、E-cadherin、vimentin和Snail抗体,PBS代替 I 抗作为阴性对照。
4.2免疫组化结果判定标准以细胞呈棕黄色或棕褐色颗粒为阳性。按半定量积分法在光镜下,随机观察10个高倍镜视野,按每高倍镜视野阳性细胞百分比计分:阳性细胞数< 5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>76%为4分;染色呈淡黄色计为1分,染色呈黄色计为2分,染色呈棕黄色者计为3分。2种计分的乘积即为阳性强度:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性。中度阳性(++)和强阳性(+++)判为阳性。
4.3Real-time PCR法检测PARP-1及EMT标志物(E-cadherin、vimentin和Snail)的mRNA表达按照TRIzol说明书方法提取组织总RNA,测定浓度及纯度后按照反转录试剂盒PrimeScript RT reagent Kit说明书建立反应体系,合成cDNA。按照SYBR-Green试剂盒说明书运用Light Cycler®480II 完成real-time PCR。引物序列见表1。采用2-ΔΔCt法计算mRNA的相对表达量。
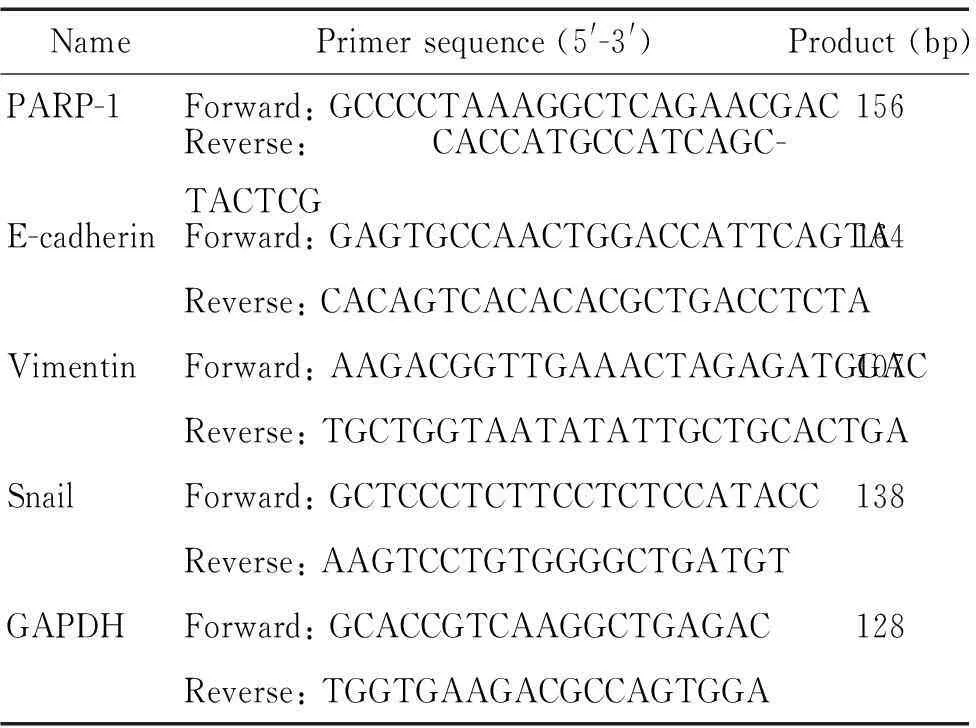
表1 引物序列
4.4Western blotting法检测PJ34处理后SKOV3细胞PARP-1及EMT标志物(E-cadherin、vimentin和Snail)的蛋白表达SKOV3细胞经5 μmol/L PJ34处理24 h后进行蛋白提取及定量,SDS-PAGE分离蛋白,转至0.4 μm PVDF膜,5% 脱脂奶粉室温封闭1 h。分别加入PARP-1、E-cadherin、vimentin、Snail和GAPDH抗体,4 ℃孵育过夜,TBST漂洗5 min 3次,分别加入辣根过氧化物标记的山羊抗兔 II 抗,室温孵育1 h,TBST漂洗10 min 3次,显影,Quantity One软件分析结果,计算灰度值比值。
5统计学处理
采用SPSS 19.0对实验数据进行统计分析,计量资料采用均数±标准差(mean±SD)表示,计量资料间的比较采用t检验,计数资料比较采用2检验,应用Spearman法计算指标间的相关系数,以P<0.05为差异有统计学意义。
结果
1PARP-1及EMT标志物(E-cadherin、vimentin和Snail)在上皮性卵巢肿瘤组织中的表达
PARP-1主要表达于细胞核,部分表达于细胞浆,在EOC中阳性表达率明显高于良性卵巢肿瘤组织(P<0.05);E-cadherin主要表达在细胞膜及细胞浆,在EOC中阳性表达率明显低于良性卵巢肿瘤组织(P<0.05);vimentin主要表达在细胞浆,在EOC中阳性表达率明显高于良性卵巢肿瘤组织(P<0.05);Snail主要表达在细胞浆,在EOC中阳性表达率明显高于良性卵巢肿瘤组织(P<0.05),见图1、表2。
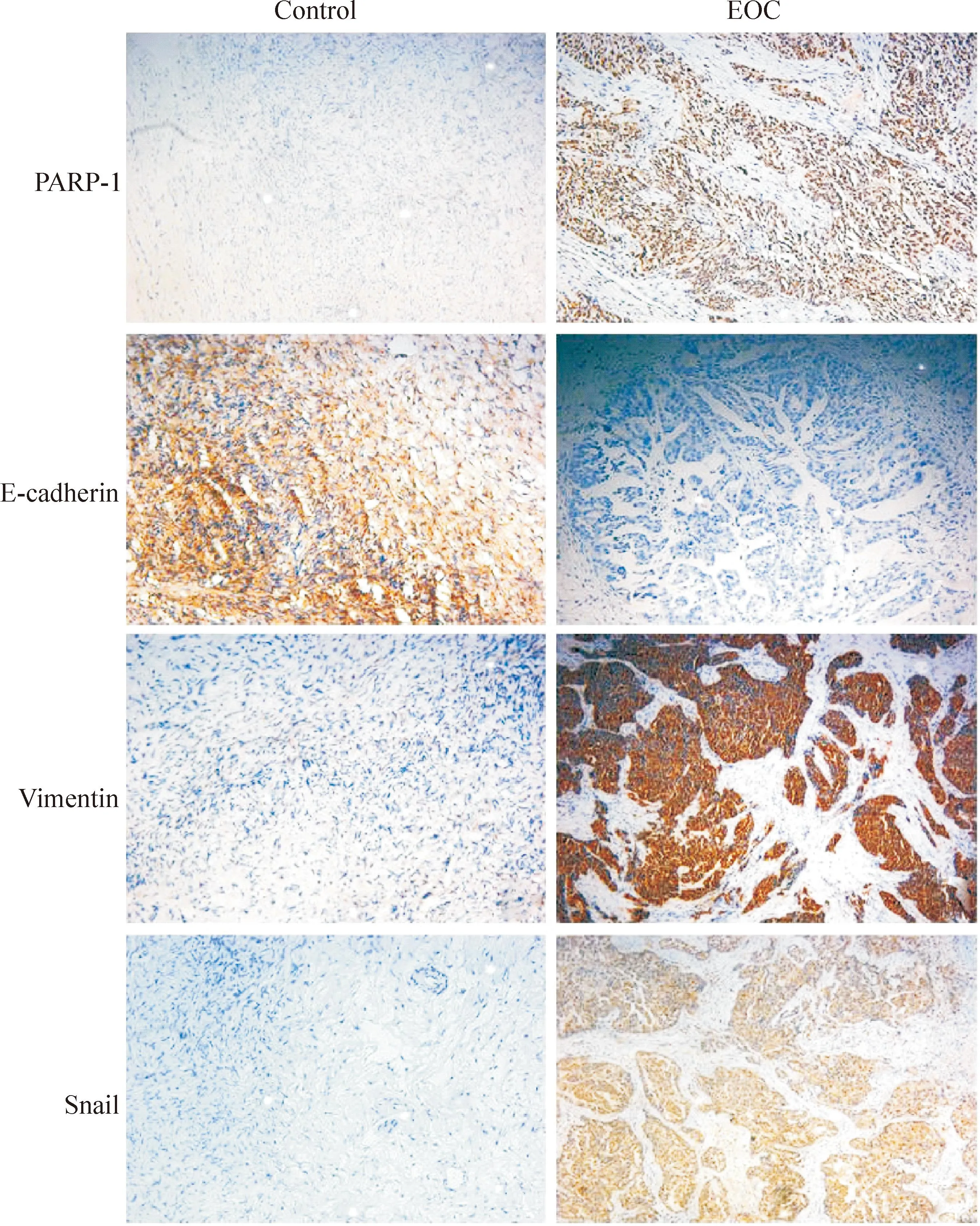
Figure 1.The results of immunohistochemical assay showed that PARP-1 and the markers of EMT (E-cadherin, vimentin and Snail) were expressed in the epithelial ovarian cancer tissues and benign ovarian tumor tissues (control)(×200).
图1免疫组化法检测PARP-1和EMT标志物在上皮性卵巢癌组织及良性卵巢肿瘤组织中的定位及表达
表2上皮性卵巢癌与良性卵巢肿瘤组织中PARP-1和EMT标志物蛋白的表达
Table 2.The expression of PARP-1 and the markers of EMT (E-cadherin, vimentin and Snail) in the epithelial ovarian cancer tissues and benign ovarian tumor tissues (control)

TissuenPARP-1positiveE-cadherinpositiveVimentinpositiveSnailpositiven%n%n%n%Control401127.5%2870.0%820.0%1537.5%EOC604676.7%*1728.3%*2846.7%*3761.7%*
*P<0.05vscontrol.
2PARP-1及EMT标志物(E-cadherin、vimentin和Snail)表达与EOC临床病理间的关系
PARP-1、vimentin、Snail蛋白在EOC G1+G2中阳性表达率低于G3(P<0.05),在I+II期的阳性表达率低于III+IV期(P<0.05),有淋巴结转移组的阳性表达率高于无淋巴结转移组(P<0.05),在不同年龄组和病理类型间的表达差异无统计学显著性。E-cadherin蛋白在EOC G1+G2中阳性表达率高于G3(P<0.05),在I+II期的阳性表达率高于III+IV期(P<0.05),有淋巴结转移组的阳性表达率低于无淋巴结转移组(P<0.05),在不同年龄组和病理类型间的表达差异无统计学显著性,见表3。
表3PARP-1、EMT标志物表达与上皮性卵巢癌临床病理间的关系
Table 3.The relationship between the expression of PARP-1, the markers of EMT (E-cadherin, vimentin, Snail) and the clinical pathology of epithelial ovarian cancer

ClinicalfeaturesnPARP-1positiveE-cadherinpositiveVimentinpositiveSnailpositiven2Pn2Pn2Pn2PAge(years)0.1100.7400.0020.9700.3100.5800.1520.696 ≤50282281218 >50322491619Pathologicaltypes0.5000.4800.0270.8900.3600.5600.8610.353 Serous4536132030 Other1510487Histologicalgrade7.4700.0065.4500.02013.4400.0005.1600.023 G1+G2281712613 G3322952224Clinicalstage6.4100.01013.6100.0009.3000.0025.6400.017 I+II181011167 III+IV423661230Lymphnodemetastasis12.1700.00011.5000.0016.4300.0116.7700.009 Present242411010 Absent3622161827
3EMT标志物(E-cadherin、vimentin和Snail)表达与PARP-1表达间的关系
经Spearman相关系数分析可知E-cadherin表达与PARP-1表达呈负相关(r=-0.412);vimentin表达与PARP-1表达呈正相关(r=0.383);Snail表达与PARP-1表达呈正相关(r=0.259),见表4。
4上皮性卵巢肿瘤组织中PARP-1及EMT标志物(E-cadherin、vimentin和Snail)的mRNA表达
以内参照GAPDH为对照,相对于良性卵巢肿瘤组织,EOC组织PARP-1、vimentin、Snail 的mRNA表达水平明显升高,E-cadherin的mRNA表达水平显著下降,差异有统计学显著性(P<0.05),见图2、表5。
5PJ34处理SKOV3细胞后PARP-1及EMT标志物(E-cadherin、vimentin和Snail)蛋白的表达
高效PARP-1抑制剂PJ34处理SKOV3细胞后,PARP-1、vimentin和Snail 蛋白表达下降,E-cadherin蛋白表达提高;用目的蛋白条带的灰度值比GAPDH灰度值得到各组目的蛋白相对表达量,高效PARP-1抑制剂PJ34处理SKOV3细胞后,PARP-1、vimentin和Snail 蛋白相对表达量下降(P<0.05),E-cadherin蛋白相对表达量提高(P<0.05),见图3。
表4上皮性卵巢癌组织中EMT标志物表达与PARP-1表达的关系
Table 4.The relationship between the expression of EMT markers (E-cadherin, vimentin and Snail) and PARP-1 in the epithelial ovarian cancer tissues
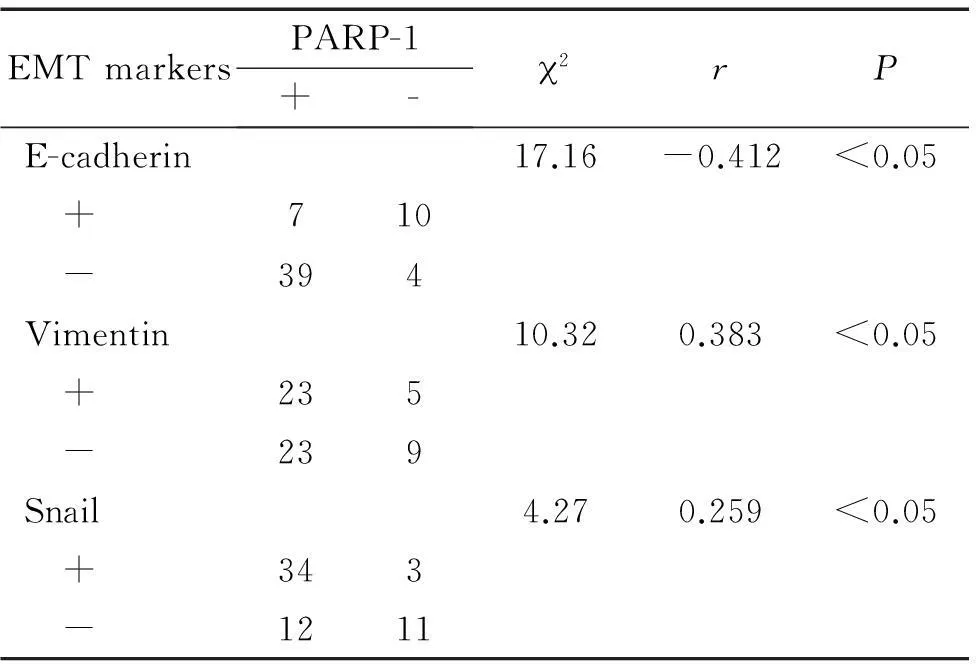
EMTmarkersPARP-1+-2rPE-cadherin17.16-0.412<0.05 +710 -394Vimentin10.320.383<0.05 +235 -239Snail4.270.259<0.05 +343 -1211

Figure 2.The relative mRNA expression of PARP-1 and the markers of EMT (E-cadherin, vimentin and Snail) in the ovarian cancer tissues and the benign ovarian tumor tissues (control). Mean±SD.*P<0.05vscontrol.
图2上皮性卵巢癌及良性卵巢肿瘤组织中 PARP-1和EMT标志物的mRNA相对表达量
表5PARP-1和EMT标志物的2-ΔΔCt数值比较
Table 5.The data of 2-ΔΔCtfor PARP-1 and the markers of EMT (E-cadherin, vimentin and Snail) (Mean±SD)

GroupnPARP-1E-cadherinVimentinSnailControl361.14±0.301.12±0.191.04±0.261.09±0.37EOC541.57±0.54*0.82±0.25*1.39±0.37*1.49±0.49*
*P<0.05vsbenign ovarian tumor (control) group.

Figure 3.The relative protein expression of PARP-1 and the markers of EMT (E-cadherin, vimentin and Snail) in the SKOV3 cells treated with PJ34 determined by Western blotting. Mean±SD.n=3.*P<0.05vsPJ34(-) group.
图3PJ34处理SKOV3细胞后PARP-1及EMT标志物蛋白的表达
讨论
卵巢癌是妇科肿瘤中最常见的癌性死因,约70%的卵巢癌患者确诊时已是晚期。腹腔转移提示晚期卵巢癌患者预后不良,关于卵巢癌细胞从原发肿瘤部位脱离,侵入腹腔的分子机制尚未完全清楚。因此,研究卵巢癌侵袭转移的分子机制有助于制定新的治疗策略。
PARP-1是存在于多数真核细胞中的蛋白翻译后修饰酶,其作用是催化ADP-核糖从烟酰胺腺嘌呤二核苷酸转移到各种受体蛋白,并且通过碱基切除修复方式对单股DNA进行损伤修复,参与DNA的甲基化修饰和转录、细胞信号传导、细胞周期调控及细胞的有丝分裂[4]。近来,其在肿瘤发生及恶性进展中的作用越来越引起研究者的重视[5]。
研究表明,肿瘤发生侵袭转移依赖于内环境的相互作用,其中EMT是主要因素之一[6],EMT通过使上皮型细胞失去正常的上皮表型和极性,获得间质表型和功能,具有间质表型的癌细胞具有从原位迁移的能力,与基质细胞相互作用,浸润邻近组织,或侵入淋巴系统和(或)血循环并定植于其他部位,形成转移灶[7]。已有研究发现,EMT是EOC发生侵袭转移的主要原因之一,在卵巢癌恶性进展中发挥关键性作用[8]。肿瘤细胞上皮间质转化伴随有细胞表面标志物的变化:如上皮型生物标志物E-cadherin表达的下调,间质细胞标志蛋白如vimentin的表达上调,同时伴随着转录调控因子Snail等的活化[9]。
E-cadherin是黏附分子钙依赖性黏附素家族中的一员,E-cadherin的表达减少导致细胞形态的改变、细胞间黏附减弱、细胞活动性增强,是EMT发生的重要标志并在癌症浸润中发挥重要作用[10]。Vimentin是存在于间质细胞中的一种中间丝蛋白,在间质来源肿瘤细胞显示阳性,在上皮来源肿瘤细胞显示阴性,因此vimentin阳性表达提示肿瘤发生上皮间质转化。研究显示,vimentin 在多种侵袭性肿瘤细胞系中表达显著增高,并与肿瘤预后呈负相关[11],与肿瘤的发生、转移密切相关[12]。Snail为锌指蛋白家族Snail的第1个成员,研究表明,Snail本质上是一种转录抑制因子,通过结合E-cadherin启动子的E-box连接基序,而直接抑制E-cadherin的表达,进而诱导EMT,促使肿瘤细胞原位侵袭和远处转移。
PARP-1在上皮间质转化过程中的作用正不断被发现。Pu等[13]发现前列腺癌细胞中PARP-1通过促进转化生长因子β和Smad蛋白表达,使E-cadherin表达下调,N-cadherin表达上调,即PARP-1通过促进TGF-β诱导的EMT促进前列腺肿瘤的发生。Rodríguez等[14]报道在内皮细胞和黑色素瘤细胞中,PARP-1通过调控vimentin诱导的细胞恶性转化从而影响肿瘤转移潜力;使用抑制剂或沉默PARP-1使之失活,可以下调vimentin的表达水平,同时伴随着E-cadherin的升高及Snail水平的下调,逆转细胞的EMT表型。但在EOC中,尚无PARP-1参与EOC EMT的相关研究。
研究表明,PARP-1在多种恶性肿瘤中均存在着过表达现象[15];俞岚等[16]发现与正常卵巢组织相比,EOC组织的E-cadherin表达下降;Handra-Luca 等[17]研究表明,vimentin 在胰腺癌中表达异常增加;Abd 等[18]发现在非小细胞肺癌中存在Snail的过表达现象,本研究结果与上述文献报道相一致。本研究采用免疫组化、real-time PCR法从蛋白水平及mRNA 水平检测良性卵巢肿瘤组织和EOC中PARP-1及EMT标志物E-cadherin、vimentin和Snail的表达,结果显示PARP-1、vimentin和Snail在EOC中的表达高于良性卵巢肿瘤组织,而E-cadherin在EOC中的表达低于良性卵巢肿瘤组织,提示PARP-1和EMT可能参与了EOC的发生。
本研究还发现EOC组织中vimentin和Snail的表达与PARP-1的表达呈正相关,E-cadherin的表达与PARP-1的表达呈负相关,提示随着PARP-1表达增加,vimentin和Snail表达增加,E-cadherin表达减少,细胞间黏附作用降低,促进了EMT的发生。高效PARP-1抑制剂PJ34处理SKOV3细胞后,vimentin和Snail 蛋白水平明显下降,E-cadherin蛋白水平显著提高,提示通过使用抑制剂使PARP-1表达降低,会下调vimentin和Snail的表达水平,同时伴随着E-cadherin表达升高,可逆转细胞的EMT表型。因而推断PARP-1可能通过调控E-cadherin、vimentin和Snail的表达参与EOC的EMT过程。
EMT的发生往往预示着患者预后较差[19-20]。本研究发现PARP-1、vimentin和Snail在早期、高分化、无浸润转移的卵巢癌组织中低表达,而在晚期、低分化、有浸润转移的卵巢癌组织中高表达,而E-cadhe-rin则相反,提示随着卵巢癌临床分期和恶性程度的增加,PARP-1表达增加,vimentin和Snail表达增加,E-cadherin表达减少,进而推测PARP-1及其参与的上皮-间质转化可能参与卵巢癌的进展。
综上所述,PARP-1及EMT在肿瘤的浸润生长和远处转移过程中发挥着重要作用,通过检测PARP-1及EMT标志蛋白在卵巢癌组织中的表达,结合病理分级、分期,可以提高判断肿瘤侵袭、转移程度的准确度,通过多项指标的联合检测,为卵巢癌临床治疗及预后判断提供了有效依据。同时,研究PARP-1和EMT的相关性有助于我们建立新的药物靶点从而对卵巢癌进行靶向干预治疗,为卵巢癌的有效治疗提供更为可靠的依据。
[参考文献]
[1]Cano CE, Motoo Y, Iovanna JL. Epithelial-to-mesenchymal transition in pancreatic adenocarcinoma[J]. Scientific World J, 2010, 10:1947-1957.
[3]Lei P, Jiang Z, Zhu H, et al. Poly (ADP-ribose) polymerase-1 in high glucose-induced epithelial-mesenchymal transition during peritoneal fibrosis[J]. Int J Mol Med, 2012, 29(3):472-478.
[4]Wei MK, Chen AP. PARP inhibitor treatment in ovarian and breast cancer[J]. Curr Probl Cancer, 2011, 35(1):7-50.
[5]Weaver AN, Yang ES. Beyond DNA repair: additional functions of PARP-1 in cancer[J]. Front Oncol, 2013, 3:290.
[6]Frisch SM, Schaller M, Cieply B. Mechanisms that link the oncogenic epithelial-mesenchymal transition to suppression of anoikis[J]. J Cell Sci, 2013, 126(Pt 1):21-29.
[7]Nuti SV, Mor G, Li P, et al. TWIST and ovarian cancer stem cells: implications for chemoresistance and metastasis[J]. Oncotarget, 2014, 5(17):7260-7271.
[8]Elloul S, Vaksman O, Stavnes HT. Mesenchymal-to-epithelial transition determinants as characteristics of ovarian carcinoma effusions[J]. Clin Exp Metastasis, 2010, 27(3):161-172.
[9]Franco-Chuaire ML, Magda Carolina SC, Chuaire-Noack L. Epithelial-mesenchymal transition (EMT): principles and clinical impact in cancer therapy[J]. Invest Clin, 2013, 54(2):186-205.
[10]Schmalhofer O, Brabletz S, Brabletz T. E-cadherin, beta-catenin, and ZEB1 in malignant progression of cancer[J]. Cancer Metastasis Rev, 2009, 28(1-2):151-166.
[11]Dauphin M, Barbe C, Lemaire S, et al. Vimentin expression predicts the occurrence of metastases in non small cell lung carcinomas[J]. Lung Cancer, 2013, 81(1):117-122.
[12]Vuoriluoto K, Haugen H, Kiviluoto S, et al. Vimentin regulates EMT induction by Slug and oncogenic H-Ras and migration by governing Axl expression in breast cancer[J]. Oncogene, 2011, 30(12):1436-1448.
[13]Pu H, Horbinski C, Hensley PJ, et al. PARP-1 regulates epithelial-mesenchymal transition (EMT) in prostate tumorigensis[J]. Carcinogenesis, 2014, 35(11):2592-2601.
[14]Rodríguez MI, Peralta-Leal A, O′Valle F, et al. PARP-1 regulates metastatic melanoma through modulation of vimentin-induced malignant transformation[J]. PLoS Genet, 2013, 9(6):e1003531.
[15]Porcelli L, Quatrale AE, Mantuano P, et al. Optimize radiochemotherapy in pancreatic cancer: PARP inhibitors a new therapeutic opportunity[J]. Mol Oncol, 2013, 7(3):308-322.
[16]俞岚,武世伍,宋文庆,等. 卵巢上皮癌中血管生成拟态和E-钙黏蛋白表达及其临床意义[J]. 中国病理生理杂志, 2011, 27(11):2120-2125.
[17]Handra-Luca A, Hong SM, Walter K, et al. Tumour epithelial vimentin expression and outcome of pancreatic ductal adenocarcinomas[J]. Br J Cancer, 2011, 104(8):1296-1302.
[18]Abd EI-Rehim DM, Abd-Elqhany MI, Nazmy MH. Integrin-linked kinase, Snail and multidrug resistance protein 1: three concordant players in the progression of non-small cell lung cancer[J]. J Egypt Natl Canc Inst, 2015, 27(3):129-137.
[19]Tanaka Y, Terai Y, Kawaquchi H, et al. Prognostic impact of EMT (epithelial-mesenchymal-transition)-related protein expression in endometrial cancer[J]. Cancer Biol Ther, 2013, 14(1):13-19.
[20]Aleskandarany MA, Negm OH, Green AR, et al. Epithelial mesenchymal transition in early invasive breast cancer:an immunohistochemical and reverse phase protein array study[J]. Breast Cancer Res Treat, 2014, 145(2):339-348.
(责任编辑: 林白霜, 余小慧)
Expression of PARP-1 in epithelial ovarian cancer and its relationship with epithelial-mesenchymal transition
ZHANG Can-can, WEI Wei, LIN Xue-yan, TIAN Yong-jie
(DepartmentofObstetrics&Gynecology,ShandongProvincialHospitalAffiliatedtoShandongUniversity,Jinan250021,China.E-mail:tianyongjie@sdu.edu.cn)
[ABSTRACT]AIM: To investigate the expression of poly (ADP-ribose) polymerase-1 (PARP-1) in the epithelial ovarian cancer (EOC) and its relationship with epithelial-mesenchymal transition (EMT). METHODS: The expression of PARP-1, E-cadherin, vimentin and Snail was detected in the EOC and benign ovarian tumor tissues by immunohistochemical method and real-time PCR. The expression of PARP-1, E-cadherin, vimentin and Snail proteins in the SKOV3 cells treated with efficient PARP-1 inhibitor PJ34 was determined by Western blotting. RESULTS: The positive expression rates of PARP-1, vimentin and Snail were significantly higher in the EOC than that in the benign ovarian tumor tissues, whereas the positive expression rate of E-cadherin was the opposite (P<0.05). The expression of PARP-1, E-cadherin, vimentin and Snail in the EOC was associated with the histological grade, clinical stage and lymphatic metastasis (P<0.05), but no relationship with age and pathological types was observed. The expression of E-cadherin in the EOC was negatively co-related to that of PARP-1. In contrast, the expression of vimentin and Snail in the EOC was positively co-related to that of PARP-1. The relative mRNA expression of PARP-1, vimentin and Snail in the EOC was significantly higher than that in the benign ovarian tumor tissues (P<0.05), while the mRNA expression of E-cadherin in the EOC was remarkably lower than that in the benign ovarian tumor tissues (P<0.05). The protein expression of PARP-1, vimentin and Snail in the SKOV3 cells was significantly decreased (P<0.05), while E-cadherin protein was increased after treated with PJ34(P<0.05). CONCLUSION: PARP-1 may contribute to the onset of EMT in the EOC by regulating the expression of E-cadherin, vimentin and Snail. The role of PARP-1, which is relevant to EMT, might be important in the development of ovarian cancer.
[KEY WORDS]Ovarian cancer; Poly (ADP-ribose) polymerase-1; E-cadherin; Vimentin; Snail; Epithelial-mesenchymal transition
doi:10.3969/j.issn.1000- 4718.2016.03.007
[中图分类号]R737.31; R730.23
[文献标志码]A
通讯作者△Tel: 0531-68776384; E-mail: tianyongjie@sdu.edu.cn
*[基金项目]国家自然科学基金应急管理项目(No. 81441075);山东省自然科学基金资助项目(No. ZR2014HM108);山东省自然科学基金青年项目(No. ZR2013HQ030)
[收稿日期]2015- 10- 16[修回日期] 2015- 12- 31
[文章编号]1000- 4718(2016)03- 0425- 07
杂志网址: http://www.cjpp.net
