低氧诱导因子短期活化后诱导miR-29c表达上调可延缓5/6肾切除大鼠的肾病进展
2016-04-12梁怡然衡艳艳俞小芳贾平方艺
梁怡然 衡艳艳 俞小芳 贾平 方艺
(1. 复旦大学附属中山医院肾内科,上海 200032;
2. 长治医学院附属和平医院肾内科,山西长治 046000;
3. 上海市肾脏疾病与血液净化重点实验室,上海 200032;
4. 上海市肾病与透析研究所,上海 200032)
低氧诱导因子短期活化后诱导miR-29c表达上调可延缓5/6肾切除大鼠的肾病进展
梁怡然1Δ衡艳艳2Δ俞小芳1,3,4贾平1,3,4方艺1,3,4
(1. 复旦大学附属中山医院肾内科,上海200032;
2. 长治医学院附属和平医院肾内科,山西长治046000;
3. 上海市肾脏疾病与血液净化重点实验室,上海200032;
4. 上海市肾病与透析研究所,上海200032)
摘要目的: 探讨适度活化低氧诱导因子(hypoxia-inducible factor, HIF)对延缓残肾慢性肾脏病进展的作用及可能机制。方法: 雄性SD大鼠采用二步法5/6肾大部切除术建立残肾模型,随机分为L-mimosine (L-Mim)治疗组(术后5~12周短期给予脯氨酸羟化酶抑制剂,隔日50 mg/kg腹腔给药)和未治疗残肾组,同时设立假手术对照组。术后12周末处死大鼠留取标本。结果: L-Mim治疗组大鼠血肌酐水平[(82.4±6.3)比(130.1±24.1) μmol/L, P<0.05]、24 h尿蛋白水平[(0.7±0.1)比(1.7±0.5) g/d, P<0.05]以及残肾病理改变较未治疗残肾组大鼠有显著改善。miRNA芯片分析结果提示:L-Mim治疗组肾皮质miR-29c丰度高于未治疗残肾组,伴HIF-1α和HIF-2α表达增强。经荧光素酶报告检测系统和体外突变实验明确原肌球蛋白1(TPM1)为miR-29c靶基因之一。HK2细胞转染pre-miR-29c寡核苷酸后可以抑制TGF-β1 (3 ng/mL, 24 h)诱导的原肌球蛋白水平上调(P<0.05或0.01)。结论: 大鼠残肾肾间质纤维化病变明显并伴miR-29c水平下调,适度活化HIF水平可通过上调miR-29c表达延缓残肾功能恶化。
关键词miR-29c;肾小管间质纤维化;低氧诱导因子;原肌球蛋白1
Short-Term Activation of Hypoxia-Inducible Factor Slows Kidney Disease Progression in Rat Model of 5/6 Subtotal Nephrectomy by Up-regulating MiR-29c Expression
LIANGYiran1ΔHENGYanyan2ΔYUXiaofang1,3,4JIAPing1,3,4FANGYi1,3,4
1.DepartmentofNephrology,ZhongshanHospital,FudanUniversity,Shanghai200032,China; 2.DepartmentofNephrology,HepingHospitalAffiliatedtoChangzhiMedicalCollege,Changzhi046000,China; 3.ShanghaiKeyLaboratoryofKidneyandBloodPurification,Shanghai200032,China; 4.ShanghaiInstituteofKidneyandDialysis,Shanghai200032,China
AbstractObjective: To investigate the role and probable mechanism of moderate activation of hypoxia-inducible factor(HIF) in slowing chronic kidney disease progression of remnant kidney.Methods: Rat models of remnant kidney were established by 5/6 subtotal nephrectomy in male Sprague-Dawley rats. And then they were randomly allocated to L-mimosine(L-Mim) treatment group, in which the rats were treated with intraperitoneal injections of L-Mim during 5-12 week after operation, and untreated remnant kidney group. Meanwhile, sham operated rats were set as control group. All rats were sacrificed at the end of week 12, and the specimens were collected. Results: The serum creatinine level in L-Mim treatment group was lower than that in untreated remnant kidney group(82.4±6.3 vs. 130.1±24.1 μmol/L,P<0.05), as well as the 24 h Ualblevel (0.7±0.1 vs. 1.7±0.5 g/d,P<0.05). And the pathological changes in in L-Mim treatment group was slightly improved while compared to untreated remnant kidney group. The result of miRNA microarray analysis showed that miR-29c in renal cortex was up-regulated in L-Mim group compared with untreated remnant group and meanwhile the expressions of HIF-1α and HIF-2α increased. Tropomyosin 1 (TPM1) met the sequence criteria for microRNA-target interaction, which was later confirmed by luciferase reporter system and mutation test in vitro. HK2 cell transfected with pre-miT-29c oligonucleotide could inhibit the tropomyosin up-regulation induced by TGF-β1treatment (3 ng/mL, 24 h),P<0.05 or 0.01.Conclusions: Renal interstitial fibrosis in rat remnant kidney was significant, and it was accompanied by the miR-29c down-regulation. Moderate activation of HIF level may attenuate the deterioration of renal function by up-regulating miR-29c expression.
Key WordsMiR-29c;Renal tubulointerstitial fibrosis;Hypoxia-inducible factor;Tropomyosin-1
肾小管间质纤维化是所有慢性肾脏疾病的共同病理特征,也是各种慢性肾脏疾病进展至终末期肾衰竭的共同途径[1]。肾小管间质的缺血损伤是导致肾小管间质病变进行性发展的重要机制[2-3],而缺氧又是缺血损伤中的始动环节。因此,作为维持氧自稳平衡的核心调控因子的低氧诱导因子(hypoxia-inducible factor, HIF)在肾脏缺血缺氧损伤中起着重要的调节作用。但HIF本身不能直接感应氧浓度的变化,常氧条件下HIF-α极不稳定,经脯氨酸羟化酶(prolyl-4-hydroxylase domain, PHD)催化发生羟基化,羟基化修饰后的HIF-α迅速与pVHL(von Hippel-Lindau protein)蛋白结合,经泛素蛋白酶体途径降解。与此相反,低氧状态下,PHD羟基化HIF-α反应受阻,故HIF-α表达上调[4]。因此,PHD构成了转录因子HIF-α低氧诱导功能的开关,前期研究亦证实通过化学方法抑制PHD后可以稳定HIF-α活性[5-6]。
微小RNA (microRNAs,miRNAs) 是一类内源性非蛋白质编码RNA分子,通过完全/不完全与靶 mRNAs 的3’非翻译区(3’-UTR)互补结合,剪切靶 mRNAs或抑制其翻译,从而调控细胞的多种生物学行为。miRNAs在缺氧导致的一系列生理或病理反应中起重要调节作用[7],尤其是一簇冠名为低氧相关的miRNAs,即HRMs(hypoxia-regulated microRNAs)在HIF介导的缺血缺氧损伤的即时和长期适应性反应中起重要作用[8]。目前认为HIF对下游基因的调控有两条途径:一是经典途径,HIF对下游基因表达的直接调控;二是近年来发现的新途径,HIF通过调控缺氧调节的microRNAs (hypoxia-regulated microRNA, HRMs)来间接调控靶基因。单一miRNAs可调控一组相关基因的表达,并且HRMs在转录后水平影响基因翻译,不涉及靶基因转录,直接影响靶基因蛋白表达水平[9]。在HIF的基因调控中,HRMs途径可能起着更为重要的作用,而以HRMs为靶点的干预可能成为新的更有效的治疗手段。本研究在以往研究的基础上,以5/6肾大部切除(5/6Nx)大鼠为体内模型,尝试从miRNA调控的新角度揭示慢性肾功能不全(CKD)进展的发病机制。
1资料与方法
1.1主要试剂及细胞培养小鼠抗鸡TPM1抗体(美国Sigma公司),兔抗大鼠HIF-1α和HIF-2α多克隆抗体(美国Abcam公司),HRP标记的鼠抗小鼠IgG(美国Jackson公司),HRP标记的山羊抗兔IgG(上海碧云天生物技术有限公司)。 Oligofectamine转染试剂(美国Invitrogen公司), pre-miR-29c Oligo、pre-negative control、control anti-miR、pRL-TK internal control plasmid购自美国Ambion公司。 Taqman miRNA RT kit、Taqman Universal PCR master mix、no UNG、Taqman miRNA assay (rno-miR-29和U6)均购自美国ABI公司。细胞培养:根据不同的实验要求选择DMEM、Opti-MEM I (美国Gibco公司)等细胞培养液。
1.25/6肾切除模型的建立清洁级Sprague-Dawley雄性大鼠,体质量180~200 g,购自复旦大学上海医学院实验动物中心,按复旦大学实验动物应用和管理委员会的要求饲养。大鼠进食标准食物,自由饮水。适应性饲养1周后,4% 戊巴比妥钠(40 mg/kg)腹腔内注射麻醉,先弧形切除左肾上、下极各1/3,1周后再进行右肾全切除,建立5/6肾大部切除的CKD大鼠模型。建模后第1周末,选取存活的大鼠随机分组。大鼠随机分组如下(n=5):未治疗的对照组(vehicle control),即单纯5/6肾切除术组;L-mimosine(L-Mim治疗组,L-Mim治疗时间为肾切除术后第5至12周(L-Mim wk 5-12)。另设假手术组,大鼠仅接受2次腹腔打开/缝合手术。所有大鼠观察12周后统一处死,留取大鼠肾脏组织进行后续研究。
1.3大鼠24 h尿微量白蛋白和肾功能测定各组大鼠处死前24 h将其置入代谢笼中,自由进食和饮水,收集24 h尿液,记量后分装,-80℃保存。ELISA法测定尿微量白蛋白浓度,结合24 h尿量计算出24 h尿微量白蛋白定量(24 h Ualb)。处死时心脏穿刺采血,分离血清,酶法测定血清肌酐(Scr)浓度,尿素酶-GLDH法测定尿素氮(BUN)浓度。
1.4大鼠肾脏组织学检查肾组织经10%中性缓冲甲醛溶液固定过夜,梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚度为2 μm)后,常规PAS染色分析。肾小球硬化和肾小管间质损伤采用半定量评分[10]。
1.5Western印迹检测抽提残肾皮质总蛋白或HK2细胞胞质蛋白,BCA法进行蛋白质定量。每泳道20 μg蛋白,10% SDS-PAGE电泳分离后湿转至PVDF膜,2%BSA+5%脱脂奶粉封闭4℃过夜,次日加一抗室温孵育2 h,洗膜,加相应二抗室温孵育1 h,最后用增强化学发光系统显色,图像分析系统灰度扫描。
1.6差异表达miRNA的芯片筛查及功能验证
1.6.1miRNA芯片检测采用Agilent的大鼠miRNA芯片比较L-Mim治疗组和单纯5/6 Nx组肾皮质miRNAs的表达差异。该芯片包含350个大鼠相关的miRNAs。标本处理、检测和芯片数据分析由生物芯片上海国家工程研究中心完成。2组大鼠肾组织(每组各4只),提取RNA,质检后上样芯片分析(Agilent Technologies, Santa Clara, CA,芯片参考Sanger database v10.1,标记350种大鼠相关的miRNAs探针)。差异miRNAs的筛选条件为:P值<0.05,错误发现率(FDR)<5%,2组间变化倍数大于1.5。
1.6.2miR-29c对应靶基因的荧光素酶活性检测通过miRNA靶预测数据库查询,预测差异rno-miR-29c对应的靶基因。在此基础上,通过PCR方法,将miR-29c预测靶基因原肌球蛋白α(TPM1)的3’-UTR区域扩增,并将扩增产物克隆至pRL-TK internal control plasmid (美国Ambion公司)。随后再转染至HeLa细胞。48 h后观察荧光素酶活性(以β-半乳糖苷酶为荧光内参),以control pre-miR为对照。采用ABI的Dual-Light系统测量荧光素酶活性。
1.6.3Real-time PCR测定miR-29c的表达 采用real-time PCR进行定量分析,选择Taqman化学检测法(美国Applied Biosystems公司) 进行检测,U6作为内参。反转录采用TaqMan miRNA RT Kit,荧光定量PCR采用TaqMan Universal PCR master mix,no UNG试剂盒,各反应体系20 μL。选择miR-29c特异性引物。参数设定参照供应商提供的数据。
1.6.4细胞培养及基因转染HK2细胞购自美国ATCC细胞库,用KSF不含血清的培养液培养。置37℃细胞培养箱(5% CO2)内培养。实验细胞为10代以内。采用Oligofectamine转染pre-miR-29c Oligo/pre-miR-negative control (Oligo最终浓度100 nmol/L)。转染24 h/48 h后提取细胞RNA/胞质蛋白。

2结果
2.1大鼠残肾肾功能和病理改变肾切除各组大鼠在体质量和收缩压方面差异无统计学意义。与未治疗组相比,L-Mim治疗组大鼠血清BUN和Scr降低,24 h尿白蛋白排泄减少,Hb增加,差异有统计学意义(P<0.05或0.01,表1)。组织学分析结果显示L-Mim治疗组肾脏病理表现轻,肾小球硬化指数和肾小管间质损伤指数均低于未治疗组(表1、图1)。
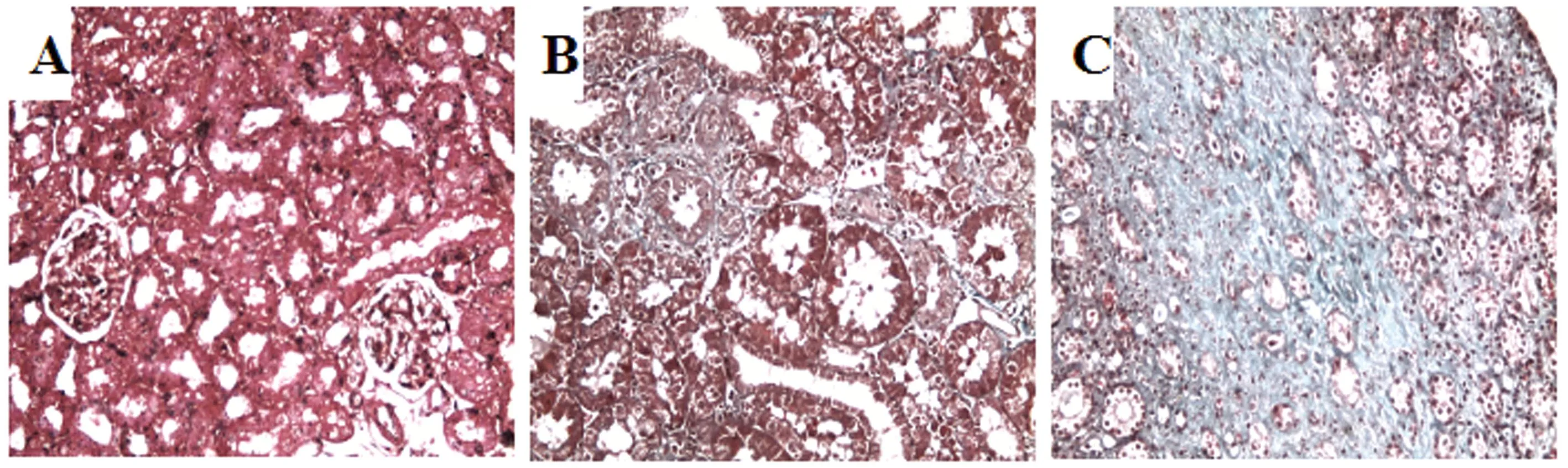
A:假手术组; B:L-Mim治疗组;C:单纯5/6肾切除术组。Masson染色(×200)图1 大鼠肾组织的病理改变
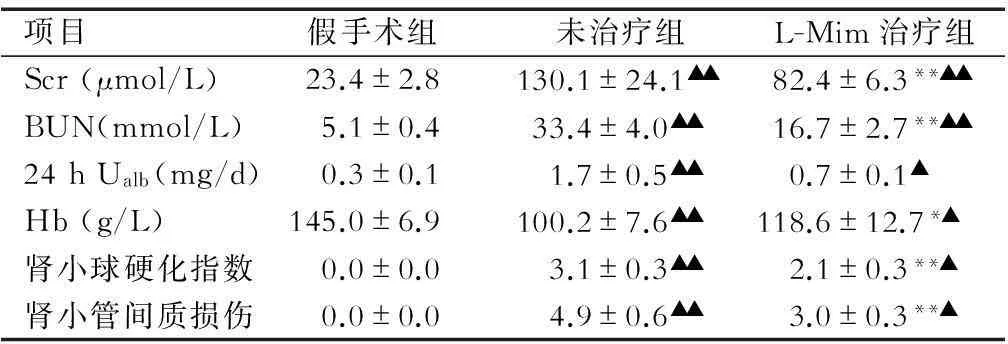
项目假手术组未治疗组L-Mim治疗组Scr(μmol/L)23.4±2.8130.1±24.1▲▲82.4±6.3**▲▲BUN(mmol/L)5.1±0.433.4±4.0▲▲16.7±2.7**▲▲24hUalb(mg/d)0.3±0.11.7±0.5▲▲0.7±0.1▲Hb(g/L)145.0±6.9100.2±7.6▲▲118.6±12.7*▲肾小球硬化指数0.0±0.03.1±0.3▲▲2.1±0.3**▲肾小管间质损伤0.0±0.04.9±0.6▲▲3.0±0.3**▲
注:Scr:血清肌酐; BUN:血清尿素氮;Ualb:尿白蛋白排泄率;Hb:血红蛋白。与未治疗组比较,*P<0.05,**P<0.01;与假手术组比较▲P<0.05,▲▲P<0.01
2.2L-Mim治疗对HIF-1α和HIF-2α的活化程度的影响术后12周,单纯手术组和L-Mim治疗组肾组织HIF-2α的蛋白水平均高于假手术组,但L-Mim治疗组肾组织HIF-1α水平高于对照组和假手术组(图2)。结果提示术后5~12周的L-Mim治疗可稳定HIF-1α和 HIF-2α的表达。
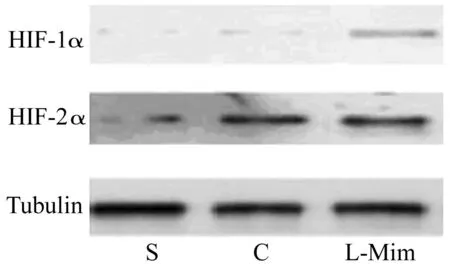
S:假手术组;C:对照组;L:L-Mim治疗组图2 术后12周各组大鼠肾脏HIF-α的蛋白表达水平
2.3L-Mim治疗组和未治疗组大鼠肾皮质miRNAs表达差异芯片分析结果显示共有9种miRNAs表达异常,其中rno-miR-22*、rno-miR-345-5p、rno-miR-29c*和rno-miR-29c的丰度在L-Mim治疗组中上调,rno-miR-872、rno-miR-130b、rno-miR-450a、rno-miR-24和rno-miR-25的表达丰度在L-Mim治疗组表达下调(表2、图3A)。由于miR-29c差异在两组间差异变化最为明显(L-Mim干预后上调3.14倍),且miR-29家族对应的靶基因中包含较多与细胞外基质相关的基因,故选择miR-29c为研究的靶点。
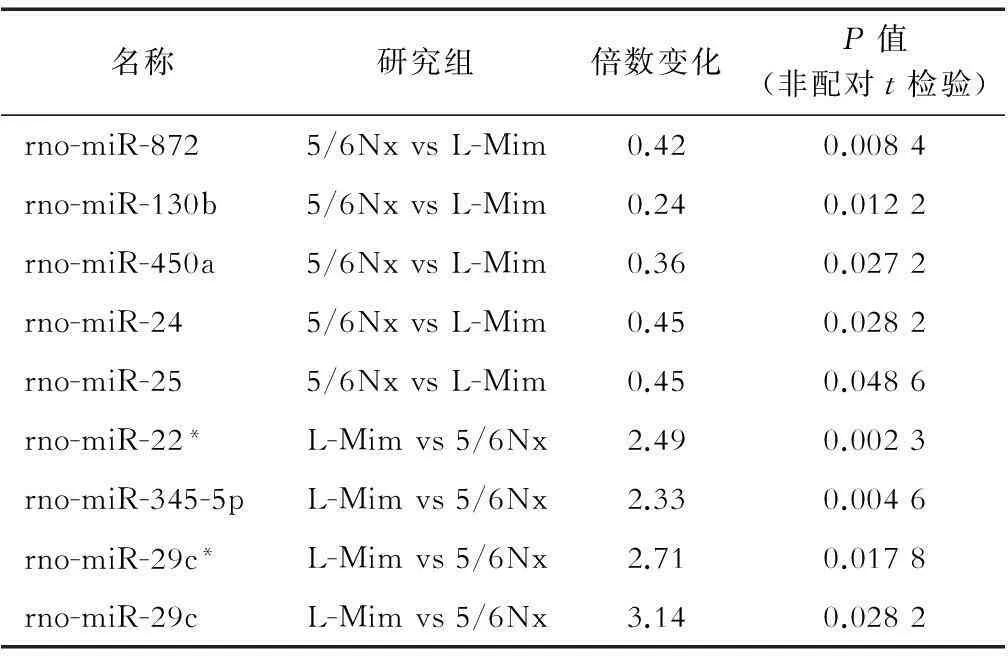
表2 L-Mim治疗组和单纯手术组
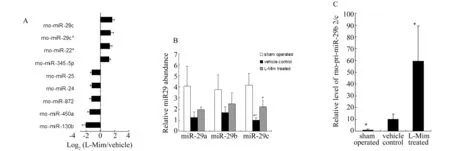
A:Agilent microRNA microarray分析结果显示9种miRNAs表达异常,其中4种miRNAs在L-Mim治疗组上调,5个下调;B:大鼠5/6肾脏切除后,肾组织miR-29c水平表达下降,L-Mim干预后可部分逆转miR-29c表达下调;C:L-Mim可上调残肾rno-pri-miR-29 b2/c的丰度
图3L-Mim干预可部分逆转残肾组织miR-29c的表达水平
2.4miR-29c差异表达的再验证及对应靶基因的预测和功能验证
2.4.1miR-29c表达差异的再验证分别取与芯片送检样本不同批的3组大鼠肾皮质组织,提取RNA后,检测假手术组、单纯5/6肾切除以及L-Mim治疗组肾皮质miR-29c及其前体pri-miR-29b2/c表达丰度。假手术组miR-29c水平高于5/6肾切除组,后两组中,L-Mim组miR-29c水平高于未治疗残肾对照组;假手术组肾组织pri-miR-29b2/c的丰度处于低平状态,L-Mim干预后残肾组织pri-miR-29b2/c表达较对照组和假手术组明显上调。同时比较了miR-29家族的其他两个成员——miR-29a和miR-29b的表达丰度,发现miR-29a和miR-29b的变化趋势与miR-29c相似,但差异无统计学意义。见图3B、3C。
2.4.2miR-29c靶基因的预测通过TargetScan (http:∥www.targetscan.org/)、PicTar (http:∥pictar.bio.nyu.edu/)、miRanda (http:∥microrna.sanger.ac.uk/targets/v4/)等运算方法,预测了miR-29c对应的与细胞外基质相关的靶基因(表3)。

表3 miR-29c对应的靶基因
注:at/c, L-Mim治疗组/单纯手术组;bNA:在数据库中未搜索到目的miRNAs的信息
2.4.3荧光素酶报告系统验证原肌球蛋白-α为miR-29c对应靶基因荧光素酶基因报告系统证实:TPM1为miR-29c对应的新靶基因,突变实验进一步证实了TPM1与miR-29c对应关系 (图4A)。
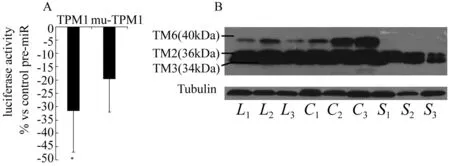
A:MiR-29c作用于TPM1的3’-UTR区,将含TPM1基因的3’-UTR序列(诱导突变或未突变)的荧光素酶报告基团、pRL-TK internal control质粒、对照pre-miR寡核苷酸和miR-29c mimic共转染至HeLa 细胞,MiR-29c mimic降低了与TMP1 3’-UTR相连的荧光素酶报告基团的荧光强度,但不明显降低TPM1 3’UTR突变后的荧光强度(*P<0.01 vs pre-miR negative control, n=5);B:大鼠5/6肾切除术后残肾组织的原肌球蛋白(TM)的蛋白水平上调,L-Mim干预可以抑制TM的表达上调。Lane 1-3: L-Mim治疗组; lane 4-6:残肾对照组; lane 7-9: 假手术组图4 TPM1为miR-29c对应的靶基因
2.4.4miR-29c与TPM1的功能验证 将人肾小管上皮细胞HK2细胞在含有TGF-β1(3 ng/μL)的培养液内孵育30 min后,分别转染pre-miR-29c和pre-miR-negative control,24 h后收集RNA或48 h后收集蛋白标本。Real-time PCR结果显示TGF-β1处理后的细胞miR-29c的表达水平下降80%左右(P<0.05),图5A),CoCl2化学诱导HIF活化后(数据未显示)可部分逆转TGF-β1引起的miR-29c表达下调(图5B)。Pre-miR-29c+TGF-β1组miR-29c的平均表达丰度为对照组(pre-miR-negtive control+ TGF-β1)的2 256倍,为单纯TGF-β1处理组的1.25×106倍。比较pre-miR-29c+ TGF-β1组和pre-miR-negtive control+TGF-β1组细胞转染48 h后TPM1的蛋白表达,前者TM2/3的表达较后者下降19.6%(n=5,P<0.01, 图5C)。动物实验观察到,L-Mim治疗组大鼠肾皮质TM的表达虽高于假手术组,但低于未治疗对照组(图4B)。
3讨论
越来越多的证据表明,肾小管间质的慢性缺氧可能是各种慢性肾脏疾病包括肾小球疾病进展为终末期肾病的共同致病通路[1-2]。5/6肾切除的残肾模型是经典CKD模型之一,我们前期的研究发现,5/6肾切除后残肾组织的HIF-1α和HIF-2α的蛋白表达上调,至术后第4~6周达到峰值,随后缓慢降低[11]。因此选择术后第5周进行干预,是因为一方面肾小管上皮细胞代偿性增生此时达到高峰,肾小管未出现萎缩和扩张,间质也没有明显纤维化;另一方面HIF-α亚单位在残肾中的表达也达到了暂时性的高峰,并趋于下降。我们的研究结果也验证了上述假设,术后12周时,与未治疗组相比,L-Mim治疗明显降低了大鼠BUN和Scr等生化指标,减轻了残肾的小管间质损伤并降低24 h的尿白蛋白排泄率。作为酮戊二酸类似物的L-Mim是众多PHD抑制剂中的一种,后者通过抑制HIF-1α或HIF-2α与pVHL的结合达到稳定和活化HIF。我们推测,进展期L-Mim的肾脏保护作用可能通过适时上调HIF-α亚单位从而选择性活化VEGF、HO-1和Glut-1等具有肾保护作用的靶基因,使得代偿性增生的肾小管上皮细胞耐受缺氧而延迟进入小管萎缩和间质纤维化[8]。
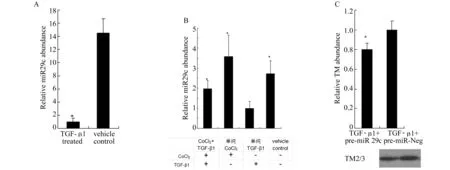
A:TGF-b1下调miR-29c丰度(*P<0.05 vs vehicle treated)。B: CoCl2逆转TGF-β1诱导的miR-29c表达下调;cHK2在接受TGF-β1(3 ng/mL)处理前24 h,预先培养于含或不含CoCl2 (200 μmol/L)的培养液(n=6, *P<0.05 vs 单纯TGF-β1处理组)。C:miR-29c mimics抑制TGF-β1诱导的TM水平上调,每条泳道的蛋白经考马氏亮蓝染色后定量,并作为TM蛋白的内参(n=5, #P<0.05 vs pre-miR-Neg)图5 MiR-29c表达下调可能参与TGF-β1诱导的TPM1表达上调
miRNAs是重要的基因调控因子,其异常表达可导致疾病的发生发展。miRNAs参与调控人类以及啮齿类动物(大鼠和小鼠)肾脏正常生理过程的状态已有文献报道,新近的研究发现,某些miRNAs的异常表达与一些肾脏疾病的发病关联,如miR-192和miR-377的表达异常与糖尿病肾病发病相关,miR-15a参与多囊肾发病等。本研究通过高通量芯片分析发现,miR-29c的表达与慢性肾脏病(CKD)进展负相关,体内和体外实验先后证实了:大鼠残肾模型中观察到肾组织miR-29c水平与肾小管间质纤维化程度、Scr和尿蛋白水平负相关;在模拟肾小管间质纤维化体外模型中,当TGF-β1诱导HK2细胞发生上皮间质转化(EMT)[12]时,细胞miR-29c水平显著下降。生物信息学的进一步研究发现miR-29c对应的靶基因包括了各型胶原、FBN1等与细胞外基质相关的基因,而miRanda、PicTar和TargetScan等数据库的检索结果提示TPM1也是miR-29c的靶基因之一,并经荧光素酶报告系统和突变实验证实。
原肌球蛋白是细肌丝中与肌动蛋白结合的蛋白,不仅是肌肉收缩过程中的重要调节蛋白,也参与细胞骨架的构成[13]。迄今为止,哺乳动物中的4个TM基因已经被确认,分别命名为TPM1、TPM2、TPM3和TPM4。TM主要分为两大类,含248~291个氨基酸残基的相对高相对分子质量组(high molecular weight,HMW)和含245~251个氨基酸残基的低相对分子质量组(low molecular weight, LMH),其中TPM1,即α基因编码的为HMW的TM,主要包括TM6(40 000)、TM2(36 000)和TM3(34 000),TPM1除编码骨骼肌的α-TM外,还编码平滑肌α-TM等其他几种同型异构体。在一些慢性疾病模型中,也证实TPM1参与了上皮细胞张力纤维的生成[13-15]。
成纤维细胞和上皮细胞均可表达TPM1编码的HMW——原肌球蛋白TM2、TM3和TM6以及TPM2编码的TM1。我们早先的研究发现TGF-β1诱导肾小管上皮细胞发生EMT时TPM1表达增强[12]。原肌球蛋白是稳定肌动蛋白,是调控细胞内张力纤维以及维系细胞骨架的重要成分之一。TPM1伴随EMT发生而表达上调的现象提示TPM1水平可能影响上皮细胞的紧密连接和极性,后者也参与病理状态下的细胞骨架重构。在本研究中我们观察到大鼠5/6肾大切后,肾组织TPM1的表达随肾功能的恶化而上升,经L-Mim短期治疗后,肾功能改善、尿蛋白减少的同时,也伴随TPM1表达下调,其中TM6经L-Mim治疗后明显下调,其蛋白表达水平随病情的改善而部分下调,提示TPM1的高表达与CKD进展和肾小管间质纤维化的发病可能相关。本研究进一步发现,HK2细胞转染miR-29c的前体寡核苷酸(pre-miR-29c)使miR-29c的过量表达后,Western印迹结果表现为TM2蛋白水平明显下降,提示在CKD的进展过程中伴随miR-29c表达下调,适时给予PHD抑制剂增加HIF表达后可部分逆转残肾组织CKD进展所致的miR-29c表达下调。TPM1是miR-29c对应的靶基因之一,前者与张力纤维生成、细胞骨架重构相关,可能是防治肾小管间质纤维化、延缓CKD进展的靶目标之一。但TPM1不同异构体在肾病进展中的作用仍有待进一步探索。
本研究结果提示L-Mim可延缓CKD进展,尤其在小管间质出现明显损伤之前开始干预效果更明显,可能的机制与上调miR-29c表达相关。与其他PHD抑制剂如 3,4-DHB和S956711 相比,L-Mim在有效治疗浓度范围内无毒性作用,其出现最大毒性的浓度是最大有效浓度的 2 倍以上[16],是有前景的诱导慢性缺氧耐受、延缓CKD进展的药物之一。关于药物的最佳干预时机、剂量以及相关作用机制仍有待于进一步阐明。
参考文献
[ 1 ]Nangaku M. Hypoxia and tubulointerstitial injury: a final common pathway to end-stage renal failure[J].Nephron Exp Nephrol,2004,98(1):e8-e12.
[ 2 ]Tanaka T, Nangaku M.The role of hypoxia, increased oxygen consumption, and hypoxia-inducible factor-1 alpha in progression of chronic kidney disease[J].Curr Opin Nephrol Hypertens,2010,19(1):43-50.
[ 3 ]俞小芳,丁小强,朱加明,等. 5/6肾切除大鼠低氧诱导因子1α和2α在肾内的表达和定位[J].中华肾脏病杂志,2010, 26(9):689-695.
[ 4 ]Maxwell PH. Hypoxia-inducible factor as a physiological regulator[J].Exp Physiol,2005, 90(6): 791-797.
[ 5 ]张晓丽,刘红,邹建洲,等.低氧诱导因子1α高表达对小鼠急性缺血性肾损伤的影响[J].中华肾脏病杂志, 2007,23(7):448-452.
[ 6 ]陈越,蒋素华,朱加明,等.小分子RNA干扰沉默缺氧诱导因子1α加重缺氧状态肾小管上皮细胞的生长抑制和坏死[J].中华肾脏病杂志, 2010,26(7):562-563.
[ 7 ]Liang M, Liu Y, Mladinov D, et al. MicroRNA: a new frontier in kidney and blood pressure research[J].Am J Physiol Renal Physiol,2009,297(3):F553-F558.
[ 8 ]Hua Z, Lv Q, Ye W, et al. MiRNA-directed regulation of VEGF and other angiogenic factors under hypoxia[J].PLoS One,2006,1:e116.
[ 9 ]Makeyev EV, Maniatis T. Multilevel regulation of gene expression by microRNAs [J], Science. 2008, 319(5871): 1789-1790.
[10]Maric C, Sandberg K, Hinojosa-Laborde C. Glomerulosclerosis and tubulointerstitial fibrosis are attenuated with 17beta-estradiol in the aging Dahl salt sensitive rat[J].J Am Soc Nephrol,2004, 15(6):1546-1556.
[11]Yu X, Fang Y, Ding X, et al. Transient hypoxia-inducible factor activation in rat renal ablation and reduced fibrosis with L-mimosine[J].Nephrology (Carlton),2012,17(1):58-67.
[12]Kriegel AJ, Fang Y, Liu Y, et al. MicroRNA-target pairs in human renal epithelial cells treated with transforming growth factor beta 1: a novel role of miR-382[J].Nucleic Acids Res,2010,38(22): 8338-8347.
[13]Houle F, Poirier A, Dumaresq J, et al. DAP kinase mediates the phosphorylation of tropomyosin-1 downstream of the ERK pathway, which regulates the formation of stress fibers in response to oxidative stress[J].J Cell Sci,2007,120(Pt 20):3666-3677.
[14]Zheng Q, Safina A, Bakin AV. Role of high-molecular weight tropomyosins in TGF-beta- mediated control of cell motility[J].Int J Cancer,2008,122(1):78-90.
[15]Morita T, Mayanagi T, Sobue K. Dual roles of myocardin-related transcription factors in epithelial mesenchymal transitionvia slug induction and actin remodeling[J].J Cell Biol,2007,179 (5):1027-1042.
[16]Warnecke C,Griethe W,Weidemann A,et al.Activation of the hypoxia-inducible factor-pathway and stimulation of angiogenesis by application of prolyl hydroxylase inhibitors[J]. FASEB J,2003,17(9):1186-1188.
中图分类号R692
文献标志码A
通讯作者方艺,E-mail: fang.yi@zs-hospital.sh.cn;贾平,E-mail: JPwxl999@126.com
基金项目:国家自然科学基金资助项目(编号:81200557;81430015);上海市科学技术委员会基金项目(编号:14DZ2260200)
Δ梁怡然和衡艳艳对本文有同等贡献,为共同第一作者。
·论著·
