人脐带间充质干细胞对难治性免疫性血小板减少症患者B淋巴细胞分化及分泌功能的影响
2016-04-11曾玉晓徐玲珑吴迪炯叶宝东高雁婷刘文宾周郁鸿
曾玉晓,徐玲珑,吴迪炯,叶宝东,高雁婷,刘文宾,周郁鸿
(浙江中医药大学第一临床医学院血液科, 杭州 310006)
ChinJAllergyClinImmunol,2016,10(3):207- 212
免疫性血小板减少症(immune thrombocytopenia,ITP)是免疫介导的血小板过度破坏、巨核细胞数量和质量异常,血小板生成相对不足的自身免疫性疾病。ITP的治疗,目前主要从激素、丙种球蛋白冲击、切脾、化疗等方面着手,取得了一定疗效。对于难治性血小板减少症患者,抗CD20单克隆抗体(美罗华)已成为重要的选择手段之一,但其存在着价格昂贵,远期疗效尚有无法确定的不足。目前,已有采用间充质干细胞(mesenchymal stem cell,MSCs)治疗ITP[1]的个案报道,但相关的实验研究仍相对缺乏。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)来源丰富,增殖分化能力强[2- 3]。因此,本实验探索hUC-MSCs对难治性免疫性血小板减少症(refractory immune thrombocytopenia,rITP)患者外周血B细胞分化及分泌功能的影响。
资料与方法
病例来源
病例资料为2012年6月至2013年10月本院rITP患者26例,男性10例,女性16例,中位年龄44(12~68)岁。健康供者6例,男性4例,女性2例,中位年龄28(21~40)岁。
rITP患者纳入标准
(1)脾切除后无效或复发者或依赖激素者;(2)仍需治疗以降低出血的危险;(3)除外其他引起血小板减少症的原因,确诊ITP。
hUC-MSCs的提取[4]及纯度鉴定
人脐带由浙江省杭州市第一人民医院提供,通过了浙江省中医院伦理委员会伦理批准。将无菌脐带用含有青链霉素双抗的PBS清洗;剥离华通氏胶,将华通氏胶剪碎至约2 mm×2 mm×2 mm大小;用0.2%的Ⅱ型胶原酶,37 ℃消化4~5 h;消化物用50目、200目滤网过滤,过滤液用PBS稀释,分别以2 000 r/min×15 min、1 500 r/min×15 min、800 r/min×5 min离心,弃上清液;计数,细胞以7.5×105个接种于25 cm2培养瓶内,48 h后首次换液,细胞融合度达90%时胰酶消化,以0.5×105/L传代培养。取第三代的hUC-MSCs,用CD44、CD31标记hUC-MSCs用流式细胞仪检测其纯度。
健康供者及rITP患者外周血B细胞的分离及共培养体系的建立
用人外周血淋巴细胞分离液以密度梯度离心法分离出rITP患者及健康供者外周血单个核细胞,调整细胞数为7.5×107/L,用流式细胞仪检测CD19标记的细胞。胰酶消化融合度90%的hUC-MSCs细胞,调节细胞浓度为5×105个接种于培养皿,贴壁3 h后,分别以hUC-MSCs∶单个核细胞0.5∶10、1∶10、2∶10、4∶10、8∶10建立共培养体系。
美洲商陆刺激B细胞分化及酶联免疫吸附测定法检测抗体IgM、IgG分泌量
将浓度分别为30、10、1 mg/L的美洲商陆(Pokeweed,PWM)加入健康供者外周血分离的单个核细胞中培养2、4、7 d,按酶联免疫吸附测定法(enzyme-linked immuno sorbent assay,ELISA)试剂盒说明书检测标准品及上清液分泌抗体IgM和IgG的吸光度值(OD值),绘制标准曲线,计算两种抗体的浓度。外周血单个核细胞与hUC-MSCs共培养4 d,收集上清液,按ELISA试剂盒说明书检测标准品及上清液分泌抗体IgM和IgG的OD值,计算两种抗体的浓度。
EnVision免疫组化法测B细胞诱导的成熟蛋白-1的表达
外周血单个核细胞与hUC-MSCs共培养4 d,CD138标记细胞。EnVision二步法免疫组化,检测B细胞诱导的成熟蛋白- 1(B lymphocyte-induced maturation protein1,Blimp- 1)被抑制程度。阳性率(positive rate, PR)=阳性细胞数/(阴性细胞数+阳性细胞数)×100%。
计分标准[5- 6]:(1)阳性强度的判断:按着色细胞染色强弱判断,细胞染色呈阴性为(-);染色弱,阳性细胞呈淡黄色为(+);染色中等,阳性细胞呈棕黄色为(++);染色强,阳性细胞呈棕褐色为(+++),统计时分别用0、1、2和3分表示。(2) 阳性率的判断:没有阳性细胞的计为(-),阳性率小于25%的计为(+),阳性率介于26%~50%之间的计为(++),阳性率大于50%计为(+++),统计时分别用0、1、2、3分表示。
统计学处理
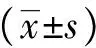
结 果
流式细胞仪检测hUC-MSCs纯度和外周血单个核细胞B细胞比例
流式细胞仪检测第三代hUC-MSCs表面CD44和CD31表达分别为99.8%和1.6%。流式细胞仪检测健康供者、rITP患者外周血单个核细胞CD19标记的细胞分别为6.9%和6.2%(图1、2)。
B细胞分化为浆细胞分泌抗体与PWM浓度和作用时间的相关性
PWM浓度30、10、1 mg/L,作用4 d时健康供者组IgG分泌量分别为(4.83±0.17)、(3.49±0.66)、(2.97±0.88)μg/L,分别高于同浓度第2天、第7天IgG分泌量(P均<0.01);IgM分泌量分别为(3.47±0.49)、(1.84±0.46)、(1.67±0.65)μg/L,高于同浓度第2天、第7天IgM分泌量(P均<0.01)(图3),因此以PWM为30 mg/L、4 d作为PWM刺激B细胞的浓度和时间。该刺激条件下rITP患者组IgG分泌量为(7.39±1.42)μg/L,高于健康供者组(P=0.014);rITP患者组IgM分泌量为(5.44±0.17)μg/L,高于健康供者组(P=0.039)(表1)。选用PWM浓度为30 mg/L,作用时间4 d进行下一步实验。
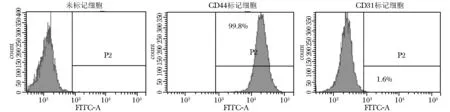
图1hUC-MSCs纯度鉴定
Fig1hUC-MSCs’ purity identification
hUC-MSCs:人脐带间充质干细胞;CD44标记的hUC-MSCs细胞占99.8%;CD31标记的hUC-MSCs细胞占1.6%
hUC-MSCs抑制抗体IgG、IgM的分泌
hUC-MSCs和rITP患者外周血单个核细胞以2∶10共培养时,rITP患者IgG、IgM分泌量分别是(4.98±1.63)和(3.78±0.82)μg/L,明显低于无hUC-MSCs时IgG、IgM分泌量(P=0.005、0.003)。此比例时rITP患者组IgG、IgM分泌量和健康供者组无明显差异(P=0.266、0.543)(表2)。
hUC-MSCs抑制Blimp- 1蛋白的表达
rITP患者CD138标记细胞阳性率即Blimp- 1蛋白表达率在hUC-MSCs∶单个核细胞为2∶10时为33.51%,较无hUC-MSCs时明显下降(P=0.026),与健康供者组比差异无统计学意义(P=0.076)(图4)。
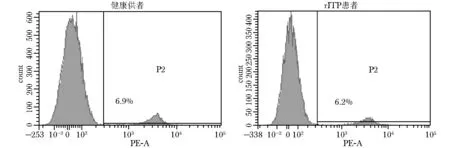
图2外周血CD19标记的细胞百分比
Fig2CD19 marked peripheral blood mononuclear cells
rITP:难治性免疫性血小板减少症;健康供者组外周血CD19标记细胞为6.9%; rITP患者组外周血CD19标记细胞为6.2%

图3健康供者外周血在不同PWM浓度及不同作用时间时IgG、IgM分泌量
Fig3IgG and IgM secretion levels of healthy donors with different PWM concentration and work time
PWM:美洲商陆
表1不同PWM浓度时健康供者组及rITP患者组IgG、IgM的分泌量
Table1IgG and IgM secretion levels of healthy donors and rITP patients with different PWM concentration

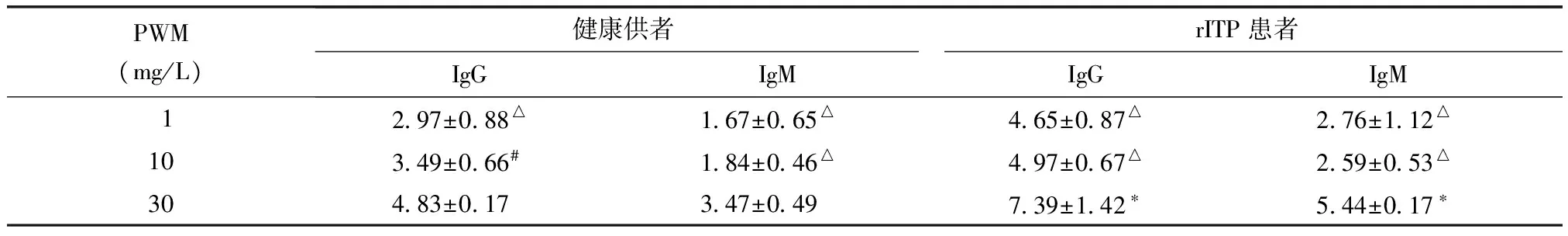
PWM(mg/L)健康供者rITP患者IgGIgMIgGIgM 1 297±088△ 167±065△ 465±087△ 276±112△10 349±066# 184±046△ 497±067△ 259±053△30 483±017 347±049 739±142∗ 544±017∗
PWM:美洲商陆;rITP:难治性免疫性血小板减少症;与健康供者比较,*P<0.01;与PWM 30 mg/L比较,#P<0.05,△P<0.01
表2rITP患者外周血单个核细胞与hUC-MSCs不同比例及无hUC-MSCs时IgG、IgM分泌量
Table2IgG and IgM secretion levels of rITP patients with no-hUC-MSCs and PBMCs co-cultured with hUC-MSCs in different ratio


hUC⁃MSCs:PBMCIgGIgM无hUC⁃MSCs 739±142 544±01705∶10 724±144 564±0961∶10 670±061 528±1052∶10 498±163∗ 378±082∗4∶10 680±187 533±0708∶10 707±112 603±116
rITP:难治性免疫性血小板减少症;hUC-MSCs:人脐带间充质干细胞;PBMC:外周血单个核细胞;与无hUC-MSCs比较,*P<0.01

图4 健康供者组、rITP患者组无hUC-MSCs、外周血单个核细胞与hUC-MSCs不同比例时Blimp- 1蛋白表达率Fig 4 Blimp- 1 protein expression of healthy donors,no-hUC-MSCs and PBMCs co-cultured with hUC-MSCs in different ratio of rITP patientsrITP:难治性免疫性血小板减少症;hUC-MSCs:人脐带间充质干细胞;Blimp- 1:B细胞诱导的成熟蛋白- 1; PBMC:外周血单个核细胞
讨 论
MSCs是全能干细胞,可以从骨髓、脐带、脂肪等组织中提取,有自我更新、分化的能力。有易于分离提取、特异性表面标记、可分化为多种细胞具有免疫调节、迁移等特性,因此MSCs可用于治疗再生障碍性贫血、系统性红斑狼疮、糖尿病、多发性硬化症等自身免疫性疾病。MSCs具有调节T细胞、B细胞、单核巨噬细胞等免疫细胞的功能[7]。目前认为MSCs通过可溶性因子[8]、白细胞介素10(interleukin- 10, IL- 10)、转化生长因子β(transforming growth factor-β,TGF-β)[9]、γ干扰素(interferon-γ,IFN-γ)等调节T细胞的活化增殖。MSCs使B 细胞停滞在G0/G1期、改变B细胞胞外激酶和p38促分裂原活化蛋白的激发模式[10],使B 细胞不能增殖分化为浆细胞,从而减少IgG、IgM、IgA的分泌。我们的实验中,hUC-MSCs高表达CD44,不表达CD31,与骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)相同,而且hUC-MSCs比其他组织来源的MSCs更原始,更具有增殖分化能力。本实验发现在hUC-MSCs∶单个核细胞为2∶10时IgG、IgM分泌量较无hUC-MSCs时明显减少,与相关文献[11]一致。说明hUC-MSCs可以抑制B细胞分化为浆细胞。
Blimp- 1是由prdm1基因编码的转录抑制因子,可以诱导成熟B淋巴细胞发育为浆细胞,被称作“B淋巴细胞终极分化的主调控子”。成熟B淋巴细胞分化为浆细胞需多个转录因子共同参与,其中PAX5、BCL- 6、MITF、MTA3、BACH2参与B细胞分化,Blimp、XBP- 1、IRF- 4参与浆细胞分化。Asari等[12]认为将B细胞和MSCs共培养可抑制Blimp- 1 mRNA的表达,本实验也证明hUC-MSCs和B 细胞共培养,Blimp- 1蛋白表达下降,从而减少B细胞向浆细胞分化。
本实验中,hUC-MSCs对IgG、IgM及Blimp- 1蛋白的抑制程度,并不和其浓度成正比,这和Bertolo等[13]的实验相似,Bertolo等在体外将人MSCs和人椎间盘组织共培养,发现人MSCs 50 000个/孔时对IgG的抑制率反而低于人MSCs为10 000/孔时的抑制率。有学者认为人MSCs对B细胞的活性无影响,但抑制B细胞的增殖,使其停滞在G0/G1期[11]。本研究未进行B细胞增殖相关的实验,对于hUC-MSCs是否使B细胞停滞于细胞周期某一时期还有待进一步研究。
综上,本实验结果表明hUC-MSCs可以抑制Blimp- 1蛋白从而抑制rITP患者外周血B细胞向浆细胞分化,减少IgG、IgM的分泌,为临床骨髓移植治疗rITP提供一定的实验依据,但其他作用机制及临床治疗剂量仍需探索。
[1]Fang B, Song YP, Li N, et al. Resolution of refractory chronic autoimmune thrombocytopenic purpura following mesenchymal stem cell transplantation: a case report[J]. Transplant Proc, 2009,41:1827- 1830.
[2]Wu LF, Wang NN,Liu YS,et al. Differentiation of Wharton’s jelly primitive stromal cells into insulin-producing cells in comparison with bone marrow mesenchymal stem cells[J]. Tissue Eng Part A, 2009,15:2865- 2873.
[3]Can A, Karahuseyinoglu S. Concise review: human umbilical cord stroma with regard to the source of fetus-derived stem cells[J]. Stem Cells,2007,25: 2886- 2895.
[4]Seshareddy K, Troyer D, Weiss ML. Method to isolate mesenchymal-like cells from Wharton’s Jelly of umbilical cord[J]. Methods Cell Biol, 2008,86:101- 119.
[5]马大烈, 白辰光. 免疫组织化学阳性标记结果的观察和判断[J]. 临床与实验病理学杂志, 2003, 19: 557- 559.
[6]Fields AC, Cotsonis G, Sexton D, et al. Survivin expression in hepatocellular carcinoma: correlation with proliferation, prognostic parameters, and outcome[J].Mod Pathol, 2004,17:1378- 1385.
[7]Gieseke F, Kruchen A, Tzaribachev N,et al. Proinflammatory stimuli induce galectin- 9 in human mesenchymal stromal cells to suppress T-cell proliferation[J]. Eur J Immunol,2013,43:2741- 2749.
[8]Duffy MM, Ritter T, Ceredig R,et al. Mesenchymal stem cell eff ects on T-cell eff ector Pathways[J]. Stem Cell Res Ther,2011,2:34.
[9]Nasef A, Chapel A, Mazurier C,et al. Identification of IL- 10 and TGF-beta transcripts involved in the inhibition of T-lymphocyte proliferation during cell contact with human mesenchymal stem cells[J]. Gene Expr, 2007,13:217- 226.
[10] Tabera S, Pérez-Simón JA, Díez-Campelo M,et al. The effect of mesenchymal stem cells on the viability,proliferation and differentiation of B-lymphocytes[J]. Haematologica,2008, 93:1301- 1309.
[11] Corcione A, Benvenuto F, Ferretti E, et al. Human mesenchymal stem cells modulate B-cell functions[J].Blood, 2006,107: 367- 372.
[12] Asari S, Itakura S, Ferreri K, et al. Mesenchymal stem cells suppress B cell terminal differentiation[J]. Exp Hematol, 2009,37: 604- 615.
[13] Bertolo A, Thiede T, Aebli N,et al.Human mesenchymal stem cell co-culture modulates the immunological properties of human intervertebral disc tissue fragmentsinvitro[J]. Eur Spine J,2011, 20:592- 603.
