男性免疫性不育患者外周血T细胞亚型分布
2016-04-11张晓霞魏任雄娄江涛
张晓霞,魏任雄,周 俊,娄江涛
(浙江中医药大学附属宁波市中医院男性科实验室,浙江宁波 315012)
ChinJAllergyClinImmunol,2016,10(3):242- 246
免疫因素是WHO男性不育标准化病因分类诊断之一,男性免疫性不育作为器官特异性自身免疫性疾病,体内可能存在免疫系统的功能紊乱。T辅助细胞(T helper cell,Th细胞)是免疫细胞分化的重要组成部分,Th1/Th2分化平衡,对维持机体稳态有重要意义[1]。体内Th1或Th2细胞失衡与糖尿病、心血管疾病及支气管哮喘等多种疾病有关[2- 4]。目前,Th细胞失衡与免疫性男性不育是否有关尚未见相关报道,男性免疫性不育异常的免疫细胞分化和免疫应答机制尚不明确。本研究主要通过观察免疫性不育患者外周血T细胞分化情况及Th1和Th2细胞的效应细胞因子γ-干扰素(interferon-γ,IFN-γ)和白细胞介素- 4(interleukin- 4,IL- 4)在基因转录水平的表达,探索男性免疫性不育患者机体的免疫状态。
资料与方法
对象
收集2014年4月至2015年4月来宁波市中医院男科就诊的免疫性不育患者40例,入选标准参照WHO《人类精液检查与处理实验室手册》(第5版)[5]:性及射精功能正常,在至少一份精液标本中,混合抗球蛋白反应试验(mixed antiglobulin reaction,MAR)或免疫珠试验有不少于50%活动精子表面被覆抗体。所有患者均排除泌尿系统感染,年龄22~47岁,平均(31.2±6.5)岁,夫妻性生活正常,未采取任何避孕措施1年以上未使女方怀孕,女方均经妇科检查排除不孕因素。所有患者均为初诊,未经治疗。另外选择妻子怀孕待产生育力正常的健康男性20例为对照组,年龄22~35岁,平均(27.1±13.9)岁。所有对象均签署知情同意书,并通过医院伦理委员会同意。
主要试剂和仪器
荧光定量PCR仪Mx3000P型 (美国Stratagene公司),普通PCR仪(德国Roche公司),溶血仪(Beckman公司),总RNA提取试剂盒(日本TaKaRa公司),cDNA第一链合成试剂盒(日本TaKaRa公司),TaqDNA聚合酶(上海Fermentas公司),dNTP(上海Fermentas公司),Universal Master Mix(Applied Biosystems),荧光抗体CD3-PE-CY5、CD4-FITC、CD8-PE均购自Beckman公司。
标本采集
所有受试者均空腹采集外周血4 ml,用EDTA抗凝。0.5 ml全血用于流式细胞术检测,剩余全血采用Ficoll密度梯度离心法收集外周血单个核细胞,用于提取基因组RNA。
T淋巴细胞细胞亚群检测
取EDTA抗凝外周血0.5 ml,加入5 μl三色荧光抗体CD3-PE-CY5/CD4-FITC/CD8-PE,室温避光孵育15 min,置溶血仪中溶血,然后加入2 ml PBS洗涤后弃上清。用500 μl PBS重悬细胞,利用流式细胞仪检测分析。
RT-PCR检测IFN-γ和IL4的基因表达
RNA提取:采用Trizol法提取外周血单个核细胞的基因组RNA,具体按照试剂盒说明书操作。经DU800紫外分光光度计测定A260/A280比值1.8~2.0,提示无DNA及蛋白质污染。
逆转录:取11 μl RNA模板样品,加入1 μl 0.5 μg/μl Oligo(dT)18,总反应体系20 μl,具体操作严格按cDNA第一链合成试剂盒说明书进行。
IFN-γ mRNA扩增:根据Genebank所收录的IFN-γ mRNA序列设计引物,上游引物5′-TTTTGGGTTCTC TTGGCTGTT-3′,下游引物5′-CTCCTTTTTCGCTTCCCT GT-3′。20 μl PCR反应体系中含有上游引物900 nmol/L,下游引物300 nmol/L,cDNA 2 μl,Universal Master Mix 10 μl。扩增条件:94 ℃预变性2 min,再用二步法进行扩增:94 ℃ 10 s,60 ℃ 30 s,共反应40个循环。
IL- 4 mRNA扩增:根据Genebank所收录的IL- 4 mRNA序列设计引物,上游引物5′-AATTGCCTCAC ATTGTCACT-3′,下游引物5′-CTCTCATGATCGTCTT TAGCC-3′。PCR反应体系和条件同IFN-γ mRNA。
管家基因β-actin:根据Genebank所收录的β-actin mRNA序列设计引物,上游引物5′-GGCAC CCAGCACAATGAAG-3′,下游引物5′-CGTCATACTC CTGCTTGCTG-3′。PCR反应体系和条件同IFN-γ mRNA。
统计学处理
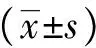
结 果
免疫性不育患者T细胞亚群
流式细胞术检测结果显示,与正常对照相比,免疫性不育患者CD3+T与CD8+T细胞数显著升高(P<0.05),CD4+T细胞数显著下降(P<0.05),免疫性不育者CD4/CD8比值下降并倒置(图1~3)。
RT-PCR检测免疫性不育患者IFN-γmRNA和IL-4mRNA表达
RT-PCR检测结果显示,与正常对照相比,IFN-γ mRNA在免疫性不育组的表达量显著上调(P<0.05);相反,IL- 4 mRNA的表达量则在免疫性不育组显著下调(P<0.05)(表1)。
讨 论
在不育夫妇中,男性因素所致不育约占50%,其中2%~10%的不育症与免疫因素有关[6]。目前普遍认为男性免疫性不育的主要机制是血睾屏障异常开放或破坏,精母细胞及精子等与机体免疫系统接触产生免疫反应,导致抗精子抗体产生[7]。但是,血清或精浆中的抗精子抗体产生时机体免疫细胞的分化状态及免疫应答的机制还不清楚。本研究应用流式细胞术分析了男性免疫性不育患者和正常对照者的外周血T细胞分化情况。结果显示,免疫性不育患者外周血CD3+T细胞较正常对照组显著升高(P<0.05),表明免疫性不育的发病与T淋巴细胞介导的细胞免疫有密切关系。进一步分析T淋巴细胞亚群,发现CD8+T细胞数显著升高(P<0.05),CD4+T细胞数显著降低(P<0.05),免疫性不育者CD4+T/CD8+T比值下降并发生倒置,提示免疫性不育患者存在T淋巴细胞亚群失调。

图1免疫性不育组与正常对照组外周血T细胞亚群分布百分比散点图
Fig1The distribution of T lymphocyte subsets in peripheral blood of immune infertility group and normal control group
A:两组外周血CD3+T细胞占淋巴细胞百分比比较,P=0.003;B:两组外周血CD4+T细胞占淋巴细胞百分比比较,P=0.000;C:两组外周血CD8+T细胞占淋巴细胞百分比比较,P=0.000;D:两组外周血CD4+T/CD8+T比值比较,P=0.000

图2流式细胞术检测男性免疫性不育患者机体外周血T细胞亚群分布
Fig2T cell subsets in peripheral blood of male immune infertility patients detected by flow cytometry

图3流式细胞术检测正常对照者机体外周血T细胞亚群分布
Fig3T cell subsets in peripheral blood of normal control subjects detected by flow cytometry


分组例数IFN⁃γmRNAIL⁃4mRNA对照组20462±173705±150免疫性不育组40345±123807±185t27012138P00090037
IFN-γ:γ干扰素;IL- 4:白细胞介素- 4
Th细胞在维持机体稳态方面发挥着重要的作用,其激活后可分泌细胞因子。根据细胞因子的分泌模式,Th 细胞主要分为两类:Th1和Th2。Th1细胞主要分泌IL- 2、IL- 12、IL- 15、肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)和IFN-γ等,而Th2细胞主要分泌IL- 4、IL- 5、IL- 6、IL- 10和IL- 13等[8]。正常情况下,Th1/Th2细胞因子呈动态平衡,以维护机体处于相对稳定的状态。一旦这种平衡遭到破坏,一方不能有效制约另一方,导致Th细胞极化,就会产生免疫紊乱,乃至发生疾病。多种自身免疫性疾病均涉及Th细胞极化,Th1/Th2处于失衡状态。细胞因子在男性生殖系统调节中同样发挥重要作用[9- 11],与之相联系的证据都表明男性免疫性不育可能同样涉及Th 极化,使免疫应答向Th1细胞方向偏离,具有促进Th1细胞应答、抑制Th2细胞活性的特点。本研究通过观察Th1细胞和Th2细胞的效应细胞因子IFN-γ和IL- 4在基因转录水平的表达情况来分析Th1和Th2细胞在免疫性不育患者机体的状态。通过RT-PCR检测IFN-γ mRNA和IL- 4 mRNA的结果发现,IFN-γ mRNA在免疫性不育组的表达量较正常对照组明显上调(P<0.05);相反,IL- 4 mRNA在免疫性不育组的表达量明显下调(P<0.05),表明Th1细胞在免疫性不育患者机体的比例升高,Th2细胞则下降,说明免疫性不育患者机体确实存在Th细胞向Th1方向分化偏移和极化的现象。Th1极化使得Th1细胞分泌更多的IFN-γ和IL- 2等细胞因子,IFN-γ可激活巨噬细胞分泌更多的IL- 2,同时上调IL- 2R在新近激活的CD4+T细胞及Th1细胞上的表达,增加Th1细胞对IL- 2的敏感性,从而增加Th1表型细胞,使T细胞倾向于1型细胞因子反应。
越来越多的证据表明,免疫性不育的发病可能与T细胞功能紊乱及其分泌较多的Th1样细胞因子有关。本研究初步研究发现男性免疫性不育患者的T淋巴细胞功能紊乱及Th细胞分化向Th1方向偏移,但免疫性不育的发病机制仍有很多尚未明确。随着免疫性不育研究机制的不断深入,势必为其治疗提供广阔的前景。
[1]Dong C, Flavell RA. Th1 and Th2 cells[J]. Curr Opin Hematol, 2001, 8: 47- 51.
[2]Sia C. Imbalance in Th cell polarization and its relevance in type 1 diabetes mellitus[J]. Rev Diabet Stud, 2005, 2: 182- 186.
[3]Jiang YH, Wang YQ, Sun KZ. Polarization and immune regulation of TH cells in children with bronchial asthma[J]. Zhongguo Dang Dai Er Ke Za Zhi, 2006, 8: 379- 381.
[4]Olson NC, Sallam R, Doyle MF, et al. T helper cell polarization in healthy people: implications for cardiovascular disease[J]. J Cardiovasc Transl Res, 2013, 6: 772- 786.
[5]谷翊群. 世界卫生组织人类精液检查与处理实验室手册[M]. 5版. 北京: 人民卫生出版社, 2011.
[6]郭应禄, 胡礼泉. 男科学[M]. 北京: 人民卫生出版社, 2005: 937- 952.
[7]Marshburn PB, Kutteh WH. The role of antisperm antibodies in infertility[J]. Fertil Steril, 1994, 61: 799- 811.
[8]何广胜, 周玲, 吴德沛. Thl和Th2细胞的分化调节机制[J]. 中华血液学杂志, 2005, 26:125- 128.
[9]Chaouat G, Zourbas S, Ostojic S, et al. A brief review of recent data on some cytokine expressions at the materno-foetal interface which might challenge the classical Th1/Th2 dichotomy[J]. J Reprod Immunol, 2002, 53: 241- 256.
[10] 周兴, 何清湖. 肝细胞生长因子与男性生殖[J]. 中华男科学杂志, 2015, 21: 747- 752.
[11] 蒋尔鹏. 转化生长因子β超家族在雄性生殖细胞发育中的作用[J]. 中华男科学, 2002, 8: 435- 437.
