缺氧条件下ADAM17-shRNA对人乳腺癌MCF-7细胞侵袭、迁移的影响
2016-04-08蔡准张媛媛张雪鹏吴春涛胡宝山
蔡准,张媛媛,张雪鹏,吴春涛,胡宝山
(华北理工大学附属医院,河北唐山063000)
缺氧条件下ADAM17-shRNA对人乳腺癌MCF-7细胞侵袭、迁移的影响
蔡准,张媛媛,张雪鹏,吴春涛,胡宝山
(华北理工大学附属医院,河北唐山063000)
目的观察缺氧条件下靶向解聚素-金属蛋白酶17(ADAM17)的短发夹RNA(shRNA)对人乳腺癌细胞MCF-7侵袭及迁移能力的影响。方法将对数生长期的MCF-7随机分为观察组、对照组、空白组,分别使用ADAM17-shRNA、无义序列shRNA、等量PBS转染细胞,置于含10%血清及氯化钴的培养基中(模拟缺氧环境)培养。转染48 h采用Real-time PCR法检测各组ADAM17 mRNA表达,体外侵袭实验检测细胞侵袭能力,细胞划痕实验检细胞迁移能力。 结果转染后观察组、对照组、空白组ADAM17 mRNA的相对表达量分别为0.77±0.19、1.19±0.22、1.00±0.01,观察组低于对照组和空白组,P均<0.05。转染后观察组、对照组、空白组穿膜细胞数分别为(37.94±4.97)、(94.84±5.39)、(100.60±5.45)个,观察组低于对照组和空白组,P均<0.05。转染后观察组、对照组、空白组划痕愈合率分别为23.49%±1.68%、57.83%±2.91%、57.02%±2.73%,观察组低于对照组和空白组,P均<0.05。结论缺氧条件下ADAM17-shRNA可抑制MCF-7的侵袭和迁移能力。
乳腺癌;缺氧条件;解聚素-金属蛋白酶17;短发夹RNA ;细胞侵袭;细胞迁移
解聚素-金属蛋白酶(ADAM)是一类具有多种生物学功能的细胞膜表面糖蛋白家族,与肿瘤的发生、侵袭和转移密切相关[1]。ADAM17是研究最多的ADAM家族成员之一,是一种蛋白剪切酶,可通过剪切细胞膜外蛋白功能区使功能区脱落,启动或释放许多结构和功能不同的分子,从而调节细胞的增殖、运动能力等生物学行为[2,3]。本课题组前期研究结果表明,正常环境下靶向沉默ADAM17可抑制人乳腺癌MCF-7细胞的侵袭及迁移[4]。2014年9月~2015年10月,我们观察了缺氧条件下靶向ADAM17的短发夹RNA(ADAM17-shRNA)对人乳腺癌细胞株MCF-7侵袭和迁移的影响,旨在为ADAM17成为乳腺癌靶向治疗的新靶点提供依据。
1 材料与方法
1.1材料MCF-7购自中国医学科学院天津血液学研究所,培养于含10%标准胎牛血清、150 μmol/L氯化钴[5]、50 U/mL青霉素、50 μg/mL链霉素的DMEM培养基中,培养条件为37 ℃、5%CO2。主要试剂:DMEM 高糖培养基、0.25%胰蛋白酶(Hyclone公司);标准胎牛血清(Gibico公司);六合水氯化钴(Sigma公司);Matrigel基质胶、Transwell小室(BD公司);shRNA-ADAM17(上海吉玛公司合成);Lipofectamine2000、SYBR Green qPCR试剂盒、TRIzol、反转录试剂盒均来自Invitrogen公司,引物的设计与合成均由Invitrogen公司合成。主要仪器: 生物安全柜(海尔公司);CO2孵育箱(Forma Scientifi公司);倒置相差显微镜(Nikon);荧光显微镜(Olympus公司);高速冷冻离心机(Sigma公司 );Rotor-Gene3000荧光定量PCR 仪(Gene Company Iimited公司)。
1.2细胞分组及转染取适量对数生长期MCF-7接种于6孔板中,分为观察组、对照组、空白组,每组6个复孔,待细胞融合度达90%以上时分别使用ADAM17-shRNA、无义序列shRNA、等量的PBS转染细胞,置于含10%血清及氯化钴的培养基中培养(模拟缺氧环境),所有操作均严格按照使用说明书进行,荧光显微镜下观察转染效率80%以上则视为转染成功。
1.3MCF-7细胞ADAM17 mRNA表达检测采用Real-time PCR法。转染48 h取适量各组细胞,用TRIzol法提取总RNA,反转录试剂盒合成cDNA,所有操作严格按照使用说明书进行。以β-actin为内参,上游引物:5′-CTGGAACGGTGAAGGTGACA-3′,下游引物:5′-AAGGGACTTCCTGTAACAATGCA-3′;ADAM17上游引物:5′-ATCAAACCCTTTCCTGCG-3′,下游引物:5′-CAAACCCATCCTCGTCCA-3′。反应体系(上游引物 0.5 μL、下游引物 0.5 μL、cDNA 1 μL、DEPC水 8 μL、SYBGREEN 10 μL)放入Rotor-Gene3000 PCR仪中进行RT-PCR扩增,扩增条件:95 ℃、15 s,57 ℃、25 s,40个循环。应用分析软件Rotor-Gene采用2-ΔΔCt相对定量分析法计算各组ADAM17 mRNA的相对表达量。实验重复3次,取平均值。
1.4MCF-7细胞侵袭能力观察采用体外侵袭实验。转染48 h取适量各组细胞,常规消化后调整细胞密度为5×105/mL。各取100 μL加入Transwell上层小室,将聚碳酸酯膜切取下来,进行苏木素染色,用中性树胶封片。100倍光学显微镜下观察穿膜细胞数后进行拍照,随机取5个视野,计算出每个视野内穿出膜的细胞数,计算其平均值。实验重复3次。
1.5MCF-7细胞迁移能力观察采用细胞划痕实验。转染48 h取适量各组细胞,常规消化后调整细胞密度为5×105/mL。细胞融合率达到100%时用10 μL的枪头作笔直划痕,PBS清洗3次,37 ℃、5%CO2培养培养24 h。用Image J软件分析培养0、48 h时的各组划痕情况,计算划痕愈合率[(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%]。实验重复3次,取平均值。
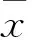
2 结果
2.1各组ADAM17 mRNA表达比较转染48 h观察组、对照组、空白组ADAM17 mRNA的相对表达量分别为0.77±0.19、1.19±0.22、1.00±0.01,观察组低于对照组和空白组,P均<0.05。
2.2各组穿膜细胞数比较转染48 h观察组、对照组、空白组穿膜细胞数分别为(37.94±4.97)、(94.84±5.39)、(100.60±5.45)个,观察组低于对照组和空白组,P均<0.05。
2.3各组划痕愈合率比较转染48 h观察组、对照组、空白组划痕愈合率分别为23.49%±1.68%、57.83%±2.91%、57.02%±2.73%,观察组低于对照组和空白组,P均<0.05。
3 讨论
ADAM是近年新发现的一类细胞膜表面糖蛋白家族,ADAM17是其中一员。研究发现,ADAM17可促进肿瘤血管的形成、细胞增殖及侵袭转移;可影响肿瘤坏死因子、Notch受体和配体、表皮生长因子受体(EGRF)等多种膜蛋白的成熟释放;可通过剪切TGF-α启动EGRF信号通路[6]与Notch信号通路[7],促使肿瘤细胞的局部或远处浸润和转移。RNA干扰(RNAi)是指与靶基因序列同源的双链RNA所诱导的转录后基因沉默现象,已被广泛用于药物靶基因的筛选、肿瘤治疗等领域[8]。Zheng等[9]构建针对ADAM17的shRNA表达载体转染人胶质瘤U87细胞,最终发现U87细胞的增殖、黏附和侵袭能力均降低。诱导表达ADAM17-shRNA可导致人胰腺癌细胞增殖和迁移能力降低[10]。因此,抑制ADAM17的表达可不同程度抑制各种肿瘤的侵袭和增殖能力。
本课题组前期研究发现,正常环境下靶向沉默ADAM17能抑制人乳腺癌MCF-7细胞的侵袭及迁移能力[4]。缺氧是人类实体肿瘤中普遍存在的现象,肿瘤细胞的恶性增殖以及肿瘤组织中血管结构的变异都可以引起肿瘤微环境的缺氧[11]。研究发现,三阴性乳腺癌组织中缺氧诱导因子1α(HIF-1α)呈高表达[12,13]。氯化钴是特异性的HIF-1α诱导剂[14],故本研究用氯化钴于模拟体内细胞低氧环境。结果显示,观察组ADAM17 mRNA的相对表达量、穿膜细胞数低于对照组和空白组,说明沉默ADAM17可抑制肿瘤细胞的侵袭和迁移能力。研究表明,shRNA-HIF-1α能抑制舌癌细胞增殖[15]。HIF-1α信号通路和其他信号通路间也存在交叉调节,形成了细胞低氧应答的特异性和多样性[16]。ADAM17可能与HIF-1α的通路相关,抑制ADAM17D蛋白的表达,可阻止HIF-1α生成的通道,从而降低其侵袭和迁移能力。
综上所述,缺氧条件下ADAM17-shRNA可抑制MCF-7中ADAM17 mRNA的表达,从而抑制细胞迁移及侵袭能力,以增强肿瘤细胞对化疗药物的敏感性,可为于乳腺癌的靶向治疗提供新的思路和方法。
[1] Duffy MJ, Mullooly M, O′Donovan N, et al.The ADAMs family of proteases: new biomarkers and therapeutic targets for cancer[J]. Clin Proteomics , 2011, 8(1):9.
[2] Scheller J, Chalaris A, Garbers C, et al. ADAM17:a molecular switch to control inflammation and tissue regeneranon[J] . Trends Immunol, 2011,32 (8):380-387.
[3] Franovic A, Robert I, Smith K, et al. Multiple acquired renal carcinoma tumor capabilities abolished upon silensing of ADAMI7[J]. Cancer Res,2006,66(16):8083-8090.
[4] 杨雯靖,张雪鹏,焦桂梅,等. ADAM17-shRNA抑制人MCF-7乳腺癌细胞体外侵袭能力的研究[J].天津医药, 2011, 39(11): 1045-1047.
[5] Torii S, Kurihara A, Li XY, et al. Inhibitory effect of extracellular histidine on cobalt-induced HIF-1alpha expression[J]. J Biochem, 2011,149(2): 171-176.
[6] BorreU-Pages M, Rojo F, Albanell J, et al. TALE is required for the activation of the EGFB by TGF-alpha in tumors[J]. EMBO J, 2003, 22(5): 1114-1124.
[7] 章建国, 田薇, 姚婵, 等. 肝细胞肝癌中Notch1蛋白和ADAM17蛋白的表达及其临床意义[J]. 江苏医药, 2012, 38(7):820-823.
[8] Koch A, Kogel KH. New wind in the sails: improving the agronomic value of crop plants through RNAi-mediated gene silencing[J]. Plant Biotechnol J, 2014,12(7):821-831.
[9] Zheng X, Jiang F, Katakowski M, et al. ADAM17 promotes glioma cell malignant phenotype[J]. Mol Carcinog,2012,51(2):150-164.
[10] 吴衡. ADAM17在胰腺癌细胞中的表达及其对细胞增殖迁移的影响[J]. 江苏大学学报(医学版),2015,17(4):299-303.
[11] Chaturvedi P, Gilkes DM, Takano N, et al. Hypoxia-inducible factor-dependent signaling between triple-negative breast cancer cells and mesenchymal stem cells promotes macrophage recruitment[J]. Proc Natl Acad Sci USA,2014,111(20):2120-2129.
[12] 刘锦,李贵新,路中,等. 乳腺癌组织中HIF-1α、VEGF、MVD的表达及意义[J].山东医药,2009,49(6):56-58.
[13] 范凤凤,杨华锋,唐鲁兵,等.缺氧诱导因子1α和Ki67在三阴性乳腺癌中的表达及意义[J].江苏医药,2015,41(3):268-270.
[14] 邓瑾, 叶家才, 廖志伟, 等. 氯化钴诱导缺氧对脑胶质瘤T98G细胞株放射敏感性的影响[J].肿瘤学杂志, 2015, 21(7): 563-566.
[15] 徐香兰,韩冰,燕杰,等. 靶向抑制HIF-1α基因对舌癌细胞增殖活性的影响[J]. 天津医药,2013,39(9):894-897.
[16] 王苹苹,孔繁平,陈学群,等.低氧细胞应激的HIF-1信号通路[J].浙江大学学报(医学版),2011,40(5):559-566.
Effects of ADAM17-shRNA on invasion and migration of MCF-7cells in patients with breast cancer under hypoxia
CAIZhun,ZHANGYuanyuan,ZHANGXuepeng,WUChuntao,HUBaoshan
(AffiliatedHospitalofNorthChinaUniversityofScienceandTechnology,Tangshan063000,China)
ObjectiveTo observe the effects of short hairpin RNA (shRNA) targeting on a disintegrin and metalloproteinase 17 (ADAM17) on the invasion and migration of human breast cancer cells MCF-7 under hypoxia.MethodsMCF-7 cells in the logarithmic phase were divided into the observation group (transfected with ADAM17-shRNA), control group (transfected with ADAM17-nonsense sequence shRNA) and blank group (phosphate-buffered saline, PBS) and then they were all cultured on the medium with 10% FBS (fetal bovine serum) and cobalt chloride. Forty-eight hours after transfection, ADAM17 mRNA expression, invasion and migration abilities of the three groups were detected by real-time PCR, Transwell assay and cell scratch test, respectively. ResultsThe expression of ADAM17mRNA in the observation group, control group and blank group was 0.77±0.19, 1.19±0.22 and 1.00±0.01, respectively. Compared with control group and blank group, the ADAM17 mRNA expression of the observation group was significantly lower (P<0.05). Transwell assay showed the number of MCF-7 cells penetrating into the bottom room through matrigel in the observation group (37.94±4.97) was significantly lower than that in the control group (94.84±5.39) and blank group (100.60±5.45), allP<0.05. Cell scratch test showed that scratch healing rate of the observation group, control group and the blank group was 23.49%±1.68%, 57.83%±2.91% and 57.02%±2.73%, respectively. The healing rate of observation group was significantly lower than that of control group and blank group (allP<0.05). ConclusionThe invasion and migration abilities of human breast cancer MCF-7 cells can be effectively inhibited by ADAM17-shRNA under hypoxia.
breast carcinoma; hypoxic condition; a disintegrin and metalloproteinase 17; short hairpin RNA; cell invasion; cell migration
河北省自然科学基金资助项目(C2010001767);河北省唐山市科学技术研究与发展计划项目(14130256B)。
蔡准(1986-),男,硕士研究生在读,主要研究方向为乳腺癌的综合治疗。E-mail: caizhun1986317@163.com
简介:张雪鹏(1971-),男,博士,主任医师,教授,主要研究方向为乳腺癌的综合治疗。E-mail: syzxp@sina.com
10.3969/j.issn.1002-266X.2016.18.002
R737.5
A
1002-266X(2016)18-0005-03
2015-02-23)
