PRDX1在人胰腺导管腺癌中的表达及其与病理指标的关系
2016-03-30张小薄石刚谭晓冬杨一帆王怀涛
张小薄,石刚,谭晓冬,杨一帆,王怀涛
(1.中国医科大学附属盛京医院普通外科,辽宁沈阳110004;2.辽宁省肿瘤医院大肠外科,辽宁沈阳110042)
PRDX1在人胰腺导管腺癌中的表达及其与病理指标的关系
张小薄1,石刚2,谭晓冬1,杨一帆1,王怀涛1
(1.中国医科大学附属盛京医院普通外科,辽宁沈阳110004;2.辽宁省肿瘤医院大肠外科,辽宁沈阳110042)
[摘 要]目的 探讨过氧化还原蛋白1(peroxiredoxin 1,PRDX1)在胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)中的表达及与临床病理学参数的关系并评价其判断预后的价值。方法 采用免疫组织化学法分析117例PDAC组织石蜡切片及41例癌旁正常胰腺组织石蜡切片中的PRDX1表达,对PRDX1表达水平与临床病理指标进行相关性分析,进行生存分析。采用Western blotting和实时定量PCR(qRT-PCR)检测9对配对新鲜PDAC组织及癌旁正常胰腺组织中PRDX1蛋白质和mRNA水平的表达。结果 免疫组化显示PRDX1在PDAC中表达阳性率高于癌旁正常胰腺组织,差异有统计学意义(x2=9.761,P<0.01);新鲜PDAC中PRDX1蛋白及mRNA表达明显高于配对的癌旁正常胰腺组织(t=9.187,P<0.01;t=7.829,P<0.011);PRDX1表达与肿瘤直径、肿瘤TNM分期、淋巴结转移、病理分级有关(x2=8.876,P<0.01;x2=4.342,P<0.05;x2=9.273,P<0.01;x2=6.943,P<0.01);PRDX1与术后复发率相关(x2=7.326,P<0.01),PRDX1表达与生存期呈负相关(r=-0.845,P<0.05)。结论 PRDX1表达与PDAC的恶性程度有关,可作为判断PDAC预后的预测因素。
[关键词]胰腺导管腺癌;过氧化还原蛋白1(PRDX1);生存分析
Expression and pathological signi■cance of peroxiredoxin 1 in human pancreatic ductal adenocarcinoma ZHANG Xiao-bao1, SHI Gang2, TAN Xiao-dong1, YANG Yi-fan1, WANG Huai-tao1.1Department of General Surgery, Shengjing Hospital Af■liated to China Medical University, Shenyang 110001, China;2Department of Colorectal Surgery, Liaoning Cancer Hospital, Shenyang 110042, China
Abstract ObjectiveTo explore the clinicopathological significance of PRDX1 expression in pancreatic ductal adenocarcinoma (PDAC) and evaluate its prognostic value.MethodsImmunohistochemistry was used to detect the expression of PRDX1 in 117 paraf■n-embedded PDAC specimens and 41 adjacent non-cancerous pancreatic tissues, the correlation between PRDX1 expression and clincopathological characteristics, survival and multifactor analysis were carried out.Western blotting and quantitative real-time polymerase chain reaction (qRTPCR) were used to detect the protein and mRNA expression in 9 paired fresh PDAC specimens and adjuvant noncancerous pancreatic tissues.ResultsPRDX1 was signi■cantly over-expressed in PDAC than that in adjacent non-cancerous pancreatic tissues (x2=9.761, P<0.01).Western blotting and qRT-PCR showed that PRDX1 expression at protein and mRNA level were higher in PDAC tissues than those in adjacent non-cancerous pancreatic tissues (t=9.187, P<0.01; t=7.829, P<0.01).Tumor size, TNM stage, lymph node metastasis and pathological grade were correlated with the expression of PRDX1 (x2=8.876, P<0.01; x2=4.342, P<0.05; x2=9.273, P<0.01; x2=6.943, P<0.01).Post-operation recurrence rate was correlated with PRDX1 expression (x2=7.326, P<0.01).The PRDX1 expression was negatively correlated with survival time (r=-0.845, P<0.05).ConclusionPRDX1 expression is correlated with the malignant degree of PDAC and which may be used to predict the prognosis of PDAC.
Key words pancreatic ductal adenocarcinoma; peroxiredoxin 1; survival analysis
胰腺癌在发病早期即发生转移,是复发率及死亡率最高的消化系恶性肿瘤之一,其中胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)占胰腺癌病理分型的80%以上[1-2]。过氧化还原蛋白(peroxiredoxins,PRDXs)是一类抗氧化酶,对细胞氧化活性具有调控作用,从而影响着细胞的分化、增殖及凋亡等生物学功能[3]。PRDX1是PRDXs家族重要成员之一,对其在恶性肿瘤中的作用,存在着抑癌及促癌两种不同的观点:PRDX1在乳腺癌、肝癌、直肠癌及前列腺癌中为高表达,与肿瘤的恶性程度呈现正相关;而在膀胱癌及黑色素瘤中为低表达,表现为抑癌基因[4-5]。PRDX1在胰腺癌中的研究较少,本研究采用免疫组化、Western blotting及qRT-PCR方法检测PRDX1在胰腺癌组织中的表达,并将其与临床病理指标进行相关性及生存分析,目的在于评价PRDX1表达水平与胰腺癌病理特征的相关性及其对胰腺癌预后的预测价值。
1 材料和方法
1.1病例选择与标本来源
选取2009年2月至2011年12月期间于中国医科大学附属盛京医院普通外科及辽宁省肿瘤医院外科手术切除的PDAC组织石蜡切片117例及癌旁组织石蜡切片41例,其中9例PDAC及配对的癌旁组织标本在手术切除后即刻取样,置于液氮中冷冻保存。组织切片相对应的病例临床资料进行采集,电话及门诊复查形式随访,临床资料见表1。
1.2实验试剂
PRDX1山羊多克隆抗体购自美国Biorbyt公司,SP免疫组织化学试剂盒购自Sigma公司。蛋白提取试剂盒购自大连宝生物工程有限公司,TRIzol购自美国Invitrogen公司,All-in-OneTMqPCR Mix试剂盒购自南京凯基生物公司。引物由上海吉玛制药技术有限公司设计合成,PRDX1上游引物:5′-GCGACTGATCTGCG TGGCC-3′,下游引物:5′-GCCTACTGGGATGAGAGC-3′;GAPDH上游引物:5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物:5′-TGGTGAAGACGCCAGTGGA-3′。
1.3实验方法
1.3.1 免疫组化实验:以磷酸盐缓冲液(phosphate buffer solution,PBS)代替一抗的PDAC组织染色切片结果作为阴性对照。PDAC术后快速切取部分标本PDAC组织和癌旁胰腺组织,于10%甲醛中固定18~24 h,脱水及石蜡包埋,4 μm切片后置于60 ℃烤箱2 h,切片进行脱水、脱蜡及抗原修复。3% H2O2每片给予50 mL,置于37 ℃烤箱25 min后PBS洗3次,加入1:400稀释PRDX1山羊多克隆抗体湿盒中4 ℃条件下孵育过夜。室温复温20 min后,PBS洗3次,加入II抗37 ℃温箱30 min。二氨基联苯胺显色后苏木素复染5~10 min。自来水洗净后盐酸酒精进行分化10~20 s,流水冲洗30 min后脱水及透明,中性树胶进行封片。
结果判定:根据染色阳性细胞占总细胞数百分比及阳性细胞着色的强度两项指标综合进行结果判断。阳性细胞占一个视野(×200)中所有细胞总数百分比:阳性细胞数≤10%为1分;11%~50%为2分;51%~70%为3分;≥71%为4分。显色程度判断阳性强度:无染色色为0分;浅染棕黄色为1分;较深棕黄色为2分;深棕黄色并且有浓染颗粒为3分。根据两项分数之和将标本分为四组:1分阴性(-);2~3分弱阳性(+);4~5分中度阳性(++);6~7分强阳性(+++)。3~7分标本为阳性染色。评分由2名高年资病理科主任医师盲法单独完成。肿瘤根据以上评分分为两组:低表达组为阴性(-)和阳性(+);高表达组为中度阳性(++)和强阳性(+++)。
1.3.2 Western blotting分析:按说明书提取胰腺癌组织及癌旁组织中蛋白,BCA定量试剂盒进行蛋白浓度测定,样品均定量至4 μg/μL,每条泳道均上样50 μg蛋白,经12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,70 V电压下电泳80 min,电转移至PVDF膜。5%脱脂奶粉封闭2 h后加入1:100稀释I抗。4 ℃孵育下过夜,TBST洗膜后二抗室温孵育1.5 h,TBST清洗后采用ECL发光并以凝胶显像仪显像。
1.3.3 qRT-PCR分析:采用RNA分离试剂盒Trizol提取并纯化组织总RNA;所有RNA样本浓度均稀释到1 μg/μL,依据逆转录及扩增试剂盒说明书进行逆转录及扩增。RT-PCR反应体系(2×All-in-One qPCR Mix,10 μL;50×Syber Green,2 μL;Primer F,1 μL;Primer R,1 μL;cDNA,2 μL;ddH2O,4 μL),反应条件:95 ℃ 10 min预变性;95 ℃ 10 s变性、60 ℃ 20 s退火、72 ℃ 10 s延伸,40个循环。所有反应均设立了复孔,并以DEPC水代替模板,cDNA为阴性对照。
1.4统计学分析
采用PASW Statistics18.0软件进行作图及统计分析。配对的癌与癌旁组织蛋白和mRNA表达水平比较采用配对t检验,率的比较采用x2检验,生存曲线采用Kaplan-Meier法,P<0.05为差异具有统计学意义。
2 结果
2.1组织中PRDX1免疫组化染色
PRDX1表达集中于PDAC导管近膜细胞浆,在癌旁组织中PRDX1无表达或轻度表达,二者对比差异有统计学意义(x2=9.761,P<0.01),见图1。
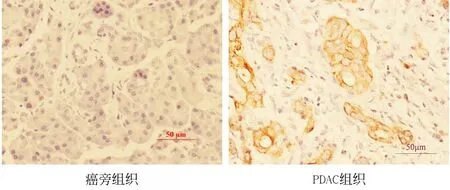
图1 免疫组化检测PRDX1在癌旁组织及PDAC组织中表达(×200)
2.2组织中PRDX1表达的Western blotting检测结果
PRDX1在9例胰腺癌中蛋白表达明显高于配对的癌旁正常胰腺组织[(17.493±3.562) vs (10.547± 2.593),t=9.187,P<0.01],见图2。
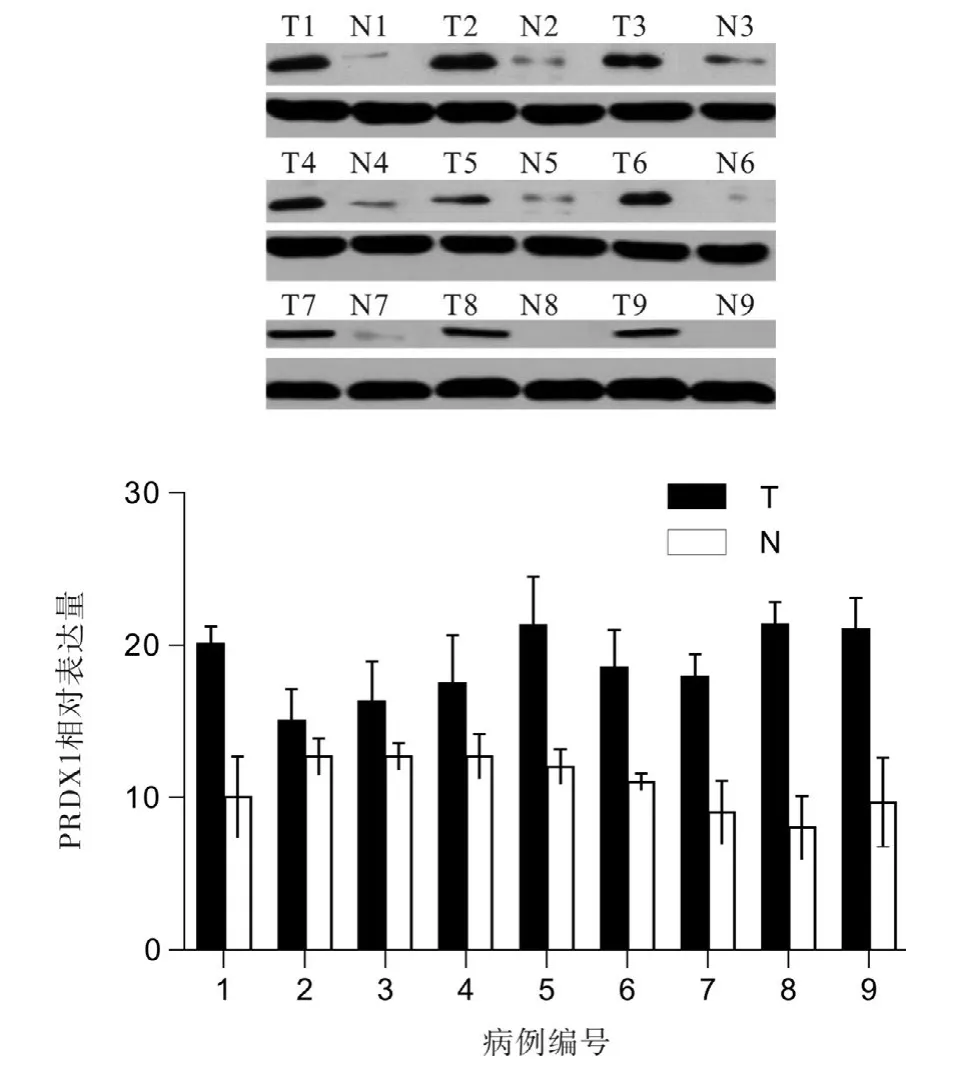
图2 Western blotting检测PDAC组织及配对正常癌旁组织中PRDX1蛋白表达
2.3组织中PRDX1 mRNA表达的qRT-PCR检测结果
PRDX1 mRNA在9例胰腺癌中表达明显高于配对的癌旁组织[(1.947±0.537) vs (1.004±0.486),t=7.829,P<0.01],见图3。
2.4PRDX1表达与PDAC临床病理特征关系
PRDX1表达与临床相关指标的关系如表2所示,PRDX1与肿瘤位置、患者性别、年龄无关(P均>0.05);肿瘤直径(P<0.01)、肿瘤TNM分期(P<0.05)、淋巴结转移(P<0.01)、病理分级(P<0.01)有关。

T:PDAC组织,N:癌旁组织
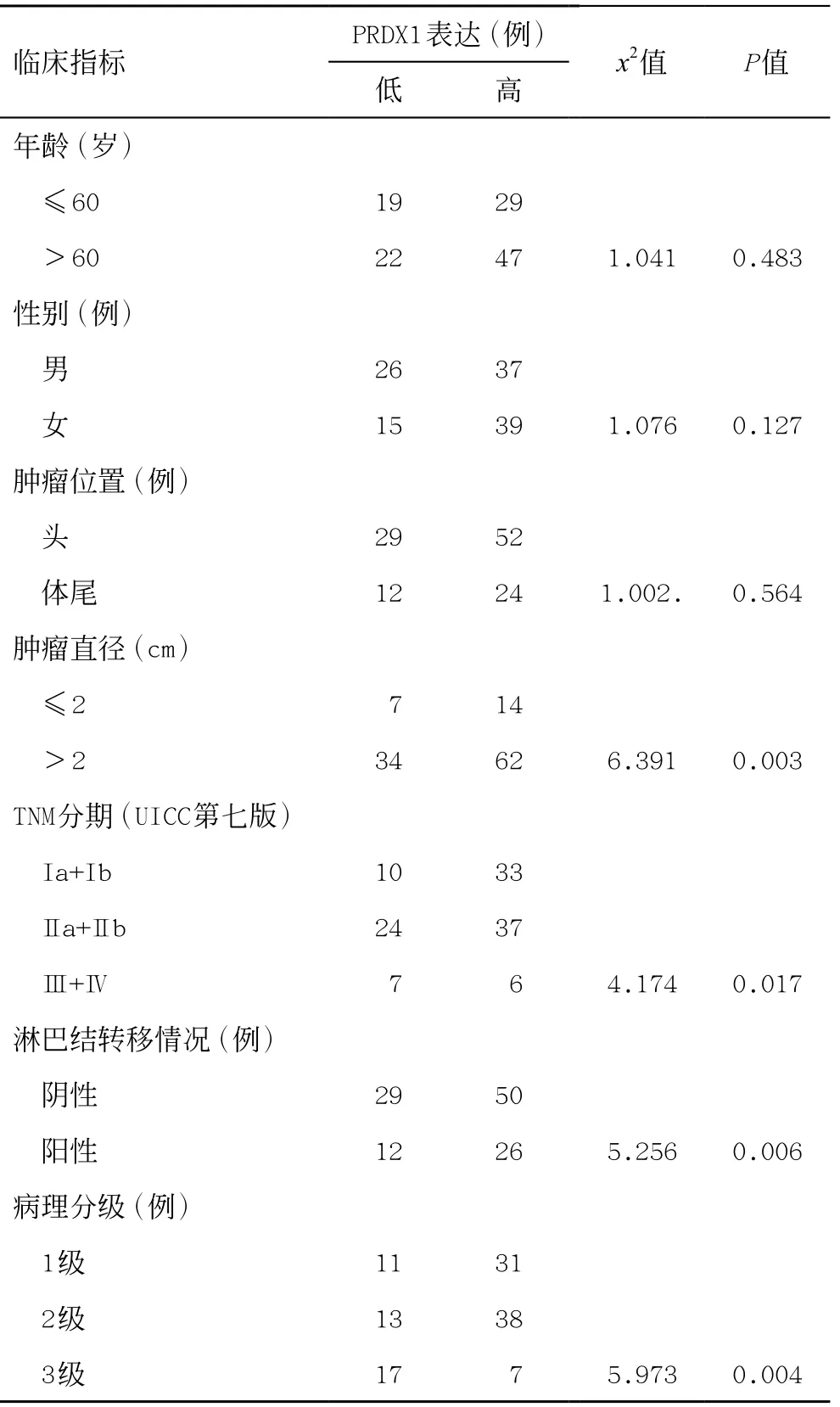
表1 在PDAC中PRDX1表达与临床指标的关系
2.5PRDX1与PDAC术后复发率的关系
117例中104例(88.89%)TNM I、II期患者均行根治性胰十二指肠切除术或胰体尾切除术,其中随访期内失访9例,3例无复发死于其他疾病(死亡原因为心肌梗塞、高血压脑出血及糖尿病肾病),随访期内92例纳入复发率分析,术后复发率为69.57% (64/92)。PRDX1与PDAC的复发有关(x2=7.326,P<0.01),见表2。
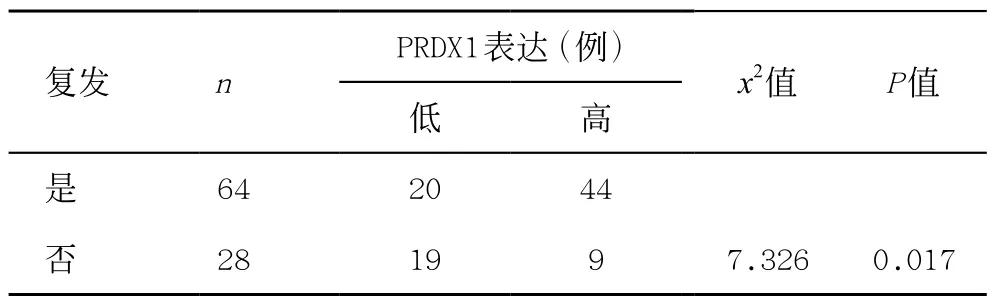
表2 PRDX1表达与PDAC术后复发的关系
2.6PRDX1在PDAC中表达与生存分析
总生存期是自手术日到患者因PDAC复发死亡的时间。因其他疾病死亡或随访期内生存病例作为截尾事件处理,可用于生存分析病例为105/117。中位随访时间为14个月;1年、2年、3年、4年及5年生存率分别为72/105(68.57%)、53/105(50.48%),23/105(21.9%),9/105(8.57%)及6/105(5.71%);在随访终点,79例病人死于PDAC复发、转移及并发症,Kaplan-Meier单因素生存分析显示PRDX1表达与生存期呈负相关(r=-0.845,P<0.05),PRDX1表达低的患者生存期较长,表达高的患者生存期较短,见图4。
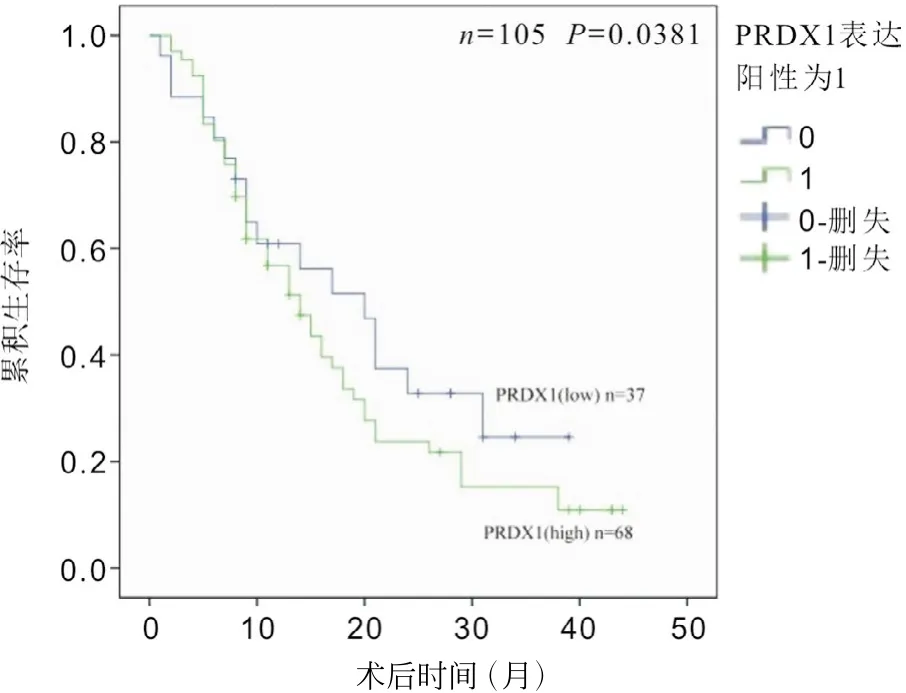
图4 PRDX1表达水平与生存率关系的Kaplan-Meier分析
3 讨论
胰腺癌以发现晚、复发及转移发生率高为特点,目前的治疗方法无论是根治性为目的手术治疗,还是化疗及放疗均不能明显改善生存率[7-8]。早发现、早诊断及早治疗仍然是胰腺癌治疗提高生存率的基础,基因治疗是目前的研究方向[9-10]。PRDXs家族能有效的清除氧自由基等有害物质,与过氧化物酶、过氧化氢酶、超氧化物歧化酶及谷胱甘肽等构建了细胞防御系统[11-12]。PRDX1是其家族中最主要成员之一,其表达水平在恶性肿瘤中的作用尚不明确,有研究认为,过表达PRDX1后,薯蓣皂苷诱导MiaPaCa-2细胞内活性氧簇水平上升和凋亡的作用明显受到抑制,PRDX1在离体胰腺癌细胞中过表达,在肝癌细胞中也得出相似的结论[13]。
本研究发现,PRDX1在PDAC组织中呈现高表达,而在癌旁正常胰腺组织中低表达或无表达。PRDX1在胰腺组织中高表达,表明其可能与胰腺癌的发生、发展及恶性行为存在密切相关性,其表达水平与肿瘤直径、TNM分期及淋巴转移的相关性进一步说明PRDX1与肿瘤增殖、细胞分化、浸润及转移行为有关。PRDX1与病理分级有关,说明其与胰腺癌细胞的分化程度有关。目前肿瘤直径在2 cm以下的早期发现率仍较低,但随着诊断手段改进及全民体检意识提高,胰腺癌的早期确诊率及体检发现率为上升趋势[14]。有研究显示,PRDX1通过发挥抗氧化性、分子伴侣及信号调节等功能参与维持细胞稳态,并通过多种信号的转导途径参与肿瘤发生、发展、浸润、转移、血管生成及放化疗抗性[15]。PRDX1可抑制因DNA损伤诱导的肿瘤细胞死亡,因此对正常细胞及肿瘤细胞均有保护作用,具有抑癌及促癌双重表观。本研究显示,虽然大部分患者均在术前明确为TNM I、II期可进行手术治疗的患者,并均进行了根治性为目的的胰十二指肠切除术或胰体尾切除术,随访期内术后复发率仍为69.57%,PRDX1与PDAC的复发率有关,4年及5年生存率仍较低,PRDX1表达与生存期有关。PDAC死亡原因以局部复发、肝转移、腹腔转移及淋巴结转移为主,根治性手术仍然是目前胰腺癌治疗的首选方法,但是对早中期患者进行根治性为目地的手术仍然不能明显降低胰腺癌的复发率及死亡率,表明转移早是胰腺癌恶性度高的首要原因。PRDX1主要生物学功能是抗氧化,参与细胞分化、增殖、凋亡、转移及浸润,通过多种信号通路调控肿瘤细胞的生物学行为,因此,PRDX1在不同的肿瘤中通过不同的通路发挥作用,由于其调控的通路作用机制不同,对恶性肿瘤行为的调控也不同[18]。组织中蛋白及mRNA检测也显示PRDX1在PDAC组织中为高表达,这种高表达在mRNA水平已经表现出来,因此,PRDX1对胰腺癌细胞的作用在基因水平即已发生。PRDX1在肿瘤发生及发展中具有双重作用,在癌变前期,细胞在多基因多因素调控下可能转化为癌细胞,PRDX1通过清除活性氧,可抑制细胞衰老,降低癌变发生,但是如果肿瘤细胞已经形成,其抗氧化作用同时对肿瘤细胞也具有保护作用[15]。
PRDX1可以作为评估PDAC远期生存率、转移和肿瘤细胞扩增的标记物之一,也是干细胞治疗的可能策略之一。因此,对于PRDX1及其家族成员在胰腺癌中的生物学功能进行进一步深入研究,具有深远的意义。
参考文献:
[1]FRAKES J M, STROM T, SPRINGETT G M, et al.Resected pancreatic cancer outcomes in the elderly[J].J Geriatr Oncol, 2015, 6(2):127-132 .
[2]POURHOSEINGHOLI M A, VAHEDI M, BAGHESTANI A R.Burden of gastrointestinal cancer in Asia; an overview[J].Gastroenterol Hepatol Bed Bench, 2015, 8(1):19-27.
[3]SUENAGA S, KURAMITSU Y, WANG Y, et al.Human pancreatic cancer cells with acquired gemcitabine resistance exhibit signi■cant up-regulation of peroxiredoxin-2 compared to sensitive parental cells[J].Anticancer Res, 2013, 33(11):4821-4826.
[4]WOLF G, AUMANN N, MICHALSKA M, et al.Peroxiredoxin III protects pancreatic ß cells from apoptosis[J].J Endocrinol, 2010, 207(2):163-175.
[5]CHEN J H, NI R Z, XIAO M B, et al.Comparative proteomic analysis of differentially expressed proteins in human pancreatic cancer tissue[J].Hepatobiliary Pancreat Dis Int, 2009, 8(2):193-200.
[6]MUNIGALA S, KANWAL F, XIAN H, et al.New diagnosis of chronic pancreatitis:risk of missing an underlying pancreatic cancer[J].Am J Gastroenterol, 2014,109(1):1824-1830.
[7]XIAO J, PENG F, YU C, et al.microRNA-137 modulates pancreatic cancer cells tumor growth, invasion and sensitivity to chemotherapy[J].Int J Clin Exp Pathol, 2014, 7(11):7442-7450.
[8]ANSARI D, GUSTAFSSON A, ANDERSSON R.Update on the management of pancreatic cancer:Surgery is not enough[J].World J Gastroenterol.2015, 21(11):3157-3165.
[9]SINGH H M, UNGERECHTS G, TSIMBERIDOU A M.Gene and cell therapy for pancreatic cancer[J].Expert Opin Biol Ther, 2015, 15(4):505-516.
[10]TAVANO F, PAZIENZA V, FONTANA A, et al.SIRT1 and circadian gene expression in pancreatic ductal adenocarcinoma:Effect of starvation[J].Chronobiol Int, 2015, 32(4):497-512.
[11]CAI C Y, ZHAI L L, WU Y, et al.Expression and clinical value of peroxiredoxin-1 in patients with pancreatic cancer[J].Eur J Surg Oncol, 2015, 41(2):228-235.
[12]TANIUCHI K, FURIHATA M, HANAZAKI K, et al.Peroxiredoxin 1 promotes pancreatic cancer cell invasion by modulating p38 MAPK activity[J].Pancreas.2015, 44(2):331-340.
[13]ABDUL RAHMAN SAZLI F, JUBRI Z, ABDUL RAHMAN M, et al.Gamma-tocotrienol treatment increased peroxiredoxin-4 expression in HepG2 liver cancer cell line[J].BMC Complement Altern Med, 2015, 15:64.
[14]KIM E J, SEMRAD T J, BOLD R J.Phase II clinical trials on investigational drugs for the treatment of pancreatic cancers[J].Expert Opin Investig Drugs, 2015, 24(6):781-794.
[15]ISMAIL S, MAYAH W, BATTIA H E, et al.Plasma nuclear factor kappa B and serum peroxiredoxin 3 in early diagnosis of hepatocellular carcinoma[J].Asian Pac J Cancer Prev, 2015, 16(4):1657-1663.
(本文编辑:张海燕,鲁翠涛)
[通讯作者简介]谭晓冬,主任医师,教授,博士生导师,E-mail:tanxd@hotmail.com。
作者简介][第一张小薄(1979-),男,河北昌黎人,主治医师。
[基金项目]辽宁省自然科学基金项目(2014021006)。
[收稿日期]2015-05-15
[中图分类号]R735.9
[文献标识码]A
DOI:10.11952/j.issn.1007-1954.2016.01.008
