右美托咪定对胃癌根治术病人Th1/Th2相关炎症因子表达的影响
2016-03-30刘洋王守田
刘洋 王守田
右美托咪定对胃癌根治术病人Th1/Th2相关炎症因子表达的影响
刘洋 王守田
【摘要】目的 观察右美托咪定(Dex)对胃癌根治术病人围手术期Th1/Th2等相关炎症因子的影响。方法 选择2014年2月—2015年4月在铁岭市中心医院择期行胃癌根治术病人72例,采用随机数字表法将其分为右美托咪定组(Dex组)和生理盐水对照组(C组)各36例。Dex组于插管前注射Dex 0.5 μg/kg,而后以0.2~0.7 μg/(kg・h)泵注至手术结束;C组在相同时间注射同等剂量的生理盐水;分别于诱导前(T0)、术后2 h(T1)、手术完成后1 d(T2)、手术完成后3 d(T3)4个时间点采集静脉血,ELISA试剂盒检测血浆中白细胞介素6(IL-6)、白细胞介素10(IL-10)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)水平;另用流式细胞仪检测计算Thl/Th2比值。结果 组内比较:C组T2、T3时间点IFN-γ浓度显著低于T0时间点(P<0.05),T2、T3时间点TNF-α、IL-6、IL-10浓度显著高于T0时间点(P<0.05);Dex组IFN-γ、IL-6、TNF-α、IL-10浓度在各时间点差异无统计学意义(P>0.05)。T2、T3时间点组间比较:Dex组IFN-γ浓度明显高于C组(P<0.05),TNF-α、IL-6、IL-10浓度显著低于C组(P<0.05)。Dex组各时点Thl/Th2无明显变化(P>0.05);C组在T2和T3时点Thl/Th2明显升高(P<0.05),与Dex组比较差异有统计学意义(P<0.05)。结论 Dex能够抑制围手术期IFN-γ表达下降和TNF-α、IL-6、IL-10表达上升,改善Thl/Th2平衡,缓解对机体免疫反应的抑制,预后效果更好。
【关键词】胃癌;手术治疗;根治术;围手术期;右美托咪定;炎症因子;Th1/Th2
右美托咪定(dexmedetomidine,Dex)是一种新型蓝斑α2肾上腺素能受体激动剂,主要作用于中枢神经系统及周围神经系统的交感神经末梢,可以降低去甲肾上腺素的释放,具有镇静、镇痛、抗交感神经等效应[1]。已有研究表明,Dex在围手术期具有保持心血管稳定的积极作用,且对机体的应激反应有一定程度的抑制作用[2]。胃癌根治术由于将原发肿瘤及其他受累浸润组织一同切除,进而会引起病人的全身应激反应[3]。因此,减轻机体应激反应、减少机体免疫抑制,对病人术后尽快恢复、降低并发症发生率具有重要意义。本研究通过对行胃癌根治术的病人在手术期间注入右美托咪定,观察机体在围手术期Th1和Th2相关炎症因子表达的变化,进而探究Dex对于胃癌根治术病人应激反应和免疫反应的影响。
1 资料与方法
1.1 一般资料 选择2014年2月—2015年4月在铁岭市中心医院择期行胃癌根治术的72例病人,男43例、女29例;美国麻醉师协会麻醉分级(ASA)Ⅰ~Ⅱ级;所有病人无肥胖、内分泌系统疾病、严重器质性疾病、慢性感染性疾病及免疫系统疾病等;研究对象均经我院伦理委员会批准,并且在病人及其家属知情并同意下,签署知情同意书后实施本研究;采用随机数字表法将其分为右美托咪定组(Dex组)和生理盐水对照组(C组)各36例,两组病人性别、年龄、体重等一般资料差异无统计学意义(P>0.05)。
1.2 麻醉方法 病人术前常规禁食禁饮;入室前30 min肌内注射0.1 g苯巴比妥钠和0.5 mg阿托品;入室后在局部麻醉下行桡动脉穿刺置管,监测血压(MAP)、心率(HR)及脉搏氧饱和度(SpO2)等指标;两组诱导麻醉均采用咪达唑仑0.5 mg/kg、芬太尼2~3 μg/kg、丙泊酚1~2 mg/kg、阿曲库铵0.2~0.6 mg/kg;气管插管后接麻醉机行机械通气,维持呼气末二氧化碳分压(PETCO2)35~45 mm Hg、潮气量8~10 mL/kg、呼吸频率10~12次/min、呼吸比1:2;维持麻醉采用芬太尼、丙泊酚、阿曲库铵等药物,根据病人自身情况调整用量;Dex组于诱导开始10 min内静脉泵入Dex 0.50 μg/kg,而后采用0.2~0.7 μg/(kg・h)持续泵入至手术结束;C组采用同样的方式和剂量泵注生理盐水;手术结束后,逐步停药,待病人清醒、生命体征平稳、无不适等表现时行气管拔管,送回病房。
1.3 样本采集与检测 记录病人一般资料,分别于诱导前(T0)、术后2 h(T1)、手术完成后1 d(T2)、手术完成后3 d(T3)4个时间点采集静脉血,以3 000转/min离心5 min,取上清液用ELISA试剂盒检测血浆白细胞介素6(IL-6)、白细胞介素10(IL-10)、肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)。另取肝素钠抗凝的静脉血,加入淋巴细胞刺激剂及蛋白转运抑制剂,混匀后,置37℃ 5% CO2培养箱中培养4 h,分别加入FITCIFN-γ和PE-IL-10抗体,送检验科用流式细胞仪检测CD3+ CD8-IFN-γ+和CD3+ CD8- IL-10+细胞,并计算Thl/Th2比值。
1.4 统计分析 应用SPSS 19.0软件对数据进行统计分析,计量资料用均数+标准差表示,组间比较应用配对样本t检验,组内不同时间点比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组相关炎症因子比较 ELISA结果见表1。组内比较:C组T2、T3时间点IFN-γ浓度显著低于T0时间点(P<0.05),T2、T3时间点TNF-α、IL-6、IL-10浓度显著高于T0时间点(P<0.05);Dex组IFN-γ、IL-6、TNF-α、IL-10浓度在各时间点差异无统计学意义(P>0.05)。T2、T3时间点组间比较:Dex组IFN-γ浓度明显高于C组(P<0.05),TNF-α、IL-6、IL-10浓度显著低于C组(P<0.05)。
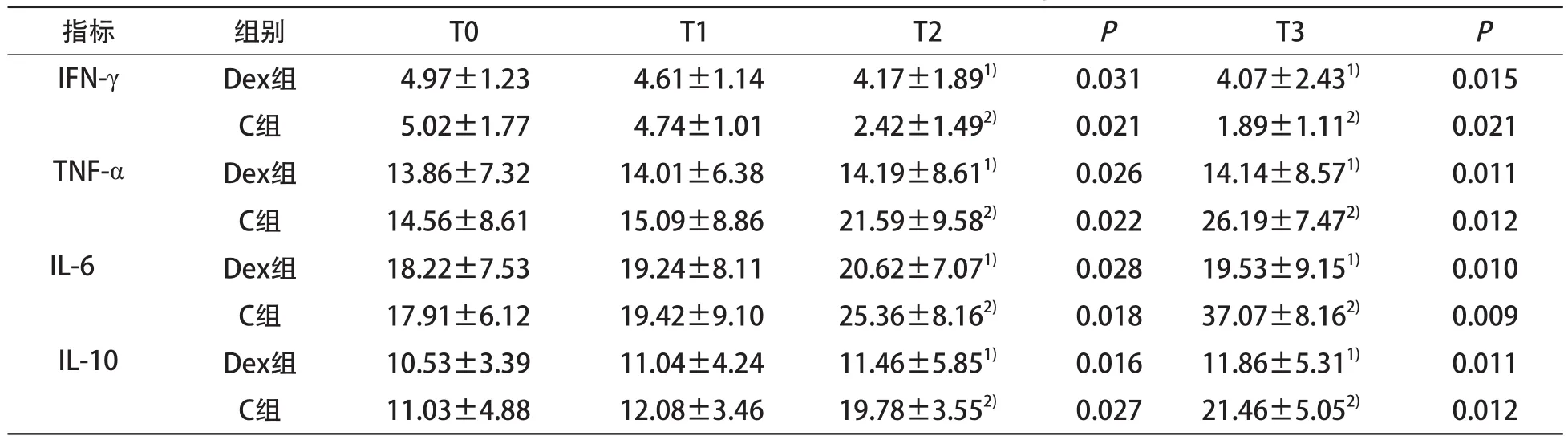
表1 两组围术期炎症相关因子变化情况 (pg/mL)
2.2 两组Thl/Th2比较 Dex组各时点Thl/Th2无明显变化(P>0.05);C组在T2和T3时点Thl/Th2明显升高(P<0.05),与Dex组比较差异有统计学意义(P<0.05)。见表2。
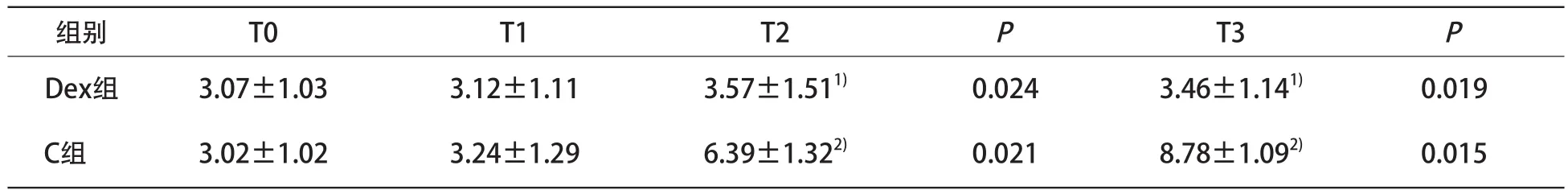
表2 两组Th1/Th2比较
3 讨论
胃癌的发生发展与T细胞、巨噬细胞改变及免疫平衡破坏微环境有关,而体内微环境涉及机体炎症反应的各种细胞因子。Th1和Th2相关炎症因子是反映机体在围手术期应激反应和免疫调节状况最具代表性的一类细胞因子,其中比较重要的有γ干扰素(IFN-γ)、α肿瘤坏死因子(TNF-α)、白细胞介素6(IL-6)、白细胞介素10(IL-10)等[4]。IFN-γ 为Th1细胞分泌的细胞因子,可以激活巨噬细胞,引起细胞免疫。TNF-α也由Th1细胞分泌,常见于组织损伤早期,具有触发和启动全身炎性反应的作用。IL-6和IL-10由Th2细胞产生:IL-6是机体应激反应中最为灵敏和重要的标志物,可以激活下丘脑-垂体-肾上腺轴,促进机体释放糖皮质激素和儿茶酚胺等,引起应激反应[5];IL-10可以介导抗体的产生;二者均可抑制机体的免疫功能。而病人的免疫状况是影响其术后转归的重要因素,减轻病人围手术期的应激反应可以缓解手术带来的免疫反应抑制,对病人的康复非常有利。本研究对胃癌根治术围手术期病人Th1/Th2等相关炎症因子进行检测,结果显示,IFN-γ、IL-6、TNF-α和IL-10各指标均明显升高,可见,炎症因子的变化在肿瘤的发生发展中起主要作用。
临床手术中,机体因切除肿瘤及受累浸润组织而产生强烈的应激反应,这时机体释放促肾上腺皮质激素、儿茶酚胺和皮质醇,通过下丘脑-垂体-肾上腺轴和自主神经系统抑制免疫功能[6]。儿茶酚胺和皮质醇通过细胞内信号通路,抑制IFN-γ释放,促进IL-6、IL-10等Th2类细胞因子产生。Dex是一种高选择性α2肾上腺素受体激动剂,可通过激动突触前膜α2受体,抑制去甲肾上腺素释放,维持血流动力学稳定,当循环血量减少时,可使心输出量重新分配,保证重要脏器的灌注,维持血流量,对肾脏、心脏等器官起到保护作用[7]。本研究观察右美托咪定(Dex)对胃癌根治术病人围手术期Th1/Th2相关炎症因子的影响,结果显示,对照组IFN-γ作为促进免疫的细胞因子表达明显下降,TNF-α、IL-6、IL-10等引起机体应激反应、抑制免疫反应的细胞因子表达明显增多;右美托咪定组中,IFN-γ并未出现明显下降,TNF-α、IL-6、IL-10也未出现明显升高,这说明Dex在一定程度上减轻了机体在围手术期的应激反应,缓解了机体免疫功能的抑制,间接改善细胞免疫功能。
综上,在胃癌根治术手术期间使用右美托咪定可以有效减轻机体血浆IFN-γ表达下降,抑制血浆TNF-α、IL-6、IL-10浓度升高,在一定程度上缓解了病人的应激反应,降低了机体免疫反应抑制,这对病人术后康复和降低因手术产生的并发症具有重要意义。
参考文献:
[1] Giovannitti JA Jr, Thoms SM, Crawford JJ. Alpha-2 adrenergic receptor agonists: a review of current clinical applications[J]. Anesth Prog, 2015, 62(1): 31-39.
[2] Peng K, Wu SR, Ji FH, et al. Premedication with dexmedetomidine in pediatric patients: a systematic review and meta-analysis[J]. Clinics(Sao Paulo), 2014, 69(11): 777-786.
[3] Zou Z, Mou T, Deng Z, et al. Exploration of digestive tract reconstruction with totally laparoscopic total gastrectomy for gastric cancer[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2014, 17(8): 844-847.
[4] Li YJ, Huo TT, Xing J, et al. Meta-analysis of efficacy and safety of fast-track surgery in gastrectomy for gastric cancer[J]. World J Surg, 2014, 38(12): 3142-3151.
[5] Takemoto K, Komatsu S, Okamoto K, et al. A novel treatment strategy using trafermin, containing basic fibroblast growth factor, for intractable duodenal fistula following curative gastrectomy for gastric cancer-case report and literature review[J]. Gan To Kagaku Ryoho, 2012, 39(12): 1960-1962.
[6] Mori T, Miyamoto T, Yoshida H, et al. IL-1β and TNFαinitiated IL-6-STAT3 pathway is critical in mediating inflammatory cytokine and RANKL expression in inflammatory arthritis[J]. Int Immunol, 2011, 23(11): 701-712.
[7] Wu LM, Jiang XJ, Lin QF, et al. Comparative study of clinical efficacy of laparoscopy-assisted radical gastrectomy versus open radical gastrectomy for advanced gastric cancer[J]. Genet Mol Res, 2015, 14(2): 3459-3465.
自 我 测 试
收稿日期:(2015-08-12)
【文章编号】1672-7185(2016)01-0073-03
doi:10.3969/j.issn.1672-7185.2016.01.034
【中图分类号】R737
【文献标识码】A
基金项目:辽宁省科技攻关项目(2013225220)作者单位:112001 辽宁 铁岭,铁岭市中心医院麻醉科通讯作者:王守田,E-mail:3184364393@qq.com
