牛乳清结晶条件的探索及其结晶体形貌
2016-03-28俞越钱浙江工业大学化学工程学院浙江杭州310014
俞越钱(浙江工业大学化学工程学院,浙江 杭州310014)
牛乳清结晶条件的探索及其结晶体形貌
俞越钱
(浙江工业大学化学工程学院,浙江杭州310014)
摘要:以脱脂及去酪蛋白的牛乳清为原料,利用紫外分光光度法及SDS-PAGE电泳技术,在pH 4.7~8.0,NaCl浓度0.5~2.0 mol/L条件下,对其结晶情况进行了研究。结果表明:牛乳清蛋白中的免疫球蛋白G(IgG)是一种理想的目标蛋白,而pH 7.0则是得到IgG的理想pH。最后还利用了工业相机及荧光倒置显微镜对牛乳清结晶体进行了拍摄,发现其中主要有长方晶、四角晶、菱方晶三种结晶体形貌。
关键词:牛乳清;结晶;结晶体形貌;免疫球蛋白
乳清蛋白是牛奶中重要的一类蛋白,其中主要包括IgG、乳铁蛋白、乳过氧化物酶、牛血清蛋白(BSA)等[1],研究[2]表明:牛乳清中各类蛋白均具有一定的生物活性和功能,所以分离乳清蛋白成了至关重要。
层析是一种分离乳清蛋白的重要手段[3],但是从工业角度来讲,层析过程主要有两个弊端:第一是设备成本高;第二是操作难度大。因此,找一种方法对工业层析过程做补充是有意义的。而结晶就是一种能补充层析的方法[5]。为此,要利用结晶方法得到乳清蛋白,首当其冲的问题就是选择合适的结晶条件。
结晶过程的条件一般包括结晶剂、pH、温度、搅拌速度等[6]。其中,结晶剂可为盐[7-8]或有机试剂[9]。对于蛋白质体系,NaCl是一种最常见的结晶添加物[10],而且层析的洗脱过程中往往也要引入NaCl,它是一种常见的洗脱剂。那么,为了能与层析过程做对接,且不引入其他物质致使体系更为复杂,本工作将NaCl作为牛乳清结晶剂。同时pH也是重要的条件之一,pH对乳清蛋白浓缩物(WPCs)的影响前人做过一些研究,如Lucena[12]和Bramaud[13]都利用了等电点沉淀法得到了WPCs中的α-乳白蛋白,沉淀中还含有少量的BSA以及免疫球蛋白(Igs)。显然,在探索pH的影响时关注乳清蛋白的等电点对于本工作是非常必要且十分重要的。
目前为止,研究pH和盐浓度对天然牛乳清体系结晶行为的影响还鲜有前人的文献记载。本工作就将针对牛乳清体系,围绕这两个变量展开研究与讨论。最后还拍摄了牛乳清中的结晶体晶型。
1 实验部分
1.1主要试剂
实验所用的牛奶来自萧山牧场。BSA向德国Sigma-Aldrich公司购买。盐酸,杭州双林化工试剂厂,分析纯。氢氧化钠,杭州萧山化学试剂厂,分析纯。氯化钠,上海申博化工有限公司,分析纯。
1.2主要仪器
低温恒温槽(SC-15),宁波天恒仪器厂;紫外分光光度计(Ultrospec 3300 pro),Amersham Bioscience;SDS-PAGE电泳槽(Mini Protean 3 Cell),Bio-Rad。分析天平(BS 224 S),赛多利斯仪器系统有限公司;大恒工业相机(DH-HV3103UC-T),北京大恒图像视觉有限公司;荧光显微镜(CFM-500E),上海长方光学仪器有有限公司。实验装置如图1。

图1 牛乳清结晶实验装置示意图Figure.1 Crystallization experiment setup of bovine whey
1.3实验过程
1.3.1牛奶处理
将鲜牛奶在5000 r/min下离心30 min脱去脂肪,然后将其调至酪蛋白的等电点(pI)为4.6,在35℃的水浴恒温加热磁力搅拌器中温浴搅拌50 min,使酪蛋白沉淀完全,将脱脂乳同样在5000 r/min下离心30 min除去酪蛋白沉淀。最后乳清的pH调至5.8,并利用0.45 μm的微滤膜过滤。
1.3.2牛乳清结晶与分析
配成一定pH(4.7,5.8,7.0,8.0),NaCl浓度(0.5 mol/L,1.0 mol/L,1.5 mol/L,2.0 mol/L)的25 mL牛乳清。取15 mL该牛乳清放入100 mL的烧杯中,并将其置于低温恒温槽中降温结晶。该降温过程分为三个阶段,恒温,降温,平衡。降温速度分为两种,先以0.1℃/min降温,等接近成核点时利用0.01℃/min降温,直至析出晶体。最后利用1 mL的移液枪取上清液至1.5 mL离心管中保存。接着利用BSA标准曲线得到各上清液蛋白质的量。最后取稀释后的上清液80 μL至20 μL的上样缓冲液(Loading buffer)中,利用100℃的水浴煮沸,接着做电泳,最后染色,脱色,拍照。
1.3.3牛乳清晶体拍摄
首先,将工业相机安装于荧光显微镜上,接着调试显微镜焦距,最后对牛乳清溶液结晶体进行拍摄。
2 结果与讨论
2.1NaCl浓度和pH对成核温度的影响
图2是在不同pH下,成核温度随NaCl浓度改变的曲线。由图可知,成核温度会随着盐浓度的增加而增加,也就是说盐浓度越高,牛乳清就越容易析出蛋白质。这种现象可以用Curtis等人[11]的蛋白质-盐相互作用理论来解释。并且它与Alderton[7]对鸡蛋清溶菌酶和Visuri[8]对淀粉酶的工作中出现的现象相类似。
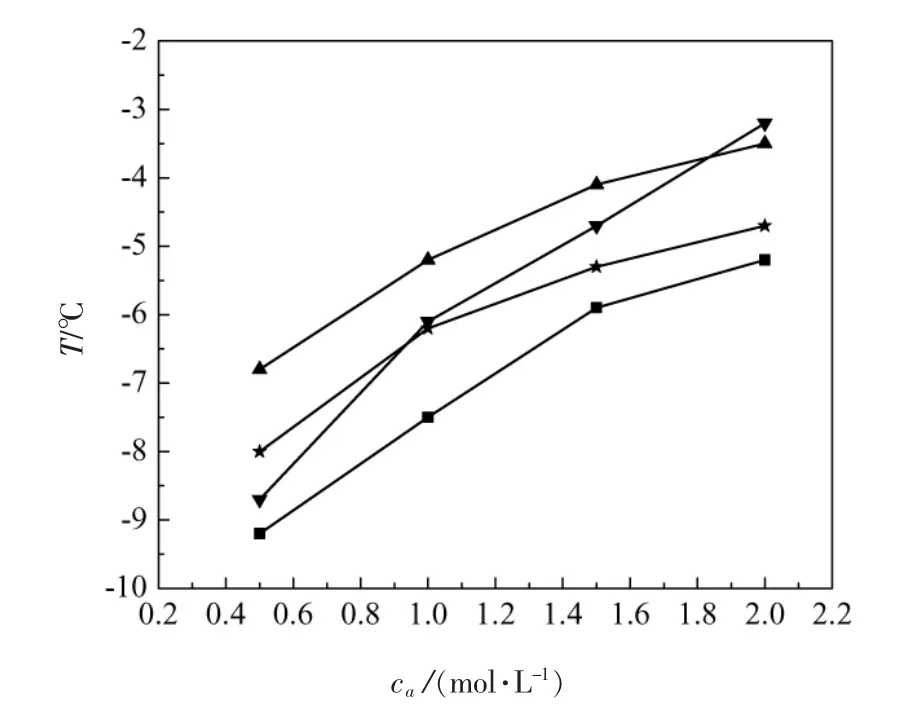
图2 不同pH下成核温度随盐浓度的变化Figure.2 Temperature of nucleation versus NaCl concentration under different pH
图3是不同NaCl浓度下,成核温度随pH改变曲线。由图可知,在盐浓度为0.5~1.5 mol/L,pH 7.0时最容易成核。但是在盐浓度为2.0 mol/L时,成核温度会随着pH的增大而增大,并在pH 7.0之后趋于平缓。这也许是因为牛乳清中蛋白的主要成分是IgG,而IgG的等电点是7.0[4]。所以在pH 7.0时析出的蛋白最多是比较合理的。而在高盐浓度下,这种现象会被弱化。所以在2.0 mol/L盐浓度下会出现这样的趋势。

图3 不同盐浓度下成核温度随pH的变化Figure.3 Temperature of nucleation versus pH at different NaCl concentration
2.2NaCl浓度和pH对蛋白质结晶量及收率的影响
图4(a)和图4(b)分别表示的是牛乳清中析出的蛋白质的量随盐浓度的变化以及牛乳清中析出蛋白质的回收率随盐浓度的变化。由于每次牛乳清结晶实验都是取15 mL牛乳清,所以上述蛋白质的析出量以及产率都是以15 mL牛乳清为基准的。从图4(a)中可以看出乳清蛋白的析出量会随着盐浓度的升高而升高。而在图4(b)中也有与图4(a)相同的趋势,从图4(b)图不难发现蛋白的最大析出量小于55 %,这主要有两方面原因,一方面是因为平衡时间较短(0.5 h)。另一个原因是蛋白与水之间的作用力在一定阶段后要大于蛋白与蛋白之间的作用力以及蛋白与盐之间的作用力[24],这样就会影响蛋白之间的成团。

图4 (a)

图4 (b)Figure.4
图5(a)和图5(b)分别表示牛乳清中析出的蛋白质的量随pH的变化以及牛乳清中析出蛋白质的回收率随pH的变化(以15 mL牛乳清为基准)。从图5(a)中可以看出pH 4.7和7.0时要比另外两个pH时的析出量大,这是因为BSA和IgG是牛乳清中含量最高的两种蛋白,而两种蛋白的等电点分别是4.7以及7.0。

图5 (a)

图5 (b)Figure. 5
2.3NaCl浓度和pH对牛乳清中各蛋白含量的影响
图6(a)和图6(b)表示不同NaCl浓度和pH下牛乳清析出蛋白后上清液的SDS-PAGE电泳图。从图6(b)显然可见,在pH 7.0时随着盐浓度的增加,IgG的量在明显减小。这种现象的出现是因为IgG的等电点在7.0左右,这时它最易沉聚析出。但如图6(a),在pH 4.7时BSA并没有出现类似于IgG的现象。
2.4牛乳清结晶体形貌
牛乳清是复杂的蛋白质体系,为了能够更好地利用结晶方法从牛乳清中得到蛋白质,对牛乳清中结晶体晶型的观察是必不可少的。

图6 (a)
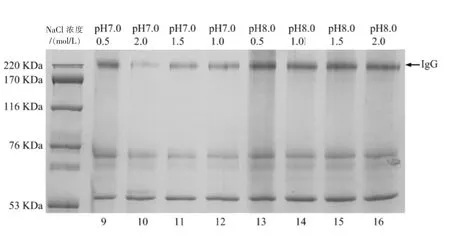
图6 (b)Figure.6

图7 Figure. 7
如图7(a)和图7(b)中出现的是长方晶,而图7(c)中则是四角晶。这两种晶型在蛋白质结晶中是比较常见的。如鸡蛋清溶菌酶在溶液结晶中会出现两种典型的晶型[4],一种是四角晶,另一种是长方晶。而图(d)出现的是菱方晶。之所以会出现不同的结晶体形貌是因为蛋白质是大分子物质,其空间构象十分复杂且易变。而在牛乳清体系中,不同作用力包括蛋白质-蛋白质作用力和盐-蛋白质作用力的共同作用下,蛋白质构象将变得更为复杂,这样导致了结晶体晶格堆叠的过程中其长出晶体形貌的不确定性的增加,最后才出现了这几种不同的晶体形貌。
3 结论
本工作以脱除脂肪以及酪蛋白的牛乳清为原料,研究了pH以及NaCl浓度对其结晶的影响。发现IgG是一种理想的牛乳清结晶目标蛋白,而pH 7.0则是得到这种目标蛋白的理想pH。
最后还观察到牛乳清中能得到四角晶、长方晶、菱方晶等三种结晶体形貌。
参考文献:
[1] Prazeres A R,Carvalho F,Rivas J. Cheese whey management: a review[J]. J. Environ. Manage,2012,110: 48-68.
[2] Farrell H J,Jimenez F R,Bleck G T,et al. Nomenclature of the proteins of cows' milk -sixth revision[J]. J. Dairy. Sci,2004,87(6):1641-1674.
[3] Gerberding S J,Byers C H. Preparative ion -exchange chromatography of proteins from dairy whey[J]. J. Chromatogr. A,1998,808(1-2):141-151.
[4] Hahn R,Schulz P M,Schaupp C,et al. Bovine whey fractionation based on cation-exchange chromatography[J]. J. Chromatogr. A,1998,795:277-287.
[5] Giffard M,Ferte N,Ragot F,et al. Urate oxidase purification by salting-in crystallization: towards an alternative to chromatography[J]. Plos One,2011,6(5):e19013.
[6]叶铁林.化工结晶过程原理及应用[M].北京:北京工业大学出版社,2006.
[7] Alderton G,Fevold H. Direct crystallization of lysozyme from egg white and some crystalline salts of lysozyme[J]. J. Biol. Chem,1946,146:1-5.
[8] Visuri K,Nummi M. Purification and characterisation of crystalline amylase from barley[J]. Eur. J. Biochem,1972,28:555-565.
[9] Weber M,Jones M,Ulrich J. Crystallization as a purification method for jack bean urease: on the suitability of poly(ethylene glycol),Li2SO4,and NaCl as precipitants [J]. Cryst. Growth. Des,2008,8:711-716.
[10] Howard S,Pamela J,Wigg T,et al. The solubility of hen egg-white lysozyme[J]. J. Crys. Growth,1988,90:94-104.
[11] Curtis R. A,Lue L. A molecular approach to bioseparations: protein -protein and protein -salt interactions [J]. Chem. Eng. Sci,2006,61(3):907-923.
[12] Eugenia L. M,Alvarez S,Menendez C,et al.α-Lactalbumin precipitation from commercial whey protein concentrates[J]. Sep. Purif. Technol,2007,3(52): 446-453.
[13] Bramaud C,Aimar P,Daufin G. Whey protein fractionation: isoelectric precipitation of α-lactalbumin under gentle heat treatment[J]. Biotechnol. Bioeng,1997,4(56):392-397.
Exploration of Bovine Whey Crystallization Conditions and Morphology of Proteins Crystals
YU Yue-qian
(College of chemical engineering, Zhejiang University of Technology, Hangzhou,Zhejiang 310014, China)
Abstract:With UV spectrophotometry and electrophoresis, degreased bovine whey after removal of casein was studied in conditions of pH 4.7~8.0 and 0.5~2.0 mol/L NaCl. The results showed that immunoglobulin(IgG) was a kind of ideal target protein in bovine whey. Meanwhile, pH 7.0 was the ideal pH to obtain IgG. Finally, the crystallization behavior of whey was surveyed by an inverted fluorescence microscope and a high resolution digital camera. Furthermore, three kinds of morphology including orthorhombic, tetragonal and rhombus crystals were observed.
Keywords:bovine whey; crystallization; morphology of crystals; immunoglobulin
作者简介:俞越钱(1990—),男,浙江绍兴人,硕士研究生,主要研究方向为分离工程。E-mail:yyqsxf@163.com。
收稿日期:2015-05-22
文章编号:1006-4184(2016)1-0026-05
