壳聚糖修饰托氟啶纳米脂质体的体外释放试验研究
2016-03-27马宝花周学锋
杨 海,马宝花,周学锋
(山东省青岛市中心医院,山东 青岛 266042)
壳聚糖修饰托氟啶纳米脂质体的体外释放试验研究
杨 海,马宝花,周学锋
(山东省青岛市中心医院,山东 青岛 266042)
目的 对壳聚糖修饰的托氟啶纳米脂质体的体外释放行为进行研究。方法 以托氟啶溶液为对照,采用动态膜透析法考察壳聚糖修饰托氟啶纳米脂质体(TFu-SLNs)在磷酸盐缓冲液(pH=7.4)、人工胃液(pH=1.2)、肠液(pH=6.8)以及人工胃液转肠液中的体外释药情况并测定其方法回收率。结果 托氟啶溶液在磷酸缓冲液、人工胃液、人工肠液释放均符合一级速率方程,方程分别为A=37 602 C+160.48(r=0.999 9)、A=39 488 C+1 915.3(r=0.999 8)、A=38 790 C-194.11(r=0.999 3)。在人工胃液中壳聚糖修饰TFu-SLNs符合Ritger-Peppas方程,ln Q=0.398 4 ln t+3.135 2(r=0.979 6);在人工肠液及人工胃液转肠液中中壳聚糖修饰TFu-SLNs均符合 Weibull方程,方程分别为 ln Q=0.385 2 ln t-1.325 86(r=0.964 5)、ln Q=0.412 6 ln t-1.270 2(r=0.974 6)。结论 壳聚糖修饰的TFu-SLNs可缓慢释放药物,且其释放药物的机制以药物扩散为主。
托氟啶;壳聚糖;体外释放度
托氟啶是阿托氟啶体内的主要代谢产物,具有明确抗肿瘤活性,化学结构稳定。托氟啶可以看作是前药,在体内选择性经肿瘤细胞酰胺酶转化为5-氟尿嘧啶,最终通过抑制肿瘤DNA和RNA的生物合成起到抗肿瘤作用[1-2]。但由于该药水中溶解度小,口服难吸收,影响其发挥抗肿瘤作用及临床应用。将该药制成固体纳米脂质体经壳聚糖修饰后可以促进口服吸收,并通过延长在吸收部位的滞留时间而提高生物利用度[3]。笔者主要对壳聚糖修饰的托氟啶纳米脂质体[4](TFu-SLNs)的体外药物释放进行了研究,现报道如下。
1 材料与方法
1.1 材料与仪器
托氟啶(山东大学药学院提供);壳聚糖(DAC95%,湖北盈荷医药有限公司);大豆卵磷脂 (沈阳天峰生物制药有限公司);无水乙醚 (深圳华丽源化工有限公司);硬脂酸聚烃氧(40)酯(美国Sigma公司);甲醇和乙腈(色谱纯,德国Merck公司);氯仿、氢氧化钠、磷酸二氢钾等试剂均为分析纯。PHS-3C型精密pH计(上海雷磁仪器厂);LABOROTA4000-efficient型旋转蒸发仪(德国Heidoph公司);NS1001L型高压匀质机(意大利Niro-Soaro公司);高效液相色谱仪(Waters公司);ZETASIZER3000型粒度分布与电势分析仪(英国Malvern公司);BP121S型电子天平(Sartorius公司);JY-92-Ⅱ型超声波细胞粉碎机(宁波新芝科器研究所);TU1810型紫外-可见分光光度计(中国普析通用仪器有限公司)。
1.2 方法
1.2.1 色谱条件
色谱柱:安捷伦C18柱;流动相:甲醇-水(60∶40);柱温:25℃;流速:0.5 mL/min;进样量:10 μL。
1.2.2 不同释放介质中标准曲线绘制
取适量托氟啶标准液(质量浓度为10.0 g/L)分别加入磷酸缓冲液(pH=7.4)、人工胃液(pH=1.2)、人工肠液(pH=6.8)后,配制成终质量浓度均为0.1 g/L的3种贮备液,加适量注射用水分别稀释至浓度为1.0,2.0,4.0,6.0,8.0,10.0 μg/mL的3种系列溶液,用前过0.22 μm微孔滤膜。采用高效液相色谱(HPLC)法,以峰面积对溶液质量浓度进行线性回归,得不同释放介质的标准曲线。
1.2.3 不同释放介质中托氟啶的回收率
在磷酸缓冲液、人工胃液、人工肠液中分别加入一定量托氟啶溶液后,用注射用水进一步稀释成质量浓度分别为1.0,6.0,10.0 μg/mL的溶液,用HPLC法测定峰面积(色谱条件同方法1.2.1),计算托氟啶的质量浓度,测算回收率。
1.2.4 体外释放度测定
采用动态膜透析法[5]进行壳聚糖修饰的TFu-SLNs体外释药试验。取一定量壳聚糖修饰TFu-SLNs,用磷酸缓冲液稀释后透析。对照溶液质量浓度为0.1 g/L的托氟啶溶液。透析条件为转速50 r/min、温度30℃、释放介质体积200 mL,分别于5 min,10 min,20 min,40 min,1 h,1.5 h,2 h,2.5 h,4 h,6 h,8 h,12 h,24 h,48 h时从释放介质中取2 mL,同时向释放介质中补充等量磷酸缓冲液。托氟啶进入释放介质的量采用HPLC法进行测定(色谱条件同1.2.1项),计算释药百分比。在进行人工胃液转肠液体外释放度测定中,模拟药物在体内吸收过程,开始2 h人工胃液作为释放介质,后转为人工肠液。
2 结果
2.1 标准曲线绘制
高效液相色谱法测定系列托氟啶溶液在磷酸缓冲液、人工胃液、人工肠液中含量时分别以药物质量浓度(C)为横坐标、峰面积(A)为纵坐标进行线性回归,得托氟啶在磷酸缓冲液、人工胃液、人工肠液中的标准曲线方程分别为 A=37 602 C+160.48(r=0.999 9),A=39 488 C+1 915.3(r=0.999 8),A=38 790 C-194.11(r=0.999 3)。结果显示,在3种不同释放介质中托氟啶质量浓度在1~10 μg/mL范围内与峰面积线性关系良好。
2.2 托氟啶回收率
按照1.2.2项下试验方法测定,计算药物回收率,结果见表1至表3。可见,托氟啶在磷酸缓冲液、人工胃液、人工肠液中测定方法回收率均符合要求。
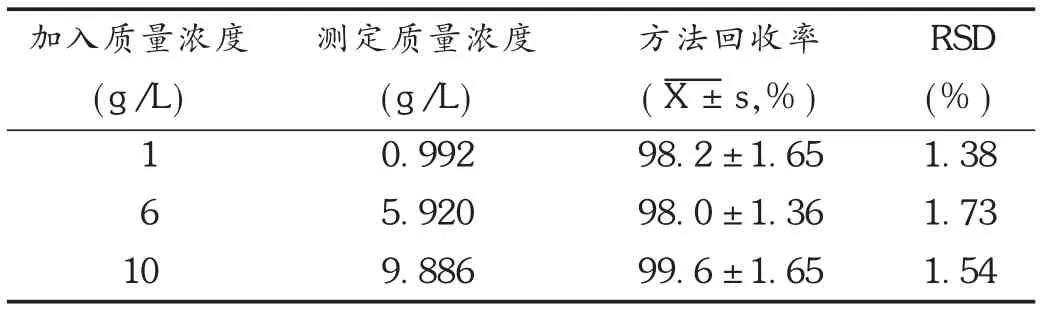
表1 托氟啶在磷酸缓冲液(pH=7.4)中的回收率测定结果
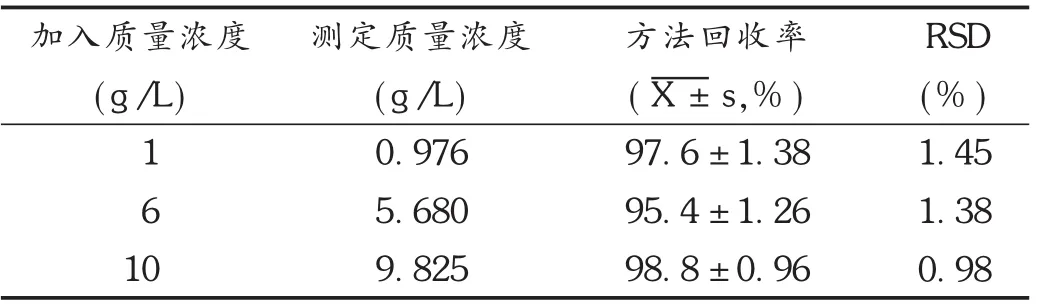
表2 托氟啶在人工胃液(pH=1.2)中的回收率测定结果
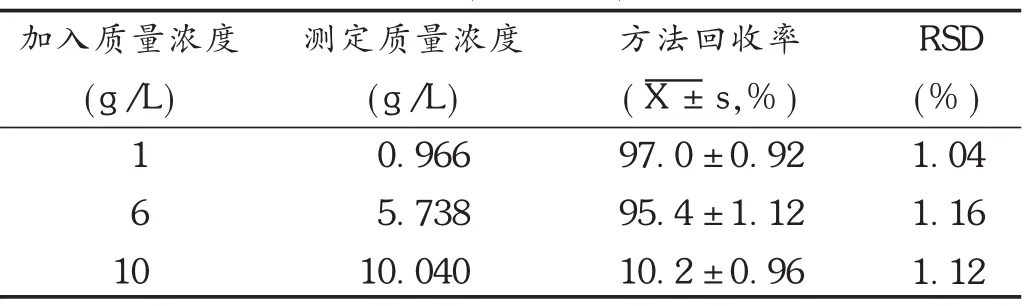
表3 托氟啶在人工肠液(pH=6.8)中的回收率测定结果
2.3 体外释放度
托氟啶和壳聚糖修饰托氟啶纳米脂质体在不同释放介质中的累积释药百分率见图1至图3。

图1 人工胃液中累积释药百分率

图2 人工肠液中累积释药百分率

图3 人工胃液转肠液中累积释药百分率
2.4 释药数学模型构建
将托氟啶溶液和壳聚糖修饰托氟啶固体纳米脂质体在不同释放介质中药物释放情况进行数学模型构建,结果如下:
在人工胃液中,托氟啶溶液释药模型符合一级速率方程 ln(100-Q)=-0.673 8t+4.123 8(r=0.993 5);壳聚糖修饰托氟啶固体纳米脂质体释药模型符合Ritger-Peppas方程 ln Q=0.398 4 ln t+3.135 2(r=0.979 6)。结果可见,壳聚糖修饰托氟啶纳米脂质体可以缓慢释放药物。
在人工肠液中,托氟啶溶液释药模型符合一级速率方程 ln(100-Q)=-0.642 8t+4.189 6(r=0.983 6);壳聚糖修饰托氟啶固体纳米脂质体释药模型符合Weibull方程lnQ=0.385 2 lnt-1.325 86(r=0.964 5)。结果可见,壳聚糖修饰托氟啶纳米脂质体可以缓慢释放药物。
在人工胃液转肠液中,托氟啶溶液释药模型符合一级速率方程 ln(100-Q)=-0.964 2 t+4.325 8(r=0.988 6);壳聚糖修饰托氟啶固体纳米脂质体释药模型符合 Weibull方程 ln Q=0.412 6 ln t-1.270 2(r= 0.974 6)。结果可见,壳聚糖修饰托氟啶纳米脂质体可以缓慢释放药物。
3 讨论
体外研究结果表明,将水溶性较差的托氟啶制成纳米脂质体,可以有效延长药物释放时间,同时能长时间维持较高浓度,达到缓释作用。本研究中发现,在不同的释放介质中壳聚糖修饰托氟啶固体纳米脂质体与托氟啶溶液相比具有明显的缓释作用,但在不同的释放介质中缓释效果不同。在人工胃液环境中,由于胃酸的作用药物释放较快。但是考虑到人体生理条件下药物在胃中滞留时间较短,本试验中采用人工胃液转肠液方法模拟了药物口服进入体内吸收过程。
将托氟啶及其经修饰的固体纳米脂质体的释放情况构建数学模型,结果发现,托氟啶溶液在3种不同释放介质中均按照一级速率释放。壳聚糖修饰托氟啶固体纳米脂质体在仍人工胃液中释放符合Ritger-Peppas方程[6],在人工肠液和人工胃液转肠液中释放符合Weibull方程[7],均体现了缓释功能。将药物做成脂质体后其释放过程有很多方式,如纳米粒表面溶蚀降解、整体崩解、骨架扩散、解离扩散、水合膨胀及解吸附等。从壳聚糖修饰的托氟啶纳米脂质体在体外的扩散系数可知,其释药机制以药物扩散为主。
[1]Li Q,Feng FY,Han J,et al.PhaseⅢ clinical study of a new anticancer drug atofluding[J].Chin J Cancer,2002,21(12): 1 350-1 353.
[2]Sun WT,Zhang N,Li AG,et al.Studies on N_3-O-toluyl-Flulorouracil(TFu)Liposomes[J].Chinese PharmaceuticalJournal,2007,42(6):445-449.
[3]潘 研,李英剑,郑俊民,等.壳聚糖包衣对胰岛素聚酯纳米粒胃肠道吸收的促进作用[J].药学学报,2003,38(6):467-470.
[4]马宝花,杨 海,刘雪丽,等.壳聚糖修饰的托氟啶固体脂质纳米粒的制备[J].中国药师,2015,18(12):2 050-2 053.
[5]Priano L,Esposti D,Esposti R,et al.Solid lipid nanoparticles incorporating melatonin as new model for sustained oral and transdermal delivery systems[J].J Nanosci Nanotechnol,2007,7(10):3 596-3 601.
[6]叶玉杰,任德全,刘 嵩,等.Origin软件拟合溶蚀型载体药物传输系统的 Ritger-Peppas方程研究[J].亚太传统医药,2014,10(4):62-63.
[7]郭剑伟,吴俊珠,王成军,等 .三种方法求解药物溶出度Weibull分布参数的探讨[J].大理学院学报:综合版,2011,10(8):1-4.
In Vitro Drug Release Test of Chitosan M odified TFu-SLNs
Yang Hai,Ma Baohua,Zhou Xuefeng
(Qingdao Central Hospital,Qingdao,Shandong,China 266042)
Objective To study the in vitro drug release of chitosan modified N3-O-toluyl-flulorouracil(TFu)Solid Lipid Nanoparticles(SLNs).M ethods The released kinetics of chitosan modified TFu-SLNs in vitro of different media,such as the phosphate buffer solution(pH=7.4),artificial gastric juice(pH=1.2),artificial intestinal juice(pH=6.8),and artificial gastric juice followed by aritifical intestinal juice,were studied by dynamic dialysis system using TFu solution as control.The recovery rate of the method was determinated in different media.Results In case of solution,all the release profiles of TFu could be described by first order kinetics model and could be expressed by the following equations:A=37 602 C+160.48(r=0.999 9),A=39 488 C+1 915.3(r=0.999 8), A=38 790 C-194.11(r=0.999 3),respectively.In artificial gastric juice,the in vitro release behavior of chitosan modified TFu-SLNs could be expressed by the Ritger-Peppas equations:lnQ=0.398 4 ln t+3.135 2(r=0.979 6).In artificial intestinal juice and artificial gastric juice followed by aritifical intestinal juice,the TFu release behavior of chitosan modified TFu-SLNs in vitro were both in accord with Weibull model:ln Q=0.385 2 ln t-1.325 86(r=0.964 5)ln Q=0.412 6 ln t-1.270 2(r=0.974 6).Conclusion Chitosan Modified TFu-SLNs can release the drug slowly,and the drug release mechanism is dominated by drug diffusion.
N3-O-toluyl-flulorouracil(TFu);chitosan;invitro release
R965;R979.1
A
1006-4931(2016)09-0012-03
杨海,男,博士研究生,主要从事医院药剂科工作,(电子信箱)qdzx08@163.com。
2015-05-07;
2015-09-25)
