ARF5/MONOPTEROS(MP)调控作用研究进展
2016-03-23李青青南文斌张汉马
李青青,南文斌,张汉马
(重庆师范大学 生命科学学院,重庆市植物环境适应分子生物学重庆重点实验室,重庆 401331)
ARF5/MONOPTEROS(MP)调控作用研究进展
李青青,南文斌,张汉马*
(重庆师范大学 生命科学学院,重庆市植物环境适应分子生物学重庆重点实验室,重庆 401331)
摘要:生长素响应因子(auxin response factors,ARFs)是生长素响应机制中的重要元件,其中,ARF5/MONOPTEROS(MP)参与调控许多生长发育过程。该文对近年来国内外有关ARF5/MP的研究进展,以及由ARF5/MP介导的生长素应答通路在拟南芥的胚根原特化、维管组织发育、茎尖发育等过程中的作用以及鉴于ARFs成员之间在结构和功能上的保守性等研究进展进行综述,为阐明植物体对生长素响应的分子机理提供参考。
关键词:ARFs;ARF5/MP;生长素
生长素作为植物激素家族中的重要一员,几乎参与了植物生长与发育调控的方方面面,如胚根形成[1]、茎尖分生组织发育[2]、花器官原基形成[3]等。植物体对生长素的响应主要依赖于对特定基因的表达调控,而这种调控主要通过2个转录因子家族的成员来实现——生长素响应因子(auxin response factors,ARFs)和生长素响应抑制因子(repressors of ARFs,Aux/IAAs)。ARFs可以直接与受控基因启动子区域的生长素应答元件(auxin response elements,AuxREs)结合,从而激活或者抑制基因的表达[4];Aux/IAAs则是与ARFs直接作用,抑制生长素响应过程[5]。
ARF5/MONOPTEROS(MP)是ARFs成员之一,缺失该蛋白功能导致拟南芥胚胎和幼苗发育出现严重缺陷。ARF5/MP功能完全丧失的突变体由于无法形成根尖而导致胚胎死亡,表型较弱的突变体则可能长出较短的下胚轴[6],但子叶的分离状况、叶脉的形态等表型常常出现异常[2,7]。越来越多的研究表明,ARF5/MP在植物生长发育过程中扮演着十分重要的角色。
1ARF5/MP蛋白及其活性调控
1.1ARF5/MP蛋白和mp突变体
ARF5/MONOPTEROS(MP)在拟南芥所有的主要器官中都有表达[8],其编码的蛋白ARF5/MP由902个氨基酸组成,包含4个结构域(图1)[9]:DNA结合域(DNA-binding domain,DBD)、中间域(middle region,MR)和2个二聚体结构域Ⅲ和Ⅳ。DBD是一种植物特有的B3-型结构,它能够识别靶基因启动子区域中的TGTCTC碱基序列[4,10]。高分辨晶体结构分析显示DBD由3个独特的结构域构成:一个是B3域,它可以折叠成一个七线的开放式β桶;从DBD的N端到C端,以及B3域,共同构成了第2个区域,称为二聚体形成域(dimerization domain,DD),它的功能主要是决定与DNA结合的亲和性;DBD C-端80个氨基酸组成了第3个结构域——辅助域(ancillary domain,AD),辅助域和二聚体形成域的功能紧密相关[9]。中间域富含谷氨酰胺、丝氨酸和亮氨酸残基,主要作为ARF5/MP活化域[4,11]。二聚化结构域Ⅲ和Ⅳ也称为C末端域(carboxyl-terminal domain,CTD),在Aux/IAAs中也包含有,它们的功能主要是抑制由中间域介导的活化作用[11-12]。
从拟南芥野生型植株Columbia背景中,鉴定出了几种mp突变体[13]。其中表型最弱的是mp-11,它的T-DNA插入位点在起始密码子上游第678个碱基后,这个插入导致ARF5/MP转录本含量降低了约30%[13]。mpG12突变体是由于染色体缺失造成,它缺少整个编码DBD的部分,但保留有编码部分MR和整个CTD部分[13]。mp-12在ARF5/MP的第2个内含子区域有一个T-DNA插入,它的子叶和子叶叶脉在表型上与alf5-1相似,而alf5-1的T-DNA插入位点在编码部分DBD的第8个外显子区域[13]。表型最强的突变体是mp-13,它的T-DNA插入位点在ARF5/MP的第10个、编码中间域起始部分的外显子区域[13]。另外,还有3个突变发生在CTD的突变体:mp-14,它的T-DNA插入位点在编码CTD的起始部分[13];2个获得功能性突变,分别是缺少结构域Ⅳ的mpabn和缺少Ⅲ和Ⅳ的mpΔ[12,14]。这些mp等位基因突变体为研究ARF5/MP功能和作用机制提供了宝贵的资源。

DNA结合域(DBD)由三部分组成:二聚体形成域(DD)、B3域和
1.2ARF5/MP活性调节与靶基因
ARF5/MP活性主要受Aux/IAAs家族中的IAA12/BODENLOS(BDL)和IAA3/SHORT HYPOCOTYL(SHY2)调节,TOPLESS(TPL)、POPCORN(PCN)等与拟南芥胚胎发育和分生组织形成相关的蛋白也能够调节ARF5/MP活性。IAA12/BDL是第一个被发现与拟南芥胚胎发育相关的Aux/IAAs成员,在根尖组织形成过程中,IAA12/BDL可以抑制ARF5/MP活性[15];另一方面,ARF5/MP能够通过结合到自身以及IAA12/BDL启动子区域中的AuxREs调节其表达,在这种调节方式中,生长素具有阈值特化驱动的作用,通过促进IAA12/BDL降解来促进ARF5/MP反馈调节作用[16]。IAA3/SHY2主要参与根尖生长、侧根形成等过程[17]。IAA3/SHY2与IAA12/BDL是功能性同源基因,IAA3/SHY2也能够直接抑制ARF5/MP活性,并且在胚胎发生过程中,IAA12/BDL或IAA3/SHY2能与ARF5/MP形成最佳配对从而发挥作用[18]。TPL与PCN都对根尖和茎尖形成具有重要作用[19-21],它们是IAA12/BDL的共抑制子,通过与IAA12/BDL形成复合体抑制ARF5/MP活性[20-21]。
在受ARF5/MP直接调控的基因中,TARGETOFMP5(TMO5)调控维管组织的发生[22],TMO7则在根尖形成过程中发挥作用[23];DORERÖSCHEN主要在胚胎时期的子叶顶端表达[24],Dof5.8和ATHB8对叶脉形成有重要作用[25-28];LEAFY(LEY)、AINTEGUMENTA-LIKE/PLETHORA(ANT)和AIL6可以调控花原基的起始[3],CUP-SHAPEDCOTYLEDON1(CUC1)/CUC2影响雌蕊的发育[29]。在上述的例子中,ARF5/MP作为激活因子,能够促进这些基因的表达,而ARF5/MP也能够作为负调控因子,在气孔发育和茎尖干细胞维持中,分别抑制STOMAGEN和ARABIDOPSISRESPONSEREGULATOR7(ARR7)/ARR15的表达[30-31]。这些基因在启动子中都含有AuxREs,而研究发现ARF5/MP与基因之间的特异性结合与AuxREs之间的空间距离有关[9],这将有助于寻找特定的ARF下游基因。
如前面所述,ARF5/MP能够直接调节ARF5/MP和IAA12/BDL表达[16]。新的研究发现,在Aux/IAA基因家族中,有近半数基因的表达受ARF5/MP直接调控,这些基因的产物又对ARF5/MP产生负反馈作用[32]。这些目标基因被分为几种不同亚类[32],可能是由于不同发育时期各基因的时空表达差异造成。
2ARF5/MP参与调控的拟南芥主要生长发育过程
2.1根系发育
在mp缺失突变体的胚胎发育过程中,原胚细胞分裂异常,不能形成下胚轴和根[6],而拟南芥的根尖系统源于一个胚柄细胞特化成的胚根原[15]。近年来有关根系发育的研究表明,胚根原前体的特化与ARF5/MP的功能紧密相关,包括细胞自主性和非细胞自主性的调控过程(图2,A);同时,ARF5/MP也能调节侧根的发育。
在拟南芥早期的胚胎发育中,ARF5/MP和IAA12/BDL的表达区域在原胚细胞中,而不是最终会特化成胚根原的胚柄细胞,这表明胚根原特化的过程有非自主性的细胞调控机制存在[15]。当发生生长素应答时,IAA12/BDL等抑制因子迅速降解并释放ARF5/MP,ARF5/MP激活目标基因TMO5和TMO7的表达。TMO5起细胞自主性的调控作用,而TMO7则从原胚细胞转移到最上面的胚柄细胞中,这个胚柄细胞最终会特化为胚根原[23]。同时,PHD-指蛋白OBERON(OBE)和TITANIA(TTA)形成复合体(可能还包括其它染色质重塑因子),通过影响TMO7位点的染色质特性,调节依赖于ARF5/MP的TMO7的表达[33]。另一方面,ARF5/MP-IAA12/BDL信号可以正调控PIN-FORMED1(PIN1)的表达以及生长素从原胚细胞向胚根原的转运[34]。而在胚柄细胞中,IAA10和ARF9等其他与生长素响应相关的蛋白,也参与调节胚根原特化[1]。
除了早期的胚根发育,ARF5/MP还参与侧根的形成[35]。侧根的形成涉及许多生长素响应通路[35]。时延相关算法(time-delay correlation algorithm,TDCor)表明,有关侧根发育的基因调控网络主要包含2个调控模型。其中一个是MP/BDL-ARF6-ARF8[36],它与另一个模型SLR/IAA14-ARF7-ARF19[37],共同调控侧根原基的侧翼和中心区域的特化。ARF5/MP、ARF6和ARF8主要在生长素浓度较高的原基中心区域表达,而ARF7的目标基因,例如LDB16和PLT5等,则只在生长素浓度较低的侧翼区域和基底细胞中表达[36]。这些调控模型表明,由生长素浓度提供的位置信号能够调节特定区域内的基因表达。
2.2维管组织发育
维管组织是植物体运输水分和营养物质的重要通道,因此维管组织的正常发育对植物体至关重要。在拟南芥的mp突变体植株中,维管组织表现出独特的缺陷型,包括维管组织总量的减少和维管束的不连续[38];在杨树中,ARF5/MP对次生木质部的发育起关键作用[39]。这些表明ARF5/MP在维管组织的发育过程中有重要作用。
根尖维管组织源于球形期早期的4个前维管细胞,这4个细胞经过几轮平周分裂后,形成维管组织的各个部分[40]。维管组织的发育进程同时包含有维管的模式建成和生长,而这2个过程由ARF5/MP介导的生长素响应和细胞分裂素(cytokinin,CK)信号协同调节(图2,B)[40]。与胚根原特化过程相似,TMO7也移动到维管组织细胞中[23],而obe突变体在心形期也表现出不正常的维管结构模式[33,41]。但是与胚根原特化不同的是,蛋白TMO5与LONESOMEHIGWAY(LHW)编码的蛋白形成一个碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)转录因子二聚体,该二聚体触发维管组织细胞的平周分裂[22]。LHW主要作用于维管起始细胞形成过程的第一步,可能是通过影响PIN1的表达[42]。进一步的研究表明,TMO5/LHW能够直接调控LONELYGUY4(LOG4)的表达并控制CK的合成,而LOG4编码的蛋白酶参与CK合成过程[43]。由此,这些研究结果描绘了一个有生长素和CK共同参与调控的维管组织发育过程。
在叶片中,维管组织形成叶脉。pin和mp的突变体都形成不正常的叶脉[7],表明叶脉的模式建成受生长素严格控制。ARF5/MP和PIN1的表达呈现一种动态过程——从广范围的低水平表达到特定的前原形成层中的高水平表达[7]。分子证据表明ARF5/MP和PIN1可能通过一个反馈调节系统调节叶脉的模式建成[7]。另外,ARF5/MP还通过直接调节ATHB8、Dof5.8等基因的表达影响叶脉的形成[25-28]。
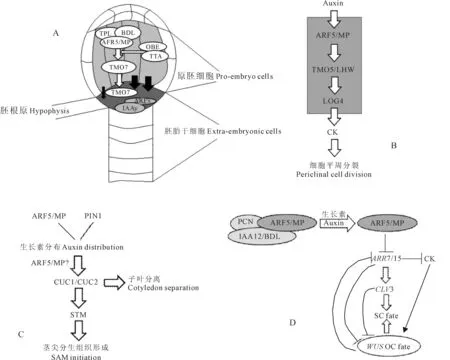
A.胚根原特化:白色椭圆形和白色箭头表示由ARF5/MP介导的生长素信号,通过移动蛋白TMO7从原胚细胞向胚根原细胞传递,
2.3子叶的分离和茎尖分生组织的形成
在双子叶植物的胚胎发育过程中,茎尖由辐射对称状变为两侧对称状,最终两片子叶对称地分布在茎尖分生组织(shoot apical meristem,SAM)的周围[44]。在这个模式建成过程中,PIN1、ARF5/MP、SHOOTMERISTEMLESS(STM)、CUC1和CUC2等基因共同调节子叶分离和SAM形成:PIN1和ARF5/MP通过影响生长素的分布而调节CUC1和CUC2的表达,CUC1和CUC2促进子叶的分离和STM的表达,STM促进SAM的形成(图2,C)[2,44]。
ARF5/MP作为生长素信号的整合因子,参与到SAM的形成和维持所涉及到的复杂的调控网络中,并使生长素信号和CK信号在这个调控网络中有机地结合到一起(图2,D)[31]。PCN蛋白可能与IAA12/BDL共同抑制ARF5/MP的活性[20],而ARF5/MP对编码生长素信号负调控因子的A-型基因ARR7和ARR15的表达有负调控作用[31]。最近的研究发现,mpΔ在组织培养中表现出极强的茎尖再生能力,一些通常情况下不具备再生能力的部位也表现出一定的再生能力[45-46],进一步表明ARF5/MP在SAM形成中扮演重要角色。
2.4其它发育过程
ARF5/MP还参与到其它发育过程中,如花原基的形成[3]。ARF5/MP可以直接调节LFY和ANT/AIL6的表达,它们分别与花器官命运决定和花的生长有关[3]。另外,ARF5/MP还能通过直接调节ANT、CUC1和CUC2的表达而影响胚珠原基的形成[29]。在叶肉细胞中,STOMAGEN编码的分泌蛋白从叶肉细胞转移到表皮,促进气孔发育[47],ARF5/MP通过抑制STOMAGEN的表达参与到气孔发育过程中[30]。
由ARF5/MP介导的生长素信号通常与生长素流式紧密相关,这个过程主要受PIN1调控,而ARF5/MP在叶片的形成过程中能够促进PIN1的表达和生长素转运[48]。叶原基形成之后,ARF5/MP在叶近轴面的活性作用[49]和PIN1介导的从叶原基向分生组织中心的生长素流向,共同形成一个低生长素浓度的区域,由此形成叶片的极性[48]。
3结语
有关ARF5/MP蛋白结构的分析为我们揭示生长素应答机制提供了有力证据。所有ARFs都具有保守DBD,ARFs与DNA结合特异性取决于结合位点之间的空间距离[9]。ARF5/MP等中间域富含谷氨酰胺等氨基酸残基的ARFs通常被认为是促进基因表达的因子[4],但新的研究发现ARF5/MP同样具有抑制作用[30-31]。CTD与Aux/IAAs中的结构域Ⅲ和Ⅳ具有同源性,完全或部分缺失CTD的ARF5/MP蛋白不受IAA12/BDL抑制,许多受ARF5/MP影响的表型增强[12]。在拟南芥中本来就存在缺少CTD的ARFs,如ARF3、ARF13等[4],它们是如何对生长素做出应答的、在进化中是否更具优越性?我们可以利用不同的mp突变体对其蛋白结构和作用机制做更深入的研究。
在植物的生活史中,众多因子共同调节着植物的生长发育,大量研究也致力于阐明各种因子之间的协同调节机制。在根尖、维管组织和茎尖等发育过程中,由ARF5/MP介导的生长素信号与肽类信号、CK信号之间形成分子调控网络:在根尖发育中,ARF5/MP通过移动肽类物质调控胚根原特化[23];在维管组织和茎尖分生组织形成过程中则与CK信号共同调控细胞命运[31,40]。在侧根、叶片、花器官等的发育过程中,ARF5/MP和PIN1共同作用,引起局部的生长素分布浓度差由此引发不同的应答反应,为侧根、花和叶原基以及叶片极性形成提供信号。无论是胚胎发生时期,还是胚后的器官发育,ARF5/MP功能都与干细胞命运紧密相关。但目前有关ARF5/MP功能研究多基于拟南芥,ARF5/MP在其它植物中是否有类似的功能仍有待研究。已经有研究者从龙眼中获得DlARF5a基因并发现其与体细胞胚胎发生过程中的鱼雷形胚时期的形态建成有关[50],鉴于ARF5/MP在发育中的重要作用,有必要在水稻、小麦、油菜等重要作物中做进一步研究。拟南芥的mp获得功能性突变体在植物组织培养中表现出较强的茎尖再生能力[45-46],但是具体的作用机制并不十分清楚,因此仍需要深入研究ARF5/MP在植物组织培养中的分子机理,这不仅将为我们研究植物再生开启新的领域,也对植物组织培养技术,尤其是粮食作物类植物,具有重要意义。
参考文献:
[1]EIKE H R,ANNEMARIE S L,ALEXANDRA S,etal.Different auxin response machineries control distinct cell fates in the early plant embryo[J].DevelopmentalCell,2012,22(1):211-222.
[2]MITSUHIRO A,TEVA V,MASAHIKO F,etal.Roles ofPIN-FORMED1 andMONOPTEROSin pattern formation of the apical region of theArabidopsisembryo[J].Development,2002,129(17):3 965-3 974.
[3]NOBUTOSHI Y,MIIN-FENG WU,CARA M,etal.A molecular framework for auxin-mediated initiation of flower primordial[J].DevelopmentalCell,2013,24(3):271-282.
[4]TOM J,GUILFOYLE,GRETCHEN HAGEN.Auxin response factors[J].CurrentOpinioninPlantBiology,2007,10(5):453-460.
[5]DREHER KA,BROWNN J,SAW RE,etal.TheArabidopsisAux/IAA protein family has diversified in degradation and auxin responsiveness[J].PlantCell,2006,18(3):699-714.
[6]BERLETH T,JÜRGENS G.The role of theMONOPTEROSgene in organizing the basal body region of theArabidopsisembryo[J].Development,1993,118(2):575-587.
[7]CAROL L W,MATHIAS S,QIAN YU,etal.Dynamics ofMONOPTEROSandPIN-FORMED1 expression during leaf vein pattern formation inArabidopsisthaliana[J].ThePlantJournal,2007,49(3):387-398.
[8]CHRISTIAN S H,THOMAS B.TheArabidopsisgeneMONOPTEROSencodes a transcription factor mediating embryo axis formation and vascular development[J].TheEMBOJournal,1998,17(5):1 405-1 411.
[9]D.ROELAND B,ALEJANDRA F,WILLY A M,VAN D B,etal.Structural basis for DNA binding specificity by the auxin-dependent ARF transcription factors[J].Cell,2014,156(3):577-589.
[10]ULMASOV T,HAGEN G,GUILFOYLE T J.Dimerization and DNA binding of auxin response factors[J].PlantJournalforCell&MolecularBiology,1999,19(3):309-319.
[11]TIWARI S B,GRETCHEN H,TOM G.The roles of auxin response factor domains in auxin-responsive transcription[J].PlantCell,2003,15(2):533-543.
[12]JASMINE J T G,MIRANDA J M,MICHAEL T B,etal.A novel,semi-dominant allele ofMONOPTEROSprovides insight into leaf initiation and vein pattern formation[J].Planta,2012,236(1):297-312.
[13]OSAMA O,JASON G,MEGAN G S,etal.Characterization of an allelic series in theMONOPTEROSgene ofArabidopsis[J].Genesis,2013,52(2):127-133.
[14]NADEN T K,WENZISLAVA C,DANIELLE M,etal.Deletion of MP/ARF5 domains Ⅲ and Ⅳ reveals a requirement for Aux/IAA regulation inArabidopsisleaf vascular patterning[J].NewPhytologist,2012,194(2):391-401.
[15]THORSTEN H,EVA B,ISABEL B,etal.TheArabidopsisBODENLOSgene encodes an auxin response protein inhibitingMONOPTEROS-mediated embryo patterning[J].Genes&Development,2002,16(13):1 610-1 615.
[16]STEFFEN L,IVE DE S,MARTINA K,etal.Auxin triggers a genetic switch[J].NatureCellBiology,2011,13(5):611-615.
[17]TIAN Q,REED J.Control of auxin-regulated root development by theArabidopsisthalianaSHY2/IAA3 gene[J].Development,1999,126(4):711-721.
[18]DOLF W,EVA B,KATJA E J,etal.Developmental specificity of auxin response by pairs of ARF and Aux/IAA transcriptional regulators[J].TheEMBOJournal,2005,24(10):1 874-1 885.
[19]LONG J A,CAROLYN O,SMITH Z R.TOPLESS regulates apical embryonic fate inArabidopsis[J].Science,2006,312(5 779):1 520-1 523.
[20]XIANG D Q,YANG H,PRAKASH V,etal.POPCORNfunctions in the auxin pathway to regulate embryonic body plan and meristem organization inArabidopsis[J].ThePlantCell,2011,23(12):4 348-4 367.
[21]HEIDI S,MIKE H,JEFF A L.TOPLESS mediates auxin-dependent transcriptional repression duringArabidopsisembryogenesis[J].Science,2008,319(5 868):1 384-1 386.
[22]BERT DE R,BARBARA M,SAIKO Y,etal.A bHLH complex controls embryonic vascular tissue establishment and indeterminate growth inArabidopsis[J].DevelopmentalCell,2013,24(4):426-437.
[23]ALEXANDRA S,BARBARA M,GERD J,etal.MONOPTEROS controls embryonic root initiation by regulating a mobile transcription factor[J].Nature,2010,464(7 290):913-917.
[24]MELANIE C,JOHN C,DOLF W,etal.DORNRÖSCHENis a direct target of the auxin response factor MONOPTEROS in theArabidopsisembryo[J].Development,2009,136(10):1 643-1 651.
[25]TYLER J D,IRA S,ENRICO S.Regulation of preprocambial cell state acquisition by auxin signaling inArabidopsisleaves[J].Development,2009,136(19):3 235-3 246.
[26]TYLER J D,IRA S,ENRICO S.Auxin signal transduction inArabidopsisvein formation[J].PlantSignaling&Behavior,2010,5(1):70-72.
[27]MINEKO K,TYLER J D,ENRICO S,etal.MONOPTEROS directly activates the auxin-inducible promoter of theDof5.8 transcription factor gene inArabidopsisthalianaleaf provascular cells[J].JournalofExperimentalBotany,2015,66(1):283-291.
[28]MINEKO K,SHUICHI Y.Transcriptional repression caused byDof5.8 is involved in proper vein network formation inArabidopsisthalianaleaves[J].TheBotanicalSocietyofJapanandSpringerJapan,2015,128(4):643-652.
[29]FRANCESCA G,DOLA S,LUCIA C.An integrative model of the control of ovule primordial formation[J].ThePlantJournal,2013,76(3):446-455.
[30]ZHANG J Y,HE SH B,LI L,etal.Auxin inhibits stomatal development through MONOPTEROS repression of a mobile peptide geneSTOMAGENin mesophyll[J].ProceedingsoftheNationalAcademyofSciences,2014,111(29):3 015-3 023.
[31]ZHONG ZHAO,STIG U A,KARIN L,etal.Hormonal control of the shoot stem-cell niche[J].Nature,2010,465(7 301):1 089-1 092.
[32]NADEN T K,YIN X J,WENZISLAVA C,etal.Distinct subclades ofAux/IAAgenes are direct targets ofARF5/MPtranscriptional regulation[J].NewPhytologist,2014,204(3):474-483.
[33]SHUNSUKE S,BARBARA M,AYAKO W,etal.Control of embryonic meristem initiation inArabidopsisby PHD-finger protein complexes[J].Development,2012,139(8):1 391-1 398.
[34]DOLF W,ALEXANDRA S,JASMIN S E,etal.Auxin triggers transient local short article signaling for cell specification inArabidopsisembryogenesis[J].DevelopmentalCell,2006,10(2):265-270.
[35]IVE DE S.Multimodular auxin response controls lateral root development inArabidopsis[J].PlantSignaling&Behavior,2010,5(5):580-582.
[36]JULIEN L,TATSUAKI G,SOAZIG G,etal.Interence of theArabidopsislateral root gene regulatory network suggests a bifurcation mechanism that defines primordial flanking and central zones[J].ThePlantCellPreview,2015,27(5):1 368-1 388.
[37]OKUSHIMA Y,FUKAKI H,ONODA M,etal.ARF7 and ARF19 regulate lateral root formation via direct activation ofLBD/ASLgenes inArabidopsis[J].PlantCell,2007,19(1):118-130.
[38]GERHARD K H P,JIM M,CHRISTIAN S H,etal.Studies on the role of theArabidopsisgeneMONOPTEROSin vascular development and plant cell axialization[J].Planta,1996,200(2):229-237.
[39]JOHNSON,LEE A,DOUGLAS,etal.PopulustrichocarpaMONOPTEROS/AUXINRESPONSEFACTOR5 (ARF5) genes:comparative structure,sub-functionalization,andPopulus-Arabidopsismicrosynteny[J].CanadianJournalofBotany,2007,85(11):1 058-1 070.
[40]BERT DE R,MILAD A,ALICE S B,etal.Integration of growth and patterning during vascular tissue formation inArabidopsis[J].Science,2014,345(6 197):636-643.
[41]CAROLE L T,DOMINIK S,EMMANUELLE M B,etal.Arabidopsisplant homeodomain finger proteins operate downstream of auxin accumulation in specifying the vasculature and primary root meristem[J].ThePlantJournal,2009,59(3):426-436.
[42]KYOKO O,MIO O,MIKIKO K,etal.Auxin-associated initiation of vascular cell differentiation byLONESOMEHIGHWAY[J].Development,2013,140(4):765-769.
[43]TAKASHI K,NANAE U,MASAHIKO M,etal.Direct control of shoot meristem activity by a cytokinin-activating enzyme[J].Nature,2007,445(7 128):652-655.
[44]AIDA M,ISHIDA T,TASAKA M.Shoot apical meristem and cotyledon formation duringArabidopsisembryogenesis:interaction among theCUP-SHAPEDCOTYLEDONandSHOOTMERISTEMLESSgenes[J].Development,1999,126(8):1 563-1 570.
[45]WENZISLAVA C,TATIANA S,DANIELLE M,etal.Irrepressible MONOPTEROS/ARF5 promotes de novo shoot formation[J].NewPhytologist,2014,204(3):556-566.
[46]WENZISLAVA C,THOMAS B.Overcoming recalcitrance-auxin response factor functions in plant regeneration[J].PlantSignaling&Behavior,2015,10(7):e993293.
[47]SUGANO S S,SHIMADA T,IMAI Y,etal.Stomagen positively regulates stomatal density inArabidopsis[J].Nature,2010,463(7 278):241-244.
[48]JIYAN QIA,YING WANG,TING YUA,etal.Auxin depletion from leaf primordia contributes to organ patterning[J].ProceedingsoftheNationalAcademyofSciences,2014,111(52):18 769-18 774.
[49]NEDEN T K,THOMAS B.A dominant mutation reveals asymmetry in MP/ARF5 function along the adaxial-abaxial axis of shoot lateral organs[J].PlantSignaling&Behavior,2012,7(8):940-943.
[50]林丽霞,屈莹,徐洋,等.龙眼体胚发生过程中生长素响应因子DIARF5a的克隆及表达分析[J].西北植物学报,2014,34(6):1 075-1 082.
LIN L X,QU Y,XU Y,etal.Cloning and expression analysis ofDlARF5ain the process of somatic embryogenesis inDimocarpuslonganLou.[J].ActaBot.Boreal.-Occident.Sin.,2014,34(6):1 075-1 082(in Chinese).
(编辑:宋亚珍)
Progress on the Functions of ARF5/MONOPTEROS(MP)
LI Qingqing,NAN Wenbin,ZHANG Hanma*
(Chongqing Key Laboratory of Molecular Biology of Plants Environmental Adaptations,College of Life Sciences,Chongqing Normal University,Chongqing 401331,China)
Abstract:Auxin response factors (ARFs) are key mediators of auxin responses,of which ARF5/MONOPTEROS(MP) plays a role in the regulation of many growth and development processes in Arabidopsis.In this article,we review recent progress in studying the regulatory functions of ARF5/MP,with a particular emphasis on its roles in mediating auxin signaling in hypophysis specification,vascular development and shoot apical meristem maintenance,as well as the structural and functional conservation of ARFs,thus provide a valuable reference for studying the molecular mechanisms of auxin signaling in plants.
Key words:ARFs;ARF5/MP;auxin
中图分类号:Q789
文献标志码:A
作者简介:李青青(1989-),女,在读硕士研究生,主要从事根尖干细胞调控机理研究。E-mail:liqingqing190@126.com*通信作者:张汉马,教授,博士导师,主要从事根尖干细胞调控研究。E-mail:hanmazhang@126.com
基金项目:国家自然科学基金(31501190);“973”计划前期研究专项(2014CB160306);重庆市教委科学技术项目(KJ1500330);重庆师范大学博士启动基金(15XLB008);重庆市教委创新团队建设基金(KJTD201307)和重庆师范大学引进人才启动基金(12XLR36)
收稿日期:2015-10-09;修改稿收到日期:2015-12-09
文章编号:1000-4025(2016)01-0197-07
doi:10.7606/j.issn.1000-4025.2016.01.0197
