光敏色素互作因子参与生长素调控的植物生长发育
2023-01-05钱静洁林苏梦张冬平高勇
钱静洁 林苏梦 张冬平 高勇
(扬州大学生物科学与技术学院,扬州225009)
光是植物生长发育过程中关键的环境因素,一方面为植物提供能量;另一方面作为一种信号,被植物感知并进行信号传递。为了能够更好地感知光信号,植物进化出了感知光的受体蛋白——光受体(photoreceptor)[1]。 光 敏 色 素(phytochromes,PHYS)是红光和远红光受体,在红光条件下,从非活性形式(Pr)转化为活性形式(Pfr),进入细胞核并调控下游基因转录,在远红光条件下,可缓慢从Pfr转化为Pr,在细胞质中积累。光敏色素互作因子(phytochrome-interacting factor,PIF)属于转录因子碱性螺旋-环-螺旋(basic helix-loop-helix,bHLH)家族中第15亚家族,是光敏色素下游的转录因子,能在细胞核内与活性形式的光敏色素相互作用并被降解[2-3]。
PIFs作为胞内信号的“枢纽”[4],参与环境信号和植物激素信号传导,调控种子萌发、下胚轴伸长、光/暗形态建成和避荫反应等过程[5]。生长素是一种植物激素,参与植物生长发育的多个阶段,促进茎伸长、叶片伸展,以及高温条件下生长所需的细胞伸长,并抑制侧芽的生长,促进侧根的形成。研究发现PIFs能够参与生长素的合成、运输以及信号通路调控植物生长发育。
1 光敏色素互作因子调控生长素合成
吲哚-3-乙酸(indole-3-acetic acid,IAA)是一种天然的生长素,由色氨酸(Trp)依赖途径和色氨酸非依赖途径共同合成[6-8]。吲哚-3-丙酮酸(indole-3-pyruvic acid,IPyA)途径是色氨酸依赖途径中的主要生长素合成路径。在IPyA途径中,Trp首先被色氨酸转氨酶家族基因(tryptophan aminotransferase of Arabidopsis,TAA)催化为IPyA[9-10],然后通过限速酶 YUCCA(YUC)将 IPyA 催化为 IAA[11-12]。PIFs主要通过调控IPyA途径影响生长素的合成。研究发现,当红光/远红光比值较低和高温时,PIF4积累,促进TAA1表达,将Trp催化形成IPyA,提高IPyA的含量,从而促进生长素的合成。PIF4、PIF5和PIF7也会直接调控YUC8、YUC9等基因的表达,将IPyA催化为IAA,促进生长素合成(图1-A)[13-15]。最新研究发现,除了YUC对IPyA进行调控外,一种尿苷二磷酸-糖基转移酶(uridine diphosphateglycosyltransferases,UDP-GTs)UGT76F1 也会对 IPyA产生影响,促进IPyA糖基化形成IPyA-葡萄糖结合物IPyA-Glc,拮抗YUC催化IPyA形成IAA来控制内源生长素水平,参与生长素动态平衡的调节。研究发现UGT76F1的转录受到光信号的调控,在pif4突变体中,UGT76F1表达量上调。进一步研究发现,PIF4直接与UGT76F1启动子结合负调控UGT76F1转录,影响生长素的合成(图1-A)[16-17]。在高温条件下,PIF4也会调控色氨酸依赖途径中的另一条生长素合成途径——色胺(tryptamine,TAM)途径。PIF4促进色胺途径中的催化酶基因CYP79B2表达,将色氨酸催化形成吲哚-3-乙醛肟(indole-3-acetaldoxime,IAOx),促进生长素的合成(图1-A)[13]。研究发现低比例红光/远红光和高温使PIFs积累,促进生长素合成,导致植物下胚轴伸长,与之相反,紫外光能通过降低PIFs的蛋白含量,抑制生长素的合成,使植株下胚轴伸长减弱。在紫外线B(UVB)辐射下,UV-8抑制PIFs表达,拮抗在低比例红光/远红光下导致的下胚轴伸长。紫外光受体UVR8(UV resistance locus 8)会被UV-8激活,与组成型光形态建成蛋白1(constitutive photomorphogenic 1,COP1)相互作用,上调光形态建成正调控因子HY5(LONG HYPOCOTYL 5)及其同源物HYH(HY5 HOMOLOG)的转录,抑制赤霉素(gibberellins,GAs)的合成,导致DELLA蛋白的浓度升高,进一步抑制PIF4和PIF5的表达,从而抑制生长素的合成。同时,UVR8也会直接与PIF4和PIF5结合,抑制生长素的合成,下胚轴伸长减弱(图1-B)[18-19]。
2 光敏色素互作因子调控生长素转运
生长素极性运输(polar transport,PAT)是植物光受体传递信息所必需的[20]。在PAT中,生长素可以质子化后被动内流进入细胞,或通过生长素内输载体AUX/LAX(AUXIN1/LIKE AUX1)内流进入细胞[21],并通过极性定位的外输载体PIN(PIN-formed)运输到相邻细胞[22-23]。生长素通过PIN进行的极性运输是光受体介导的生长反应必不可少的,包括下胚轴伸长、顶端弯曲等。研究发现,PIF7在低比例红光/远红光时积累,促进PIN3和PIN4的表达,将子叶中的生长素运输到下胚轴,促进下胚轴伸长(图1-C)[24]。PIFs不仅在低比例红光/远红光下调控生长素运输,在高温下也被调控。在高温下,PIF4积累,提高叶片中的生长素浓度,并将生长素转运至叶柄,随后PIN3将叶柄中生长素运输至表皮。同时PIF4也会激活蛋白激酶PID(PINOID)的基因的表达,增强PIN3磷酸化,使PIN3定位在细胞外膜上,促进生长素流向靶组织(图1-E)[25]。
3 光敏色素互作因子调控生长素信号转导
生长素抑制因子生长素/吲哚乙酸(AUX/IAA)与生长素响应因子(auxin response factor,ARF)是生长素信号转导中关键的两个转录因子,AUX/IAA能与ARF结合,并抑制ARF活性,进一步抑制生长素下游基因的转录[26]。PIFs通过调控AUX/IAA以及ARF的表达参与生长素的信号转导。低比例红光/远红光时,PIF4在下胚轴组织表皮中积累。PIF4的积累激活了AUX/IAA家族基因IAA19、IAA29等的表达,IAA19和IAA29的表达抑制生长抑制因子IAA17和 ARF6的表达,促进下胚轴伸长[27]。PIF4也会抑制生长素响应抑制因子AFR18的表达,从而增强下胚轴的伸长(图1-B)[28]。最新的研究发现,IAA3会与PIF4相互作用,抑制PIF4与下游基因的结合,抑制下胚轴的伸长(图1-B)[29]。研究还发现,在低比例红光/远红光时,bHLH家族中的转录因子,如HFR1(long hypocotyl in far-red)和PARs(phytochrome rapidly regulated)等作为避荫反应中的负调控因子,会与PIFs形成异源二聚体,减少PIFs与生长素相关基因启动子的结合,抑制下胚轴的伸长(图1-C)[30]。
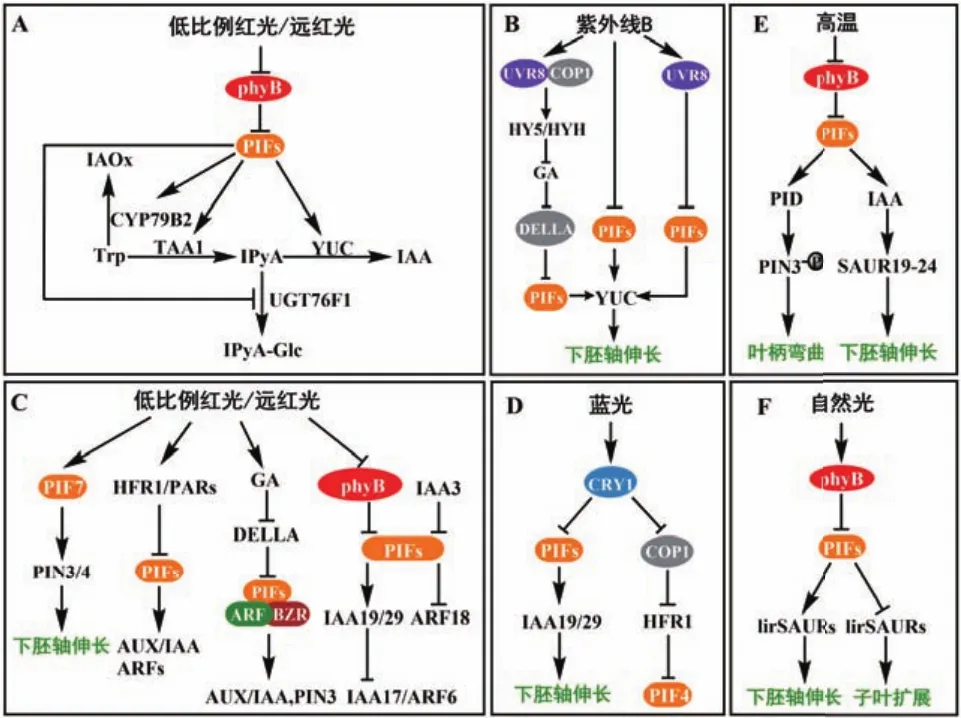
图1 光敏色素互作因子参与生长素的合成、运输和信号转导调控植物生长发育Fig.1 PIFs participate in auxin synthesis,transport and signaling to regulate plant growth and development
PIFs不仅在低比例红光/远红光下调控生长素信号转导,在蓝光和高温下也会对生长素信号转导产生影响。研究发现,在高温条件下,PIF4积累并促进生长素合成,提高生长素浓度,生长素浓度提高会促进生长素上调小RNA(small auxin upregulated RNA,SAUR)家族中的SAUR19表达,使下胚轴伸长(图1-E)[13]。近几年研究发现,PIFs能够直接调控SAURs的转录产物lirSAUR,并使其在子叶和下胚轴中差异表达,影响植物不同部位的生长。在光照条件下,PIFs被降解,释放被其抑制的lirSAUR,使lirSAUR转录积累,促进子叶扩展。而在下胚轴中,PIFs降解,游离的生长素降低,抑制lirSAUR的表达,因此下胚轴伸长减缓(图1-F)[31]。研究还发现,在蓝光下CRY1通过调控PIF4的表达拮抗高温导致的下胚轴伸长。CRY1能够直接与PIF4相互作用,抑制PIF4的表达,同时CRY1也可以与COP1相互作用,使PIFs抑制因子HFR1的蛋白保持稳定结构,抑制PIF4表达,从而影响IAA19、IAA29、YUC8等基因的转录(图1-D),抑制下胚轴伸长[32-33]。
生长素信号转导也能受到PIFs和其他激素的协同调控。在低比例红光/远红光和高温条件下,生长素浓度会迅速增加。然而,生长素浓度迅速增加影响生长素响应通常是短暂的,很快会消失[24,27,34]。因此,需要提高生长素的敏感性,以便在低比例红光/远红光中维持较长时间的生长素信号。在低比例红光/远红光下,赤霉素合成基因GA20氧化酶(GA-20 oxidase,GA20ox)和GA3氧化酶(GA-3 oxidase,GA3ox)的催化能力增强,促进GA的合成[34-36],GA浓度的增加导致DELLA蛋白的降解。DELLA蛋白是一种转录阻遏因子,可以抑制许多转录因子的活性,包括油菜素内酯(brassinosteroid,BR)反应生长促进剂BZR1(brassinazole-resistant 1)及其同源基因 BES1(bri1-ems-suppressor 1)、ARF和PIFs等[37-40]。这些转录因子与DELLA抑制子一起构成BZR-ARF-PIF/DELLA(BAP/D)蛋白复合体。BZR1/ARF6/PIF4通过诱导许多共同的靶基因来刺激细胞生长,并且它们相互作用增强了彼此在这些靶基因上的活性,提高了生长素的敏感性,影响植物生长发育(图1-C)[40-41]。
4 展望
PIFs能够调控种子萌发、光形态建成和避荫反应等生长发育过程,在植物整个生长周期中发挥作用。PIFs通过参与生长素的合成、运输和信号转导,将光信号和生长素信号串联起来。由于PIFs家族基因的多样性,使得解析PIFs调控生长素的机制变得复杂。目前,PIFs调控生长素的研究主要集中在拟南芥PIF4、PIF5和PIF7中,对PIF1、PIF2、PIF3和PIF6的研究较少,因此,开展拟南芥其他PIFs的研究可以完善PIFs家族与生长素之间的调控关系,使调控网络更加完整。同时PIFs调控生长素的研究多集中在拟南芥中,进一步探索农作物,如水稻、玉米和小麦中PIFs的作用机制,将更具有应用价值。其次,PIFs参与生长素合成路径,主要集中在参与了色氨酸依赖途径中的吲哚-3-丙酮酸途径和色胺途径,对于PIFs是否参与其他色氨酸依赖路径如吲哚-3-乙腈途径(3-Indoleacetonitrile,IAN)和色氨酸非依赖途径还有待于研究。生长素信号路径中,已经发现PIF4与IAA17/19和ARF18等相互作用,抑制下胚轴伸长。在拟南芥中,AUX/IAA家族有34个成员,ARF家族中有23个成员,因此PIFs是否会与其他IAAs和ARFs相互作用,最终会如何调控植物生长发育仍然需要探索。之前的研究还发现,PIF4在高温下可以促进生长素的合成、运输和信号转导,调控下胚轴生长,表明PIFs与温度相关。因此,将温度-光信号-生长素串联起来,探索它们之间的协同调控关系也是今后的研究方向。随着研究方法和技术的深入,PIFs参与生长素调控的植物生长发育机制将被阐述的更加清晰,可为植物的遗传改良提供理论支持。