颅骨腺泡状软组织肉瘤的影像学表现
2016-03-22郝大鹏石祥龙于俪媛万光耀刘吉华徐文坚
李 洋,郝大鹏,石祥龙,于俪媛,万光耀,刘吉华,徐文坚
(青岛大学附属医院放射科,山东 青岛 266003)
颅骨腺泡状软组织肉瘤的影像学表现
李 洋,郝大鹏,石祥龙,于俪媛,万光耀,刘吉华,徐文坚
(青岛大学附属医院放射科,山东 青岛 266003)
目的:探讨颅骨腺泡状软组织肉瘤(Alveolar soft part sarcoma,ASPS)的影像学特征。资料与方法:回顾性分析8例经手术病理证实的颅骨ASPS的CT(n=8)、MRI(n=8)及MR静脉造影(MRV)(n=2)表现。结果:8例ASPS均以推压头皮软组织向外生长为主,向内则与硬脑膜分界不清。CT表现:6例原发性APSP呈溶骨性骨质破坏,见不均匀密度肿块,含斑片状残留骨质,边缘示不完整骨性薄壳;2例继发性ASPS呈溶骨性骨质破坏,肿块密度较均匀。MRI表现:6例原发性ASPS外观呈“蘑菇征”,呈以等T1、长T2、高DWI信号为主的混杂信号,内部可见片状T2WI高信号(n=6)、点条状低信号(n=4)或簇状血管影(n= 2),MR增强示明显不均匀强化,并于肿瘤两侧出现“硬膜尾征”;2例继发性ASPS呈卵圆形,呈均匀等T1、等T2信号,明显均匀强化;6例原发性ASPS的ADC值平均为2.19×10-4mm2/s,2例继发性ASPS的ADC值平均为1.76×10-4mm2/s。MRV表现:上矢状窦受压,肿块内见大量引流静脉。结论:颅骨ASPS具有特征性的影像表现,结合其临床、病理特征,有助于本病的诊断。
肉瘤,软组织腺泡状;颅骨肿瘤;体层摄影术,螺旋计算机;磁共振成像;磁共振血管造影术
腺泡状软组织肉瘤(Alveolar soft part sarcoma,ASPS)是一种罕见的软组织恶性肿瘤,占软组织肉瘤的0.5%~1%,由Christopherson和Stewart在1952年首次发现并描述[1-2]。ASPS好发于四肢深部软组织,也可发生于躯干、头颈部、腹壁及腹膜后等处,原发或继发转移至颅骨者罕见[3],国内外仅见个例报道。ASPS虽然生长较缓慢,早期临床症状可不明显,但是迟发性转移率高,可经血行、淋巴道转移至全身,预后不良[4-5],因此通过影像学方法早期检出就显得尤为重要,笔者回顾性分析经手术病理证实的8例原发或继发转移至颅骨的ASPS,总结其CT、MRI和MR静脉血管造影(MRV)表现,以便更好地认识这一罕见类型的颅骨肿瘤,提高诊断准确率,为临床诊断、治疗和判断预后提供更多依据。
1 资料与方法
1.1 临床资料
2005年8月—2015年8月在我院经手术病理证实为颅骨ASPS的8例患者纳入本次研究,其中男3例,女5例,年龄20~33岁,平均25.9岁。其中原发性颅骨ASPS共6例,继发于下肢软组织ASPS 1例,继发于舌ASPS 1例。临床症状包括颅骨进行性增大的肿物,6例原发性ASPS无明显头痛症状,2例继发性ASPS有较明显的头痛、头晕症状。
1.2 检查方法
8例均经CT平扫和MRI平扫、普通增强扫描检查,2例同时行MRV检查。CT检查使用德国Siemens公司64层螺旋CT机,扫描参数:电流控制在180 mA左右,电压控制在130 kV左右,层厚为0.5 cm,层距为0.25 cm。使用层厚0.125 cm、间隔重叠0.062 5 cm进行1/2重建。MR检查采用美国Signal公司GE Signal 1.5T超导型磁共振扫描仪,层厚5 mm,层距5 mm。扫描方法包括横轴位、冠状位及矢状位。扫描序列采用自旋回波序列T1WI(TR 300~500 ms,TE 15~30 ms),快速自旋回波序列T2WI(TR 4 000~6 000 ms,TE 80~120 ms)。弥散加权成像 (DWI)采用单次激发自旋回波-回波平面(SE-EPI)序列,TR 7 000 ms,TE 80 ms,扩散敏感系数(b)值选用0 s/mm2和1 000 s/mm2。增强扫描采用自旋回波序列T1WI,对比剂使用Gd-DTPA,剂量为0.1 mmol/kg体质量。2例MRV采用冠状面2D TOF成像序列,TR 25 ms,TE 4 ms;层厚1.5 mm,层间距1.5 mm。
1.3 图像后处理
利用ADW 4.2工作站配备处理DWI的Functiontool软件处理DWI数据获得相应ADC图。在病灶最大层面选取感兴趣区(ROI),包括整个病灶的实性部分,避开囊变区及病变边缘,在选择ROI时对照同一层面的T1WI、T2WI图像,避开其低信号区,以去除瘤体内骨质对ADC值的影响。每个ROI测量3次,取其平均值。
1.4 图像分析
回顾性分析8例颅骨ASPS的CT、MRI特征,包括病变部位、形态、边缘、CT密度及MRI信号特点、有无钙化、骨质改变、强化程度。所有影像资料由2位有多年影像诊断经验的医师采用盲法共同审阅,对影像累及部位及征象不一致处,由2位医师经协商达成一致。
1.5 病理学分析
所有标本均经4%中性甲醛固定,石蜡包埋,5μm连续切片,常规行HE染色和PAS-D染色。免疫组化采用EnVision法,所用抗体为Vim、CK、S-100、肌细胞生成素(Myogenin)、MyoD1、NSE、EMA、CgA、Desmin、MelanA、HMB-45等。核检测转录因子E3(TFE-3)。参考Schenning等[6]所提出的诊断标准,即镜下可见胞质内酸希夫(PAS)阳性的针状或杆状结晶体。
2 结果
2.1 病变部位
6例原发性ASPS左侧发病3例,右侧发病1例,累及双侧2例,病变累及额骨2例、顶骨4例;继发转移至颅骨的ASPS累及双侧顶骨1例,右侧枕骨1例。
2.2 CT表现
骨质改变:6例原发性APSP均于发病部位形成骨质破坏区,破坏区内部呈溶骨性骨质破坏,可见斑片状残留骨质,破坏区边缘可见骨性包壳,壳薄且不完整;2例继发性ASPS于发病部位形成穿凿样骨质破坏区,边缘不规则,内部无残留骨质,边缘未见明显骨性包壳。
软组织改变:8例ASPS均于发病部位形成软组织肿块,6例原发性ASPS肿块形状不规则,密度不均匀,内含斑片状低密度影,2例继发性ASPS肿块呈卵圆形,密度较均匀(图1,2,8)。
2.3 MRI表现
MRI平扫信号改变:6例原发性ASPS以等T1、长T2信号为主,病变内部含斑片状长T1、长T2信号以及散在血管流空影 (其中2例呈点条状低信号,4例呈簇状血管影)。2例继发性ASPS以等T1、等T2信号为主,信号较均匀。
MRI显示病变范围:8例ASPS均以推压头皮软组织向外生长为主,向内则与硬脑膜分界不清,脑实质未见受累,6例原发性ASPS形态呈 “蘑菇征”,2例继发性ASPS形态呈卵圆形。
DWI和ADC值:6例原发性ASPS病变主体于DWI上呈高信号,内含斑片状低DWI信号,2例继发性ASPS在DWI上呈高信号。6例原发性ASPS的ADC值平均为2.19×10-4mm2/s。2例继发性ASPS的ADC值平均为1.76×10×10-4mm2/s。
MRI增强表现:6例原发性ASPS呈明显不均匀强化,内含斑片状不强化影;2例继发性ASPS则呈明显均匀强化。8例病变邻近硬脑膜皆可见强化,6例原发性ASPS于病变两侧出现“硬膜尾征”,尾部相对病变主体较短,双侧尾部形态一致,属对称多极型;2例继发性ASPS于病变一侧出现 “硬膜尾征”,形态光滑,属平滑型。
MRV表现:1例位于双侧顶骨、枕骨和1例位于顶骨的ASPS均可见邻近肿瘤的上矢状窦后部受压,肿块内示大量迂曲的引流静脉(图3~7,9~11)。
2.4 病理学表现
术中见灰黄、灰褐色碎组织多块,表面被膜包绕,切面呈灰黄、灰白色,质韧,肿物内见骨组织。镜下见瘤巢呈圆形、索条形,似器官、内分泌腺样结构,含呈束状排列的棒状、菱形晶体伴大量圆形、多角形细胞,可见耐淀粉酶颗粒(图12)。免疫组化:PAS阳性表达8例,Myogenin阳性表达7例。6例转录因子E3(TFE-3)呈阳性。
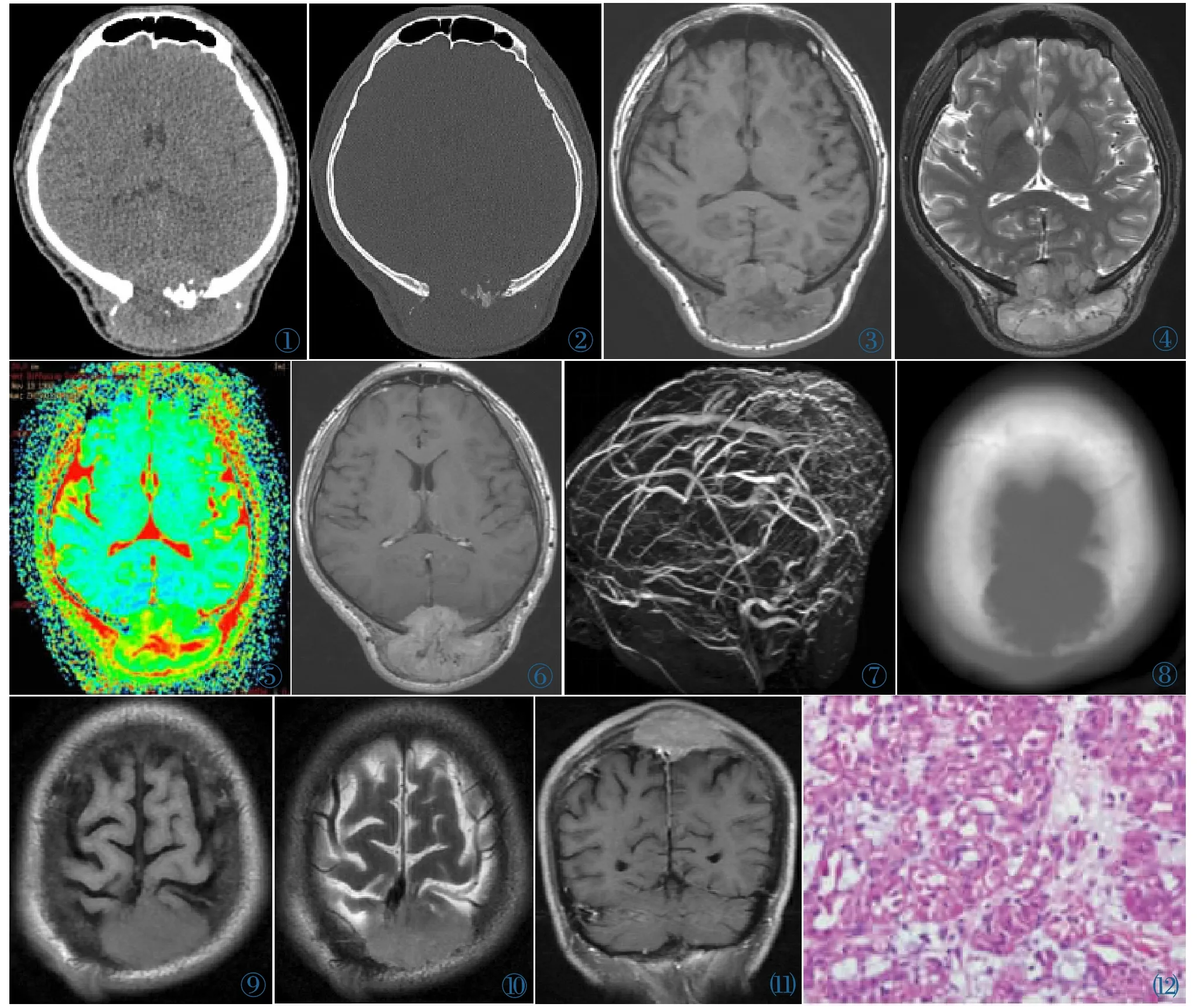
图1~7 男,21岁。CT软组织窗示双侧顶骨软组织肿块,整体较均质,内含少许斑片状低密度影;CT骨窗示双侧顶骨溶骨性骨质破坏,边缘可见不完整骨性包壳,壳较薄,内部含斑片状钙质密度影;MR平扫示双侧顶骨肿块,以等T1、长T2信号为主,病变内含斑片状长T1、长T2坏死区及血管流空影;ADC图灰度较低,ADC值为2.27×10-4mm/s2;MR增强示病变呈不均匀明显强化;MRV示肿瘤内大量引流静脉。 图8~11男,33岁。CT骨窗示顶骨溶骨性骨质破坏;MR平扫示顶部等T1、等T2信号肿块影;MR增强示明显均匀强化。 图12 瘤巢细胞基质呈玻璃样变性(HE染色)。Figure 1~7. Male,21 years old.CT with soft tissue window showed a soft tissue mass with homogeneous density occurred in bilateral parietal bone,containing a little piece of low density;CT with bone window showed osteolytic bone destruction.The edge of the lesion showed incomplete bony package shell,and the shell is thinner,with patchy calcium density;On MR scanning,a soft tissue mass occurred in bilateral parietal bone,with iso T1and long T2weighted signal,containing patchy long T1and long T2weighted signal,necrosis and vascular flowing-void effect;The ADC grayscale value was low;The ADC values was 2.27×10-4mm/s2;MR enhanced imaging showed heterogeneous enhancement;MRV showed tumor with venous drainage. Figure 8~11. Male,33 years old.CT with bone window showed osteolytic bone destruction in the parietal bone;MR scanning showed a mass with iso T1and iso T2weighted signal;MR enhanced imaging showed obvious homogeneous enhancement.Figure 12.Tumor cell matrix showed glass-like degeneration(HE staining).
3 讨论
ASPS好发于30岁之前人群,女性稍占优势;发生于四肢深部肌肉或筋膜的ASPS以成年人居多,而发生于头颈部的ASPS则多见于儿童或青少年[7]。本组8例ASPS患者平均年龄25.9岁,男女之比为3∶5,与文献所述相接近。原发性颅骨ASPS多无明显临床症状,病程较缓慢,多以头部逐渐增大、隆起的肿物就诊,而继发性ASPS多可出现头晕、头痛以及肿瘤原发部位产生的临床症状[8]。本组6例原发性颅骨ASPS患者均以头部无痛性肿物为首发症状入院就诊,病程5月以上,无头痛、头晕及恶心、呕吐,意识清楚,昏迷评分(GCS)≤15分。2例继发性颅骨ASPS患者均有头痛症状,且均表现出肿瘤原发部位的相应症状,继发于下肢软组织者出现左侧股部进行性增大的软组织肿块,疼痛不明显,肺内见多发性结节灶,有咳嗽、痰中带血症状;继发于舌部软组织者表现为舌部巨大软组织肿块,吞咽、发音困难,喉咽亦见转移性病灶,多发淋巴结肿大,头痛症状明显。
显微镜下,颅骨ASPS最具特征性的表现为周期性PAS呈阳性,大量耐淀粉酶颗粒,细胞质见大量菱形、棒状晶体呈束状排列,局部可见圆形、多角形细胞呈小泡状排列,这些结构由毛细血管网和精细的纤维网分隔,瘤巢中心细胞缺乏黏附性、多发细胞坏死,这些因素使肿瘤形成假腺泡样结构[6]。肿瘤细胞核仁明显,含有丰富的嗜酸性细胞胞浆,有丝分裂少见。免疫组化示S-100为阴性,Myogenin呈阳性表达。肿瘤大体外观多呈结节状,切面呈灰白色,血供非常丰富,易出血[8-9]。关于ASPS的组织学起源仍存在争议,早期学者认为ASPS起源于神经,而Nakano[10]研究发现肿瘤细胞内含有肌动蛋白和多种骨骼肌细胞抗体,Christopherson等[11]认为ASPS可能起源于肌梭,后者包含肌梭纤维和神经组织。
病程缓慢而又具备恶性肿瘤对周围组织结构的侵蚀性特点,使得颅骨原发性ASPS在CT上具有特征性表现,本组6例颅骨原发性ASPS于肿瘤边缘均可见到不完整的骨性薄壳,笔者认为这是肿瘤缓慢生长、逐渐增大,使受累颅骨长期受到推压所致,而包壳的不完整性以及内部逐渐被侵蚀掉的残留骨,与本病的侵蚀性特征是分不开的。本研究中,6例原发性ASPS在发病部位处形成的软组织肿块体积均较大,且随着病程进展不断推压头皮软组织,以向外生长为主,向内与硬脑膜分界欠清,但无脑实质的累及。由于ASPS细胞排列致密,纤维血管束丰富,使肿瘤大部分密度均实,但随着病程迁延,内部可见到多灶性斑片状坏死区域,从而在CT上表现为斑片状低密度坏死区和残留骨。本组2例继发性颅骨ASPS除表现出原发部位的相应影像学表现外,对于颅骨的破坏均呈溶骨性骨质破坏,破坏区边缘呈不规则状,未见骨性包壳,软组织肿块的密度较均匀。MRI增强检查,6例ASPS均于肿瘤两侧出现“硬膜尾征”,笔者认为这与肿瘤的恶性侵袭性有一定联系,发生于颅骨凸面的良性脑膜瘤也可出现双侧“硬膜尾征”的征象,但发生的概率相对较低,其病理基础主要为硬膜的反应性改变,而非肿瘤的侵袭性所致[12]。综上,结合本组病例及相关文献[13],原发性颅骨ASPS的CT表现可分为3个诊断要点:①肿瘤边缘可见不完整骨性包壳,包壳较薄;②肿瘤内部可见不规则状、斑片状钙质密度影;③肿块体积较大,以推压头皮软组织向外生长为主,肿瘤内部可见斑片状低密度坏死区。继发性颅骨ASPS的CT特征主要分为两个诊断要点:①对发病颅骨呈穿凿样、溶骨性骨质破坏,无包壳及残留骨;②肿块密度较均匀,亦见推压头皮软组织向外生长。
本组6例原发性颅骨ASPS病变主体呈等T1、长T2信号,内部及边缘可见到低信号影,结合CT为骨质信号,另可见多发斑片状长T1、长T2坏死区,MR增强示明显不均匀强化,结合病理表现考虑与其瘤巢细胞缺乏黏附性、坏死相关,这也同样是与颅骨内脑膜瘤的鉴别点之一。此外,肿块内部另可见些许血管流空影,结合病理表现考虑与其血供丰富密切相关。DWI及表观扩散系数ADC值反应的是水分子的扩散速度。扩散速度越慢,DWI信号越高,ADC值越小,相应ADC图信号越弱,灰度越低,本组6例原发性颅骨ASPS由于肿瘤细胞排列致密、纤维血管束丰富,限制了水分子的扩散运动,因而病变主体在DWI上呈高信号,ADC图信号弱、ADC值低。本组2例继发性ASPS与原发性ASPS相比信号则更为均质,坏死区较少。MRI可清晰显示颅骨ASPS的病变范围,6例原发性ASPS向外广泛侵及头皮下软组织间隙,向内则侵犯硬脑膜,在MRI增强图像上病变两侧均可见到“硬膜尾征”,但尾部较短。ASPS常发生血管侵犯,后期可沿血行发生转移[14],本组2例原发性ASPS的MRV可见肿瘤邻近颅内大静脉以受压推移为主要改变,肿瘤内示大量引流静脉供血。根据本组病例及相关文献的MRI特点[15],笔者对颅骨原发性ASPS的MRI表现作出如下小结:①肿瘤形态呈“蘑菇征”,以推压头皮软组织向外生长为主,向内侵犯硬脑膜,于两侧呈现 “硬膜尾征”,尾部较短;②病变主体呈等T1、长T2信号,内部可见斑片状坏死区及血管流空信号,肿瘤边缘和内部可见长T1、短T2骨质信号,DWI呈高信号,ADC图信号弱、ADC值低;③MRV可见邻近颅内大血管以受压改变为主,肿瘤内示大量滋养血管。继发性颅骨ASPS的MRI特征主要有两点:①肿块信号均匀,可见推压头皮软组织向外生长;②肿块与硬脑膜分界不清,MRI增强可见“硬膜尾征”。
原发性与继发性颅骨ASPS的病理基础相似,光镜下均具备特征性的腺泡状或巢状结构,形成大小不同、排列一致的细胞巢,巢间纤维结缔组织间隔内含有衬以扁平内皮细胞的窦状血道[13]。瘤巢中心的细胞缺乏黏附性,病史较长时坏死更加明显,即形成常见的假腺泡状结构,致使病程较长的原发性颅骨ASPS病变内部多形成坏死和残留骨,而继发性颅骨ASPS多于下肢、肺等器官发现原发病灶之后,病史相对较短,瘤体生长程度较为缓慢,细胞瘤巢形成较少,因而假腺泡状结构数量也较少,肿块在CT和MRI上的密度、信号也较为均质。关于二者之间的鉴别,在临床症状上,原发性ASPS病史缓慢、疼痛不明显,而继发性ASPS病史相对较短且有疼痛症状;在影像学上,如上文所总结,原发与继发性ASPS在肿瘤形态、骨质改变、瘤内密度与信号、强化方式上皆有所不同。
颅骨原发性ASPS还需与发生于颅骨的其它肿瘤相鉴别:①板障型脑膜瘤,多呈膨胀性骨质破坏,周围可有残留的骨性包壳,但局部可见成骨,增强扫描呈均匀强化。恶性脑膜瘤坏死、囊变多见,密度不均匀,多侵犯脑组织,可有瘤周水肿,强化多以环状强化为主,虽也可破坏颅骨浸润头皮下脂肪间隙,但肿块周围多无骨性包壳[16]。②颅骨血管瘤,多以颅骨板障为中心向颅内外生长,CT上可见病变呈膨胀性骨质破坏,边缘较锐利,中心呈蜂窝状,内含多发斑点状钙化灶及纤维骨分隔,MR可见病变于T2WI上信号较高,内部可见血管流空影。③颅骨骨化性纤维瘤,呈多房性囊性肿块,密度不均,常伴大量钙化及骨化,内部可见网状纤维或骨性分隔影,MR上信号较为混杂,增强后内部分隔明显强化,囊性部分不强化[17]。此外,继发性颅骨ASPS与一般性颅骨转移瘤相比,浸润硬脑膜、颅骨,但不侵及脑实质,以推压头皮、向外生长为主的特点较具特征性。④颅骨组织细胞增生症,常累及造血功能旺盛的骨骼,尤其好发于儿童富含红骨髓的颅骨,临床表现以尿崩、突眼及颅骨肿块为主。CT上多表现为跨越颅缝生长的多骨性骨质破坏,边界清晰,无硬化边,骨质破坏区周围伴或不伴软组织肿块。软组织肿块在T1WI上信号较低,因板障脂肪组织被病灶替代所致,瘤周多见反应性水肿。
对于原发性颅骨ASPS,手术切除是最好的治疗途径,而对于全身多处转移的继发性颅骨ASPS,则需配合使用化疗和放射治疗。本病在颅骨肿瘤中实属罕见,术前通过传统CT和MRI可以对病变累及范围、肿瘤性质进行初步把握,本组病例通过三维CT重建、ADC值的测定以及MRV检查,有助于对本病进一步作出特征性总结。
[1]Wang HW,Qin XJ,Yang WJ,et al.Alveolar soft part sarcoma of the oral and maxillofacial region:clinical analysis in a series of 18 patients[J].Oral Pathol Oral Radiol,2015,119(4):396-401.
[2]Portera CA Jr,Ho V,Patel SR,et al.Alveolar soft part sarcoma: clinical course and patterns of metastasis in 70 patients treated at a single institution[J].Cancer,2001,91(3):585-591.
[3]Feng M,Jiang W,He Y,et al.Primary alveolar soft part sarcoma of the uterine cervix:a case report and literature review[J]. Int J Clin Exp Pathol,2014,7(11):8223-8226.
[4]Folpe AL,Deyrup AT.Alveolar soft-part sarcoma:a review and update[J].J Clin Pathol,2006,59(11):1127-1132.
[5]McCarville MB,Muzzafar S,Kao SC,et al.Imaging features of alveolar soft-part sarcoma:a report from Children’s Oncology Group Study ARST0332[J].AJR,2014,203(6):1345-1352.
[6]Schenning R,Vajtai P,Troxell M,et al.Alveolar soft part sarcoma:unusual etiology of mediastinal mass in an adolescent[J].Clin Pract,2013,3(2):e26.
[7]Anbarasi K,Sathasivasubramanian S,Kuruvilla S,et al.Alveolar soft-part sarcoma of tongue[J].Indian J Pathol Microbiol,2011, 54(3):581-583.
[8]Cohen DB,Jones DM,Fergus AH,et al.Metastatic alveolar softpart sarcoma of the intracranial skull base:case report[J].Skull Base,2002,12(1):33-38.
[9]Kinger M,Chakrabarti P,Varma A,et al.Alveolar soft part sarcoma of tongue in 14-year-old boy[J].Ann Maxillofac Surg, 2014,4(2):240-242.
[10]Nakano H.Alveolar soft part sarcoma:histogenesis[J].Anticancer Res,1998,18(6A):4207-4211.
[11]Christopherson WM,Foote FW,Stewart FW.Alveolar soft-part sarcomas;structurally characteristic tumors of uncertain histogenesis[J].Cancer,1952,5(1):100-111.
[12]刘亿,漆松涛.“脑膜瘤硬尾征”与脑膜瘤部位及其病理类型的关系[J].中国临床神经外科杂志,2012,28(5):499-503.
[13]周正荣,王坚,彭卫军,等.腺泡状软组织肉瘤的影像学特征及临床病理表现[J].中国癌症杂志,2009,19(1):12-16.
[14]Kim HS,Lee HK,Weon YC,et al.Alveolar soft-part sarcoma of the head and neck:clinical and imaging features in five cases[J].AJNR,2005,26(6):1331-1335.
[15]张海栋,王仁法,万捷,等.腺泡状软组织肉瘤的MRI表现[J].放射学实践,2009,24(9):1033-1036.
[16]张碧云,黄海青,陈自谦.原发性颅骨内脑膜瘤的CT与MRI表现[J].中国临床医学影像杂志,2009,20(7):549-550.
[17]解中福,靳松,阎晓玲,等.颅骨骨化性纤维瘤的CT、MRI表现与组织病理学相关性分析[J].实用放射学杂志,2009,25(7):947-950.
The imaging manifestations of alveolar soft part sarcoma in skull
LI Yang,HAO Da-peng,SHI Xiang-long,YU Li-yuan,WAN Guang-yao,LIU Ji-hua,XU Wen-jian
(Department of Radiology,the Affiliated Hospital of Qingdao University,Qingdao Shandong 266003,China)
Objective:To investigate the imaging features of alveolar soft part sarcoma(ASPS)in skull.Materials and Methods:The CT and MRI of eight patients with ASPS in skull confirmed by pathology were analyzed retrospectively.Results:All patients were shown excentric growth with pushing the scalp soft tissue and unclear margins abutting upon duramater.On CT scanning,six primary ASPSs were shown soft tissue mass with heterogeneous density,in which contained residual bone and uncompleted bony shell(n=6).The bone destruction was mainly osteolytic destruction(n=6).Two secondary ASPSs were shown soft tissue mass with homogeneous density and osteolytic destruction(n=2).On MRI scanning,six primary ASPSs were shown mushroom sign(n=6).The tumors appeared as hyper-intensity on T2WI,iso-intensity on T1WI and hyper-intensity on DWI(n=6).There were patchy hyper intensity areas,punctual/stripy hypo-intensity areas(n=4),clustered vessel signals(n=2) in tumors on T2WI.Inhomogeneous enhancement was seen on contrast-enhanced scan in six cases.Dural tail sign was seen in both side of the tumor(n=6).Two secondary ASPSs were shown orbicular-ovate mass(n=2).The tumors appeared as iso-intensity on T2WI and iso-intensity on T1WI(n=2).Homogeneous enhancement was seen on contrast-enhanced scan in two cases.The mean ADC value of six primary ASPSs was 2.19×10-4mm2/s.The mean ADC value of two secondary ASPSs was 1.76×10-4mm2/s.MRV was shown superior sagittal sinus pushed with a large number of drainage veins in the tumors.Conclusion:ASPS in skull was shown some typical imaging features.Combination the imaging features,clinical findings and pathology are helpful to the diagnosis the disease.
Sarcoma,alveolar soft part;Skull neoplasms;Tomography,spiral computed;Magnetic resonance imaging; Magnetic resonance angiography
R738.6;R739.41;R814.42;R445.2
A
1008-1062(2016)08-0584-05
2015-11-10;
2015-12-11
李洋(1988-),男,山东青岛人,在读硕士研究生。E-mail:ly8848128@126.com
郝大鹏,青岛大学附属医院放射科,266003。Email:haodp_2009@163.com
