四硼酸锂水溶液体系的热容及离子相互作用
2016-03-21张思思刘元会郭亚飞邓天龙
李 珑,张思思,刘元会,郭亚飞,邓天龙
(天津市海洋资源与化学重点实验室,天津科技大学化工与材料学院,天津300457)
四硼酸锂水溶液体系的热容及离子相互作用
李珑,张思思,刘元会,郭亚飞,邓天龙
(天津市海洋资源与化学重点实验室,天津科技大学化工与材料学院,天津300457)
摘要采用Setaram BT 2.15微量热仪测定了Li2B4O7-H2O体系( Li2B4O7的浓度为0. 00415~0. 4208 mol/kg) 在298. 15,308. 15和323. 15 K下的热容,分别计算了不同温度和浓度下的表观摩尔热容,并获得了不同温度下表观摩尔热容与浓度的关系式.基于Li2B4O7-H2O体系的热容测定结果,应用Pitzer电解质溶液离子相互作用表观摩尔热容模型,拟合获得了四硼酸锂在不同温度下的Pitzer单盐参数.
关键词四硼酸锂;热容;量热法;电解质溶液; Pitzer单盐参数
硼酸盐功能材料因其优越的性能而在移动通讯、医药和航天航空等领域被广泛应用,是国家高新技术领域的重要战略物资[1].我国西部四省区富硼、锂盐湖资源丰富,构建复杂卤水体系热力学模型及其动态预测系统对于资源的合理开发利用至关重要[2~4].盐湖卤水体系的热容与卤水蒸发结晶、稀释成盐等物理、化学过程密切相关,有助于揭示水溶液中溶质离子、分子与溶剂水分子之间的微观相互作用,是构建复杂卤水体系热力学模型的重要物理量[5].
近年来,研究人员针对不同形态锂硼酸盐固体的标准摩尔生成焓开展了系统深入的研究.Li等[6]、Zhu等[7]和Li等[8,9]测定了Li2B4O7·3H2O,LiB5O8·5H2O,LiBO2·2H2O,LiBO2·8H2O,Li3B5O8( OH)2(Ⅰ,Ⅱ)和Li4[B5O13( OH)2]·3H2O固体硼酸盐的标准摩尔生成焓; Zhang等[10]测定了0. 0187 mol/kg的Li2B4O7溶液在80~355 K条件下的低温热容,获得了每隔5 K的焓、熵和吉布斯自由能热力学函数值;尹国寅[11]研究测定了LiCl-Li2B4O7-H2O体系不同四硼酸锂离子强度分数在298. 15 K时的稀释热;李积才等[12]测定了四元体系Li2B4O7-Li2SO4-LiCl-H2O及其2个三元子体系Li2B4O7-Li2SO4-H2O和Li2B4O7-LiCl-H2O的稀释热,并结合Debye-Huckel极限公式计算获得了平均表观摩尔热容.
本文采用Setaram BT 2.15微量热仪测定了四硼酸锂水溶液体系在不同温度和不同浓度下的热容,获得了不同温度下相对表观摩尔热容与浓度的关系式.利用Pitzer电解质溶液离子相互作用表观摩尔热容模型,获得了不同温度下四硼酸锂的Pitzer单盐参数,对于构建具有我国盐湖卤水组成特征的盐湖卤水体系热力学化学模型及促进盐湖卤水资源开发利用具有参考价值.
1 实验部分
1.1试剂与仪器
无水四硼酸锂(分析纯,国药集团化学试剂有限公司) ;二次去离子水( pH=6. 60,电导率<1×10-4S/m).
BT 2.15微量热仪(法国Setaram公司)基于卡尔维3D传感器设计技术,通过液氮制冷以实现低温段热量的测定,样品池容积大(标准池12. 5 cm3),分辨率0. 07 μW,RMS噪音约1 μW,恒温扫描温度精度±0. 0001 K; Labsys热重-差示扫描同步热分析仪( TG-DSC,法国Setaram公司) ; Prodigy电感耦合等离子体发射光谱仪( ICP-OES,美国Leeman公司) ;变温配置XD系列X射线粉晶衍射仪( XRD,北京普析通用仪器有限责任公司).
1.2样品的制备和分析
根据文献[11]方法二次重结晶四硼酸锂.重结晶产品经XRD分析,表明重结晶干燥后的产物为Li2B4O7·3H2O.重结晶固相经TG-DSC同步热分析,发现从437. 15 K开始失水,633. 15 K失水完成,仅有1个失重峰,失重率为24. 3%,而Li2B4O7·3H2O失去3分子结晶水的理论失重率为24. 2%.经化学分析方法得到重结晶的四硼酸锂样品中四硼酸锂的质量分数为99. 78%.
准确称取一定质量经重结晶的Li2B4O7·3H2O固体,用除去二氧化碳的二次去离子水溶解,配制成准确浓度的储备溶液,密封,备用.实验中的待测溶液通过准确称取需要量的除去二氧化碳的二次去离子水和储备液混合得到.
1.3热容的测定
采用精密天平准确称取待测溶液(精度±0. 01 mg)加入样品池中,参比池为空,分别将样品池与参比池缓慢放入微量热仪中.放置样品后,设置热容实验程序控温.当样品池与参比池达到动态热平衡时,程控样品升温或降温到起始温度,在恒温阶段,设置稳定3 h,然后以0. 1 K/min升温速率升温,在终点温度稳定5 h,确保升温前后的热流信号基线走稳.采用同样的操作过程进行空白实验.
2 结果与讨论
2.1 Li2B4O7-H2O体系不同温度下热容的测定
依据实验方法,测定了不同质量摩尔浓度的Li2B4O7水溶液在298. 15,308. 15和323. 15 K时的热容值( Cp)结果见表1.按下式计算可获得溶质表观摩尔热容( Cp,Φ) :
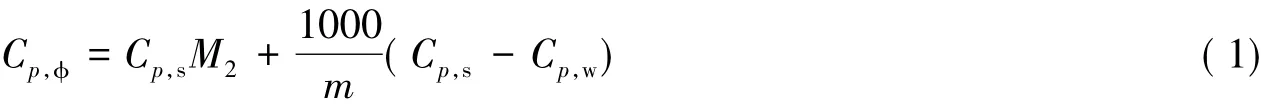
式中: Cp,Φ( J·K-1·mol-1)是溶质的表观摩尔热容; Cp,s( kJ·K-1·kg-1)为不同浓度Li2B4O7水溶液的热容实验测定值; Cp,w( J·K-1·mol-1)为水在同温度时的比热容; M2( g·mol-1)是溶质的摩尔质量,m ( mol·kg-1)为Li2B4O7的质量摩尔浓度,即在1 kg水中含四硼酸锂的摩尔数.
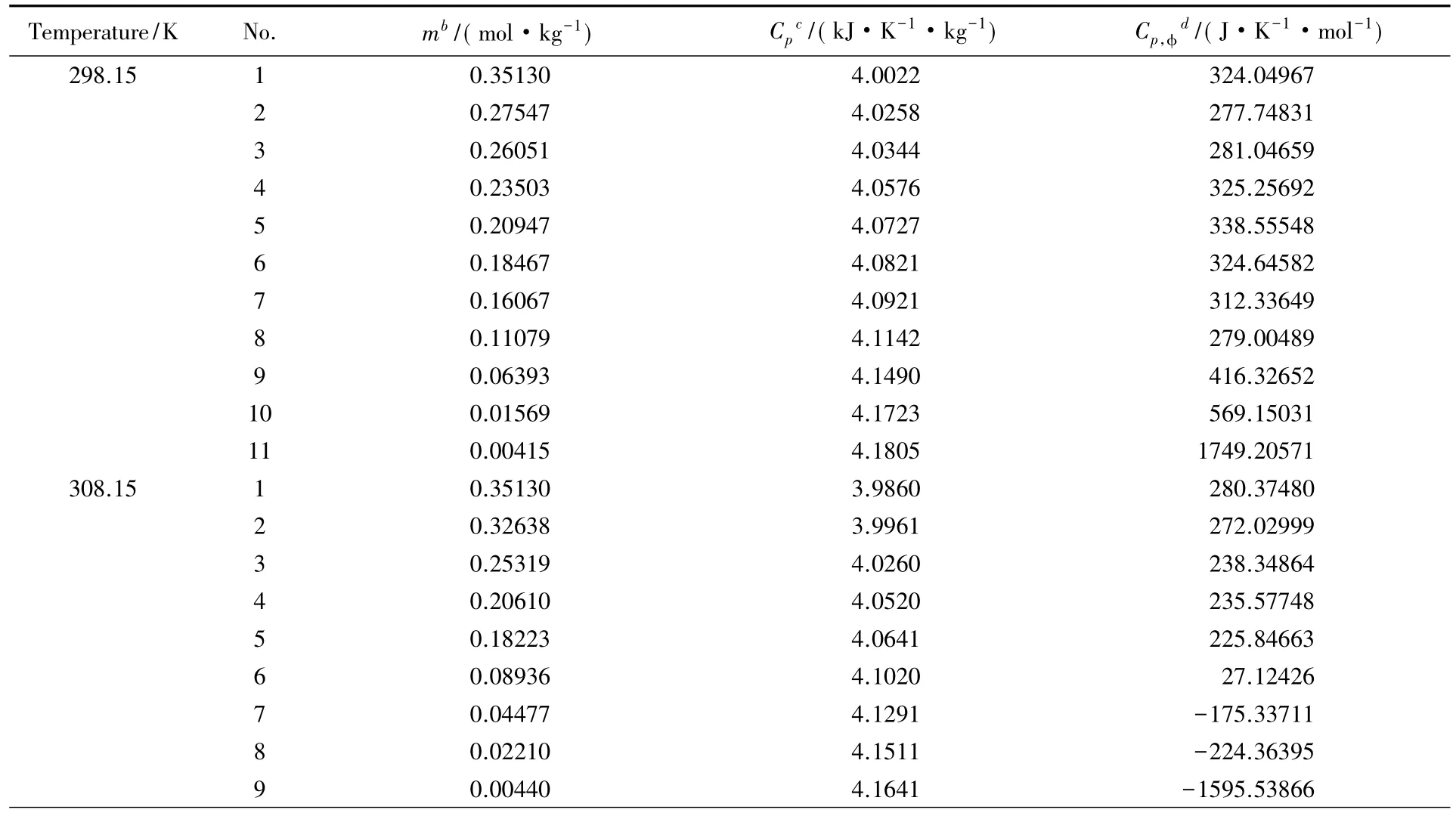
Table 1 Heat capacity and apparent molar heat capacity of Li2B4O7-H2O systema

Continued
根据同一温度下不同溶液浓度和表观摩尔热容的结果,拟合获得溶液浓度( m)与表观摩尔热容( Cp,Φ)的关系式为
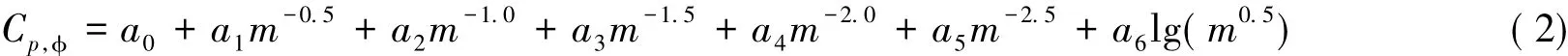
在298. 15,308. 15和323. 15 K时系数a0,a1,a2,a3,a4,a5,a6的值和标准偏差( SD)及复相关系数( r)的值见表2,可见拟合结果与实测结果吻合得很好.
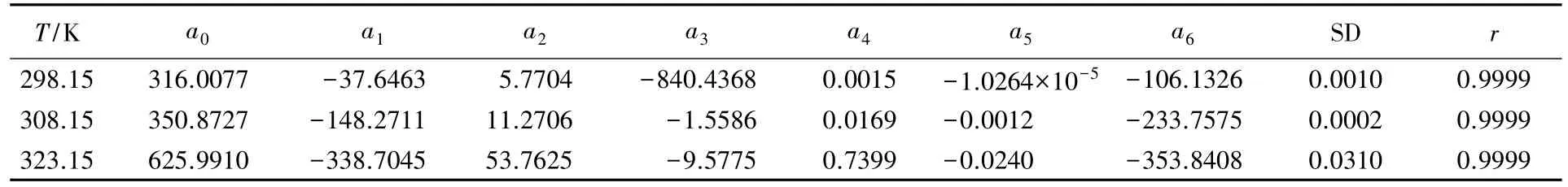
Table 2 Polynomial coefficients for the equations of m versus Cp,Φat different temperatures
以表观摩尔热容对浓度作图(见图1~图3).由图1可见,在298. 15 K下,随着Li2B4O7溶液浓度的增大,表观摩尔热容逐渐下降.当Li2B4O7溶液的浓度低于0. 01569 mol/kg时,表观摩尔热容随着浓度的增大急剧下降;当Li2B4O7溶液的浓度高于0. 01569 mol/kg时,表观摩尔热容趋于稳定.由图2和图3可见,在308. 15和323. 15 K下,随着Li2B4O7溶液浓度的增大,表观摩尔热容均逐渐升高,变化趋势与298. 15 K下的情况相反,其原因可能是四硼酸锂水溶液结构随温度不同而发生变化.
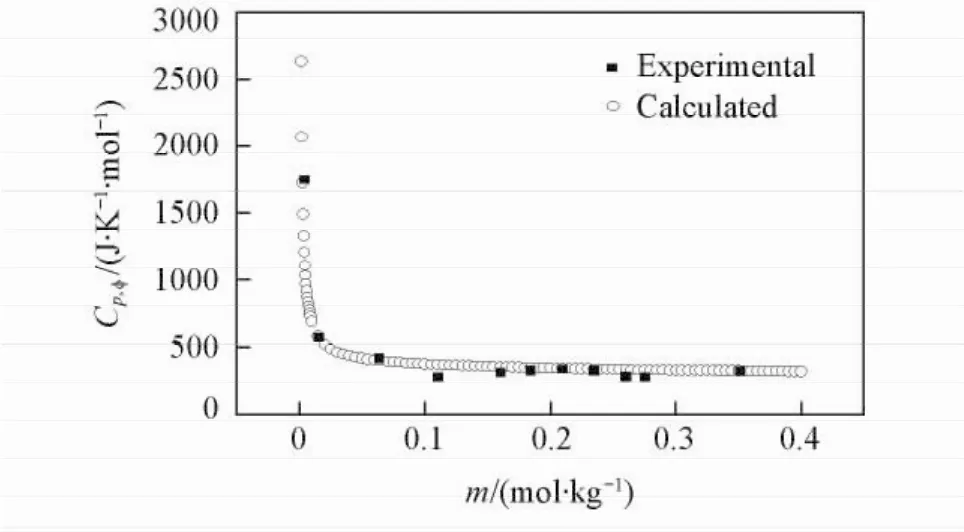
Fig.1 Relative apparent molar heat capacities of the system Li2B4O7-H2O versus m at 298. 15 K
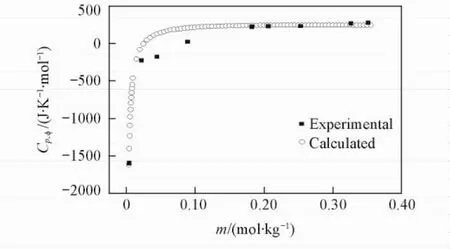
Fig.2 Relative apparent molar heat capacities of the system Li2B4O7-H2O versus m at 308. 15 K
2.2不同温度下Pitzer模型对表观摩尔热容的表达式
对于二元硼酸盐体系,考虑到溶液中的硼存在聚合或解聚现象,在原方程的基础上引入β( 2)系数项,Pitzer离子相互作用模型对表观摩尔热容的表达式变为[13]
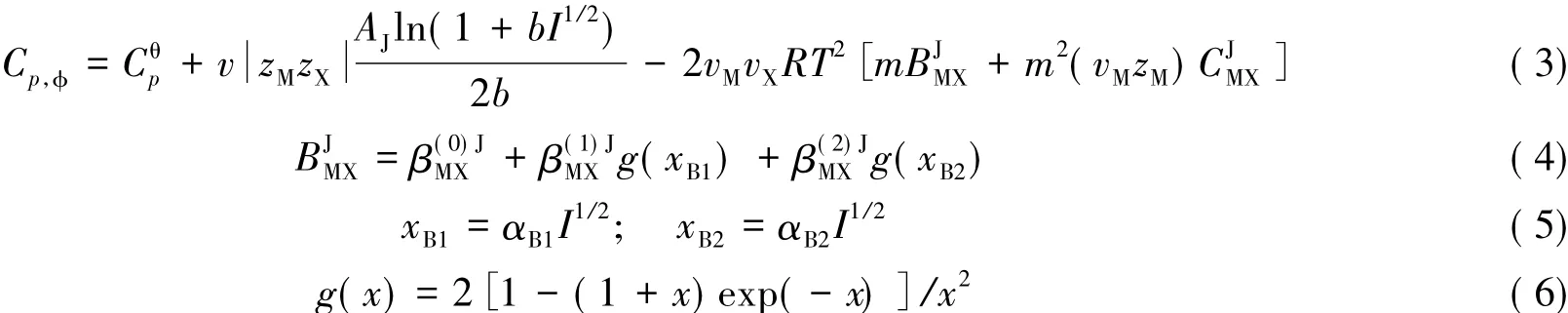
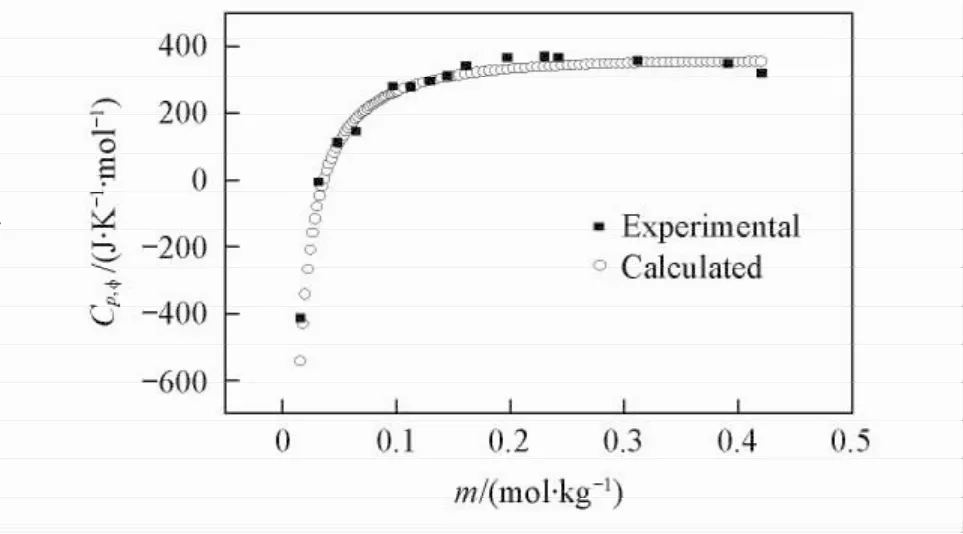
Fig.3 Relative apparent molar heat capacities of the system Li2B4O7-H2O versus m at 323. 15 K
根据Pitzer离子相互作用的表观摩尔热容模型方程,应用实验测定的Li2B4O7-H2O体系在不同温度下的热容及换算获得的表观摩尔热容,采用Fortran编程回归,分别针对不同温度进行多元拟合,获得不同温度下的四硼酸锂单盐参数,其中Pitzer表观摩尔热容方程中的常数项α1的值为1.4 kg1/2/mol1/2,α2值为28.0/( kg1/2·mol1/2).不同温度的表观摩尔热容Pitzer参数β,β,β和C值,模拟参数的标准偏差(σ),复相关系数( r)以及经实验数据最小拟合获四硼酸锂无限稀溶液时的表观热容C见表3,σ≤0.01285,r≥0.99847.
3 结 论
采用微量热仪测定了不同浓度四硼酸锂水溶液体系分别在298. 15,308. 15和323. 15 K下的热容,并算得了四硼酸锂体系在不同浓度下的表观摩尔热容,拟合出了298. 15,308. 15和323. 15 K下表观摩尔热容与浓度的关系式.结果表明,在298. 15 K下,溶液的表观摩尔热容随着浓度的增加而降低;而在308. 15和323. 15 K下,则随浓度的增加而增大.应用Pitzer电解质溶液离子相互作用表观摩尔热容模型拟合获得了四硼酸锂分别在298. 15,308. 15和323. 15 K下的Pitzer单盐参数,可为构建含硼酸锂的盐湖卤水体系相平衡预测化学模型提供热力学基础数据.
参考文献
[1]Xing N.,Shan H.,Song G.,Wei D.M.,Li G.H.,Shi Z.,Xing Y.H.,Chem.J.Chinese Universities,2013,34( 5),1041—1046(邢娜,单辉,宋鸽,魏东明,李光华,施展,邢永恒.高等学校化学学报,2013,34( 5),1041—1046)
[2]Gao S.Y.,Song P.S.,Xia S.P.,Zheng M.P.,Salt Lake Chemistry: A New Type Salt Lake of Borate and Lithium,Science Press,Beijing,2007,110(高世扬,宋彭生,夏树屏,郑绵平.盐湖化学:新类型硼锂盐湖,北京:科学出版社,2007,110)
[3]Cui R.Z.,Sang S.H.,Liu Q.Z.,Wang P.,Chem.Res.Chinese Universities,2014,30( 5),844—847
[4]Li T.,Sang S.H.,Cui R.Z.,Zhang K.J.,Chem.Res.Chinese Universities,2013,29( 2),311—313
[5]Zhang G.C.,Zhou C.S.,Gao S.L.,Acta Phys.Chim.Sin.,2013,29( 10),2129—2134(张国春,周春生,高胜利.物理化学学报,2013,29( 10),2129—2134)
[6]Li J.,Li B.,Gao S.J.,Chem.Thermody.,1998,30( 6),681—688
[7]Zhu L.X.,Gao S.Y.,Xia S.P.,Thermochim.Acta,2004,419( 1),105—108
[8]Li P.,Liu Z.H.,Chinese J.Chem.,2012,30( 4),847—853
[9]Li P.,Liu Z.H.,J.Chem.Eng.Data,2010,55( 8),2682—2686
[10]Zhang Z.H.,Tan Z.C.,Yin G.Y.,Yao Y.,Sun L.X.,Li Y.S.,J.Chem.Eng.Data,2007,52( 3),866—870
[11]Yin G.Y.,Studies on the Thermodynamics of the Systems Containing Boron and Lithium by Calorimetry,Qinghai Institute of Salt Lakes,Chinese Academy of Sciences,Xining,2005(尹国寅.含锂、硼水盐体系热力学性质的量热研究,西宁:中国科学院青海盐湖研究所,2005)
[12]Li J.C.,Zhai Z.X.,Zeng Z.M.,Wang L.Y.,J.Salt Lake Res.,1993,1( 4),34—38(李积才,翟宗玺,曾忠民,王鲁英.盐湖研究,1993,1( 4),34—38)
[13]Yin S.T.,Yao Y.,Li B.,Tian H.B.,Song P.S.,J.Solution Chem.,2007,36( 12),1745—1761
Heat Capacities and Ion-interaction of Lithium Tetraborate Aqueous Solution System†
LI Long,ZHANG Sisi,LIU Yuanhui,GUO Yafei,DENG Tianlong*
( Tianjin Key Laboratory of Marine Resources and Chemistry,College of Chemical Engineering and Material Sciences,Tianjin University of Science and Technology,Tianjin 300457,China)
Abstract The heat capacities of aqueous solution systems( Li2B4O7-H2O) with molality of Li2B4O7of 0.00415—0. 4208 mol/kg at 298.15,308.15 and 323.15 K were determined experimentally using microcalorimeter.On the basis of experimental data,the apparent molar heat capacities at different concentrations and temperatures were calculated,and the relationship equations between apparent molar heat capacity and solution concentration of lithium tetraborate at 298.15,308.15 and 323.15 K were obtained.The Pitzer single salt parameters of lithium tetraborate at different temperatures were fitted based on the Pitzer ion-interaction theory on the apparent molar heat capacity of electrolytes.
Keywords Lithium tetraborate; Heat capacity; Calorimetric method; Electrolyte solution; Pitzer single salt parameter
( Ed.: S,Z,M)
†Supported by the National Natural Science Foundation of China( Nos.21306136,U1407113),the Training Program for Yangtze Scholars and Innovative Research Team in University,China( No.[2013]373) and the Innovative Research Team of Tianjin Municipal Education Commission,China( No.TD12-5004).
基金项目:国家自然科学基金(批准号: 21306136,U1407113)、教育部科研创新团队培育计划项目(批准号:[2013]373)和天津市科研创新团队项目(批准号: TD12-5004)资助.
收稿日期:2015-07-29.网络出版日期: 2016-01-14.
doi:10.7503/cjcu20150594
中图分类号O642.3
文献标志码A
联系人简介:邓天龙,男,博士,教授,主要从事溶液化学研究.E-mail: tldeng@ tust.edu.cn
