基于1,8-萘酰亚胺与罗丹明B间荧光共振能量转移的高选择性Hg2+比率荧光探针
2016-03-21陈家逸王恩举
陈家逸,苏 伟,王恩举
(海南师范大学化学与化工学院,海口571158)
基于1,8-萘酰亚胺与罗丹明B间荧光共振能量转移的高选择性Hg2+比率荧光探针
陈家逸,苏伟,王恩举
(海南师范大学化学与化工学院,海口571158)
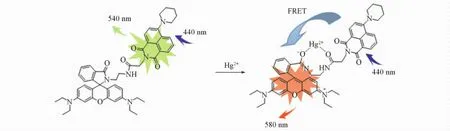
摘要以罗丹明B与1,8-萘二甲酰亚胺反应合成了1个高选择性Hg2+比率荧光探针( RN).在甲醇/乙腈/ 4-羟基哌嗪乙磺酸缓冲溶液( pH=7. 2,体积比8∶1∶1)中,RN对Hg2+具有比色和比率荧光双重响应.加入Hg2+后,RN的紫外-可见光谱在约556 nm处产生强吸收,溶液由浅绿色变为橙色,其它金属离子对RN的紫外-可见光谱几乎无影响.无Hg2+存在时,RN的荧光光谱在540 nm处出现萘二甲酰亚胺荧光团的特征峰;加入Hg2+后,540 nm处的发射带逐渐消失,同时在580 nm附近产生强荧光,荧光颜色从绿色变为橙色.这归因于从萘酰亚胺到开环罗丹明B的荧光共振能量转移( FRET),探针RN对Hg2+的比率荧光响应具有高选择性,不受其它共存金属离子的干扰.
关键词罗丹明B; 1,8-萘二甲酰亚胺;荧光共振能量转移; Hg2+;比率荧光探针
汞是最危险的金属污染物之一,主要通过空气流动传播,沉入水中后可通过水生食物链快速累积,水生食物链顶端捕食者(如鲨鱼、金枪鱼)体内富集的汞可达水体汞浓度的几十万倍.因此,发展高选择性、高灵敏度的Hg2+检测方法对环境保护和人体健康至关重要.近年来已开发出多种性能优异的Hg2+荧光探针[1~4].与普通荧光探针相比,比率荧光探针涉及2个波长荧光强度的变化,可以更有效地避免来自环境的干扰.分子内电荷转移( ICT)和荧光共振能量转移( FRET)是2种最常用于设计比率荧光探针的传感机制.基于ICT机制的比率荧光探针,2个荧光发射带的波长差一般较小,经常出现两者重叠的现象,可导致荧光强度比率测量的误差.FRET型比率荧光探针更易避免2个荧光发射带的重叠,因此被广泛应用于比率荧光探针的设计[5~8].
罗丹明类荧光染料不但具有摩尔消光系数大、荧光量子产率高、激发波长和发射波长均较长的优点,而且具有基于开环-螺环结构转换的荧光开-关机制.当罗丹明处于螺环结构时,无色且无荧光,而在H+或某些金属阳离子作用下,可形成开环结构并发射强荧光,同时在自然光下呈现出颜色.即该类荧光探针既属于“off-on”型荧光探针,又是肉眼可视的比色探针.因此,罗丹明类分子被广泛应用于金属离子的检测[9~13].近年来,一系列基于罗丹明的高选择性Hg2+荧光探针被相继报道[14~21].萘酰亚胺类物质也是一类常见的荧光团,其发射光谱与罗丹明B的吸收光谱有部分重叠,因此两者间可发生荧光共振能量转移[22~25].本文通过1个酰胺链将两者连接起来,合成了以1,8-萘二甲酰亚胺为能量供体,以罗丹明B为能量受体的FRET型荧光探针,并研究了其对Hg2+的传感行为.
1 实验部分
1.1试剂与仪器
罗丹明B、1,8-萘二甲酰亚胺、1-羟基苯并三氮唑( HOBT)、1-乙基-( 3-二甲基氨基丙基)碳二亚胺盐酸盐( EDCI)和4-羟乙基哌嗪乙磺酸( HEPES)均购自上海晶纯试剂有限公司;测试所用金属离子均为相应的硝酸盐(上海晶纯试剂有限公司).
Bruker-400型核磁共振波谱仪( TMS为内标,CDCl3为溶剂)和Bruker esquire HCT型质谱仪(德国Bruker公司) ; Hitachi F-7000型荧光光谱仪(日本Hitachi公司) ; TU-1901型分光光度计(北京普析通用仪器有限责任公司).
1.2荧光探针RN的合成
荧光探针RN的合成路线见Scheme 1.

Scheme 1 Synthetic approach for RN
参考文献[26]方法合成化合物1,产率80%.ESI-MS( C30H36N4O2理论值),m/z: 485. 2( 485. 28) [M+H]+. [27,28]方法合成化合物2,产率78%.1H NMR( 400 MHz,DMSO-d6),δ: 8. 45( d,1H,J=8. 0 Hz),8. 40( d,1H,J=8. 0 Hz),8. 36( d,1H,J=8. 0 Hz),7. 80( t,1H,J=8. 0 Hz),7. 28( d,1H,J=8. 0 Hz),4. 71( s,2H),3. 20( m,4H),1. 82( m,4H),1. 66( m,2H) ; ESI-MS( C19H18N2O4理论值),m/z: 337. 2( 337. 13)[M-H]-.
化合物RN的合成:将化合物1( 0. 17 g,0. 5 mmol)、化合物2( 0. 24 g,0. 5 mmol)和HOBT( 0. 10 g,0. 7 mmol)溶于15 mL二氯甲烷,于0℃搅拌30 min后加入EDCI( 0. 19 g,1. 0 mmol),在氮气保护下继续低温搅拌60 min,逐渐升至室温再搅拌反应10 h.用水洗涤3次,待有机层干燥后,减压蒸干得0. 38 g黄色固体,用硅胶柱层析纯化[展开剂: V(石油醚)∶V(乙酸乙酯) = 1∶1]得到0. 32 g化合物RN,淡黄色粉末,产率78. 0%.1H NMR( 400 MHz,CDCl3),δ: 8. 55( d,1H,J = 8. 0 Hz),8. 47( d,1H,J=8. 0 Hz),8. 46( d,1H,J=8. 0 Hz),7. 70( t,1H,J=8. 0 Hz),7. 42( br,1H),7. 38( t,1H,J= 8. 0 Hz),7. 25( t,1H,J=8. 0 Hz),7. 19( d,1H,J=8. 0 Hz),7. 01( d,2H,J=8. 0 Hz).6. 37( d,2H,J=8. 8 Hz),6. 36( s,2H),6. 29( d,2H,J= 8. 8 Hz),4. 77( s,2H),3. 32( q,8H,J= 6. 8 Hz).3. 28 ( m,6H),1. 92( m,4H),1. 75( m,4H),1. 15( t,12H,J=6. 8 Hz) (1H NMR谱图见本文支持信息图S1) ;13C NMR( 100 MHz,CDCl3),δ: 170. 0,167. 5,164. 6,164. 0,157. 5,153. 9,153. 1,149. 0,132. 9,132. 6,131. 2,130. 7,130. 5,129. 9,128. 5,127. 7,126. 4,125. 4,123. 7,123. 4,122. 6,116. 2,114. 8,108. 5,104. 6,97. 7,65. 5,54. 7,44. 4,43. 3,41. 3,39. 1,26. 3,24. 4,12. 6(13C NMR谱图见本文支持信息图S2) ; ESI-MS,m/z: 805. 4[M+H]+(图谱见本文支持信息图S3).
1.3 Hg2+荧光试纸的制备及应用
将普通滤纸( 1 cm×4 cm)浸泡在RN的二氯甲烷溶液( 1×10-3mol/L)中,1 min后取出晾干即得所需试纸.用喷雾小瓶将待检样品水溶液均匀喷到滤纸上,在60℃烘箱中加热5 min,在紫外暗箱中于365 nm紫外光下观察.
2 结果与讨论
2.1比色法研究RN对Hg2+的选择性响应
在甲醇/乙腈/HEPES缓冲溶液( 50 mmol HEPES,pH=7. 2,体积比为8∶1∶1)中进行紫外-可见光谱测试.由Hg2+对RN紫外-可见光谱[图1( A)]的影响可知,当不存在Hg2+时,RN的最大吸收波长为412 nm,随着Hg2+浓度的增大,在556 nm附近出现1个新的吸收带.当Hg2+浓度在10~80 μmol/L范围内时,吸光度随着Hg2+浓度线性增加,当Hg2+浓度达到探针RN浓度的10倍时,吸光度达到最大[图1( B)].以吸光度对较低Hg2+浓度作线性相关图[图1( C)],由公式LOD=3σ/k计算得RN对Hg2+的紫外检出限为4. 5×10-7mol/L.其它金属离子( Al3+,Na+,Mn2+,Co2+,Ni2+,Cu2+,Cr3+,Ag+,Pb2+,Zn2+,Cd2+,Fe2+和Fe3+)对RN的吸收波长和吸收强度都没有明显影响[图2( A)],只有Hg2+能使RN溶液的颜色由淡绿色变为橙色[图2( B)].RN的吸收光谱和溶液颜色的变化归因于Hg2+致使罗丹明B螺环结构开环.

Fig.1 UV-Vis spectra of RN( 10 μmol/L) under different conditions( B) Effect of Hg2+concentration at 556 nm; ( C) with different concentrations of Hg2+( 1,2,3,4 and 5 μmol/L) at 556 nm.

Fig.2 UV-Vis spectra( A) and color changes of RN( 10 μmol /L) ( B)( A) With different metal ions,c( metal ions) =100 μmol /L; ( B) addition of Hg2+under natural light,a. only RN,b. addition of Hg2+( 100 μmol /L) ,c.addition of a mixture of Al3+,Na+,Mn2+,Co2+,Ni2+,Cu2+,Cr3+,Ag+,Pb2+,Zn2+,Cd2+,Fe2+and Fe3+,each concentration was 100 μmol /L.
2.2比率荧光法检测Hg2+
在甲醇/乙腈/HEPES缓冲溶液( 50 mmol HEPES,pH= 7. 2,体积比为8∶1∶1)中进行荧光测试,激发波长为440 nm.探针RN对不同浓度Hg2+的荧光响应见图3( A),当不存在Hg2+时,RN的最大发射波长为540 nm,为探针萘酰亚胺部分的发射带.随着Hg2+的加入,该发射带的强度逐渐减小,同时,在580 nm处出现1个新的发射峰,随着Hg2+的增多逐渐增强.荧光颜色从绿色变为橙色(图3插图).这归因于Hg2+引起罗丹明B螺环结构开环,开环的罗丹明B在580 nm产生强荧光,此荧光发射的激发光谱(即开环罗丹明B的吸收光谱,490~580 nm,图1)与萘酰亚胺的发射光谱( 500~600 nm)存在部分重叠( 500~580 nm),发生了从萘酰亚胺到开环罗丹明B的荧光共振能量转移.以荧光强度对较低Hg2+浓度作线性相关图[图3( B)],由公式LOD= 3σ/k计算得RN对Hg2+的荧光检出限为1. 05×10-8mol/L.实验发现,加入Hg2+不能立即引起探针RN的颜色和荧光发生变化,这可能是由于罗丹明螺环结构开环需要一定的反应时间所致.为此,测定了荧光比率( F580/F540)随时间的变化关系.由图4可见,加入Hg2+后0~10 min内,荧光比率几乎线性增大,10 min后基本趋于稳定,14 min后达到极大值.升高温度有利于罗丹明的开环反应,从而可以显著提高探针的响应速度,在50℃下Hg2+引起的颜色和荧光变化在1 min内即可完成.

Fig.3 Fluorescence spectra of RN( 10 μmol/L)( A) c( Hg2+) /(μmol·L-1),a—k: 0,10,20,30,40,50,60,70,80,90,100.λex=440 nm.Inset: a and b represent colors of RN solution( 10 μmol/L) before and after the addition of Hg2+( 100 μmol/L) in dark-box ultraviolet analyzer when excited at 365 nm,respectively; ( B) fluorescent intensities ratio( I580 nm/I540 nm) as a function of Hg2+( 0,1,2,3 and 4 μmol/L).

Fig.4 Time-dependent ratiometric fluorescence responses of 10 μmol/L RN to 100 μmol/L Hg2+

Fig.5 pH-dependent fluorescence ratios( F580/F540) of RN in the absence( a) and presence( b) of Hg2+
众所周知,不但某些金属阳离子可以使罗丹明发生开环反应,酸性条件下H+也能打开罗丹明的螺环结构,使其发出强荧光[10].因此,有必要考察环境酸度对RN荧光传感Hg2+的影响.RN的荧光比率( F580/F540)随溶液pH变化曲线如图5所示.在加入Hg2+前,当pH<6时,荧光比率随pH值的减小而快速增加.这是由于H+导致罗丹明的螺环结构发生开环反应.加入Hg2+后,当pH>7时,荧光比率随pH的增加迅速减小,这可能是由于在碱性条件下OH-与RN竞争结合Hg2+,失去Hg2+后,螺环开环的罗丹明B重新关环,同时荧光失活.当pH≥10时,比率荧光达到最小值,RN完全失去对Hg2+的传感能力.可见,RN对Hg2+产生比率荧光响应的最佳pH值为6~7,但pH值在6~8的范围内均可产生足够强的比率荧光信号.
2.3 RN对Hg2+的选择性
荧光探针RN对各种金属离子的荧光响应如图6所示.可见,只有加入Hg2+才能引起540 nm处吸收峰的减弱,并在580 nm处产生新的吸收峰,其它金属离子( Al3+,Na+,Mn2+,Co2+,Ni2+,Cu2+,Cr3+,Ag+,Pb2+,Zn2+,Cd2+,Fe2+和Fe3+)对RN的荧光光谱几乎没有影响.
为了进一步评估探针RN在复杂环境中对Hg2+的选择性,在Hg2+样品中加入其它金属离子,考察这些离子对Hg2+测试的干扰.由图7可知,Hg2+引起的荧光响应并没有受到其它共存离子的干扰,因此,比率荧光探针RN对Hg2+具有特异性响应.

Fig.7 Selective responses of RN( 10 μmol/L) to Hg2+( 100 μmol/L) in the presence of different cations ( 200 μmol/L)a.None; b.Al3+; c.Na+; d.Mn2+; e.Co2+; f.Ni2+; g.Cu2+; h.Cr3+; i.Ag+; j.Pb2+; k.Zn2+; l.Cd2+; m.Fe3+; n.Fe2+.

Fig.8 ESI-MS of RN in the presence of Hg2+and trace amounts of Cl-Inset: observed( left) and calculated( right) isotopic patterns for the[RN+Hg+Cl]+.
2.4罗丹明的开环机制
金属离子引起罗丹明螺环开环从而激活其强荧光主要有3种方式,相应地存在以下3类探针: ( 1)反应型荧光化学计量器[29]; ( 2)普通配位型荧光探针[30,31]; ( 3)配位开环并进一步催化酰胺键水解[32].为了探究RN对Hg2+的传感机制,测定了Hg2+存在下RN的电喷雾质谱.结果表明,在m/z 500~2000的范围内,最强峰始终是游离态RN的分子离子峰( m/z=805. 4[RN+1]+),并未发现其它强峰.位于m/z 502. 7处的弱峰可能归属为结合常数较小的双电荷配合物[RN+Hg]2+(质谱图见本文支持信息中图S4).为了确证该离子峰的归属,向试样中加入极微量的Cl-,一方面,Cl-可以中和掉Hg2+的1个正电荷,另一方面,两者的强配位作用使RN与Hg2+的配位作用得到协同加强,从而得到比较稳定的单电核正离子[RN+Hg+Cl]+.在m/z 1041. 5附近较强的离子峰群归属为[RN+Hg+Cl]+(理论值为m/z 1041. 34),模拟图与实测图具有较高的吻合度(见图8).因此,RN与Hg2+形成了1∶1的配合物,但两者之间的配位作用比较弱.在此基础上提出了RN与Hg2+作用的可能机制( Scheme 2).
Scheme 2 Proposed Hg2+-sensing mechanism of RN
2.5 Hg2+试纸的制备及应用
为进一步拓展该荧光探针的实用性,采用浸渍法将RN负载到滤纸上制备成试纸,研究了该试纸对Hg2+的检测性能.在喷涂Hg2+溶液前,试纸在365 nm光照射下呈绿色荧光;喷涂Hg2+溶液后,试纸荧光变为橙色.随着Hg2+浓度的增加,荧光颜色逐渐加深,荧光强度逐渐加强(见图9).为了评价该试纸对实际环境样品的检测性能,取海口市红城湖的湖水,过滤后用其代替蒸馏水配制Hg2+样品.结果表明,在365 nm光照射下,试纸对该样品呈现类似的橙色荧光响应,与蒸馏水Hg2+样品引起的橙色荧光无明显区别(见图9).
综上所述,通过酰胺缩合反应将2个常用的荧光化合物罗丹明B与1,8-萘酰亚胺连接起来,合成了1个高选择性的Hg2+比率荧光探针( RN),其比率荧光的形成基于从萘酰亚胺到开环罗丹B的分子内荧光共振能量转移( FRET)机制.在甲醇/乙腈/4-羟乙基哌嗪乙磺酸( HEPES)缓冲溶液( pH = 7. 2)中,于440 nm光激发下探针RN发射波长为540 nm的绿色荧光,确认为探针萘酰亚胺部分的荧光发射.加入Hg2+后,探针RN发射波长为580 nm的橙色强荧光,同时萘酰亚胺的绿色荧光逐渐消失,荧光变化不受其它共存离子的干扰.同时,Hg2+的存在可引起探针的紫外-可见光谱在556 nm附近产生强吸收,溶液颜色由浅绿色变为橙色,其它金属离子对探针RN的吸收光谱几乎没有任何影响.因此,RN是一个对Hg2+具有比色和比率荧光双重响应的高选择性探针.

Fig.9 Test papers after being sprayed with Hg2+in watera.None; b.5. 0×10-5mol/L; c.1. 0×10-4mol/L; d.5. 0× 10-4mol/L; e.1. 0×10-4mol/L in filtered lake water.
支持信息见http: / /www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20150563.
[1]Selid P.D.,Xu H.,Collins E.M.,Striped Face-Collins M.,Zhao J.X.,Sensors,2009,9,5446—5459
[2]Ou S.,Lin Z.,Duan C.,Zhang H.,Bai Z.,Chem.Commun.,2006,42,4392—4394
[3]Yoon S.,Miller E.W.,He Q.,Do P.H.,Chang C.J.,Angew.Chem.Int.Ed.,2007,46,6658—6661
[4]Yang H.,Hu Q.,Ma G.,Chen G.,Tao M.,Zhang W.,Chem.Res.Chinese Universities,2014,30( 6),910—914
[5]Yuan L.,Lin W.,Zhang K.,Zhu S.,Acc.Chem.Res.,2013,46,1462—1473
[6]Qiao B.,Sun S.,Jiang N.,Zhang S.,Peng X.,Dalton Trans.,2014,43,4626—4630
[7]Kaewtong C.,Niamsa N.,Wanno B.,Morakot N.,Pulpokab B.,Tuntulani T.,New J.Chem.,2014,38,3831—3839
[8]He G.,Zhang X.,He C.,Zhao X.,Duan C.,Tetrahedron,2010,66,9762—9768
[9]Chen X.,Pradhan T.,Wang F.,Kim J.S.,Yoon J.,Chem.Rev.,2012,112,1910—1956
[10]Kim H.N.,Lee M.H.,Kim H.J.,Kim J.S.,Yoon J.,Chem.Soc.Rev.,2008,37,1465—1472
[11]Xu H.,Dai Y.N.,Shan H.Y.,Fei Q.,Huan Y.F.,Li G.H.,Feng G.D.,Chem.J.Chinese Universities,2014,35( 4),736—740(徐惠,代艳娜,单洪岩,费强,郇延富,李光华,冯国栋.高等学校化学学报,2014,35( 4),736—740)
[12]Beija M.,Afonso C.A.M.,Martinho J.M.G.,Chem.Soc.Rev.,2009,38,2410—2433
[13]Wu D.,Huang W.,Duan C.,Lin Z.,Meng Q.,Inorg.Chem.,2007,46,1538—1540
[14]Wang H.,Li Y.,Xu S.,Li Y.,Zhou C.,Fei X.,Sun L.,Zhang C.,Li Y.,Yang Q.,Xu X.,Org.Biomol.Chem.,2011,9,2850—2855
[15]Yang Z.,Hao L.,Yin B.,She M.,Obst M.,Kappler A.,Li J.,Org.Lett.,2013,15,4334—4337
[16]Lin W.,Cao X.,Ding Y.,Yuan L.,Yu Q.,Org.Biomol.Chem.,2010,8,3618—3620
[17]Zhang X.,Huang X.J.,Zhu Z.J.,RSC Adv.,2013,3,24891—24895
[18]Zhan X.Q.,Qian Z.H.,Zheng H.,Su B.Y.,Lan Z.,Xu J.G.,Chem.Commun.,2008,16,1859—1861
[19]Lin W.,Cao X.,Ding Y.,Yuan L.,Yu Q.,Org.Biomol.Chem.,2010,8,3618—3620
[20]He S.,Liu Q.,Li Y.,Wei F.,Cai S.,Lu Y.,Zeng X.,Chem.Res.Chinese Universities,2014,30( 1),32—36
[21]Biswala B.,Bag B.,Org.Biomol.Chem.,2013,11,4975—4992
[22]Zhou Z.,Yu M.,Yang H.,Huang K.,Li F.,Yi T.,Huang C.,Chem.Commun.,2008,29,3387—3389
[23]Wang Q.,Li C.,Zou Y.,Wang H.,Yi T.,Huang C.,Org.Biomol.Chem.,2012,10,6740—6746
[24]Mahato P.,Saha S.,Suresh E.,Liddo R.D.,Parnigotto P.P.,Conconi M.T.,Kesharwani M.K.,Ganguly B.,Das A.,Inorg.Chem.,2012,51,1769—1777
[25]Wang C.,Zhang D.,Huang X.,Ding P.,Wang Z.,Zhao Y.,Ye Y.,Sens.Actuat.B,Chem.,2014,198,33—40
[26]Bao X.,Shi J.,Nie X.,Zhou B.,Wang X.,Zhang L.,Liao H.,Pang T.,Bioorg.Med.Chem.,2014,22,4826—4835
[27]Dai H.,Xu H.,Bioorg.Med.Chem.Lett.,2011,21,5141—5144
[28]Li C.Y.,Xu F.,Li Y.F.,Zhou K.,Zhou Y.,Anal.Chim.Acta,2012,717,122—126
[29]Liu Y.,Lv X.,Zhao Y.,Chen M.,Liu J.,Wang P.,Guo W.,Dyes Pigments,2012,92,909—915
[30]Kim H.N.,Lee M.H.,Kim H.J.,Kim J.S.,Yoon J.,Chem.Soc.Rev.,2008,37,1465—1472
[31]Chen Y.,Zhang Y.,Zeng X.,Mu L.,Li J.,Sun Q.,Zhang J.X.,Wei G.,Chem.J.Chinese Universities,2013,34( 7),1598—1605(陈义,张艳,曾晞,牟兰,李俊,孙强,张建新,卫钢.高等学校化学学报,2013,34( 7),1598—1605)
[32]Dujols V.,Ford F.,Czarnik A.W.,J.Am.Chem.Soc.,1997,119,7386—7387
Highly Selective Ratiometric Fluorescent Probe for Hg2+
Based on Fluorescence Resonance Energy Transfer
Between 1,8-Naphthalimide and Rhodamine B†
CHEN Jiayi,SU Wei,WANG Enju*
( School of Chemistry&Chemical Engineering,Hainan Normal University,Haikou 571158,China)
†Supported by the National Natural Science Foundation of China( No.21162010).
Abstract A ratiometric fluorescent probe( RN) was developed based on rhodamine B and 1,8-naphthalimide which were linked together by an amido linkage.In CH3OH/CH3CN/HEPES buffer solution( pH=7. 2),free RN showed absorption maximum at 412 nm.The presence of Hg2+could induce an intensive absorption at 556 nm.The change of absorption spectrum resulted in a color change from light green to orange in response to Hg2+.Significantly,the probe RN gave rise to a ratiometric fluorescent response to Hg2+.Upon the addition of Hg2+,a significant fluorescence enhancement at 580 nm and meanwhile the gradual disappearance of the emission at 540 nm were observed,which were ascribed to the fluorescence resonance energy transfer( FRET) from 1,8-naphthalimide moiety to the ring-opened rhodamine B moiety.Accompanying the change of fluorescence spectra,the significant fluorescence color changed from green to orange occurred,which could be used for naked-eye detection of Hg2+.The ratiometric fluorescence signal for Hg2+was not affected by other coexisting mental ions.
KeywordsRhodamine B; 1,8-Naphthalimide; Fluorescence resonance energy transfer; Hg2+; Ratiometric fluorescent probe
( Ed.: P,H,N,K)
基金项目:国家自然科学基金(批准号: 21162010)资助.
收稿日期:2015-07-20.网络出版日期: 2015-12-26.
doi:10.7503/cjcu20150563
中图分类号O657
文献标志码A
联系人简介:王恩举,男,博士,教授,主要从事荧光传感方面的研究.E-mail: enjuwang@ 163.com
